3.5: Minerales sin Silicatos
- Page ID
- 88580
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La estructura cristalina de minerales no silicatos (ver tabla) no contiene tetraedros de sílice-oxígeno. Muchos minerales no silicatos son económicamente importantes y proporcionan recursos metálicos como cobre, plomo y hierro. También incluyen valiosos productos no metálicos como sal, materiales de construcción y fertilizantes.
| Grupo Mineral | Ejemplos | Fórmula | Usos |
|---|---|---|---|
| Elementos nativos | oro, plata, cobre | Au, Ag, Cu | Joyería, monedas, industria |
| Carbonatos | calcita, dolomita | CaCo 3, CaMg (CO 3) 2 | Cal, cemento Portland |
| Óxidos | hematita, magnetita, bauxita | Fe 2 O 3, Fe 3 O 4, una mezcla de óxidos de aluminio | Minerales de hierro y aluminio, pigmentos |
| Halogenuros | halita, sylvita | NaCl, KCl | Sal de mesa, fertilizante |
| Sulfuros | galena, calcopirita, cinabrio | PBS, CuFes 2, HG | Minerales de plomo, cobre, mercurio |
| Sulfatos | yeso, sales de epsom | CaSO 4 ·2H 2 O, MgSO 4 ·7H 2 O | Sheetrock, remojo terapéutico |
| Fosfatos | apatita | Ca 5 (PO 4) 3 (F, Cl, OH) | Fertilizante, dientes, huesos |
Carbonatos


La calcita (CaCo 3) y la dolomita (CaMg (CO 3) 2) son los dos minerales carbonatados que ocurren con mayor frecuencia, y generalmente ocurren en rocas sedimentarias, como rocas calizas y rocas dolostone, respectivamente. Algunas rocas carbonatadas, como la calcita y la dolomita, se forman por evaporación y precipitación. Sin embargo, la mayoría de las rocas ricas en carbonato, como la piedra caliza, son creadas por la litificación de organismos marinos fosilizados. Estos organismos, incluyendo los que podemos ver y muchos organismos microscópicos, tienen conchas o exoesqueletos que consisten en carbonato de calcio (CaCo 3). Cuando estos organismos mueren, sus restos se acumulan en el suelo del cuerpo de agua en el que viven y las partes blandas del cuerpo se descomponen y se disuelven. Las partes duras de carbonato de calcio se incluyen en los sedimentos, convirtiéndose finalmente en la roca sedimentaria llamada piedra caliza. Si bien la piedra caliza puede contener fósiles grandes y fáciles de ver, la mayoría de las calizas contienen restos de criaturas microscópicas y, por lo tanto, se originan en procesos biológicos.

Los cristales de calcita muestran una propiedad interesante llamada birrefringencia, lo que significa que polarizan la luz en dos componentes de onda que vibran en ángulo recto entre sí. A medida que las dos ondas de luz pasan a través del cristal, viajan a diferentes velocidades y se separan por refracción en dos caminos de viaje diferentes. En otras palabras, el cristal produce una doble imagen de objetos vistos a través de él. Debido a que polarizan la luz, los cristales de calcita se utilizan en microscopios petrográficos especiales para estudiar minerales y rocas.
Muchos minerales no silicatos se conocen como sales. El término sales que se usa aquí se refiere a compuestos elaborados reemplazando el hidrógeno en ácidos naturales. El ácido natural más abundante es el ácido carbónico que se forma por la solución de dióxido de carbono en el agua. Los minerales carbonatados son sales construidas alrededor del ion carbonato (CO3 -2) donde el calcio y/o magnesio reemplazan al hidrógeno en el ácido carbónico (H 2 CO 3). La calcita y el aragonita polimorfo estrechamente relacionado son secretadas por los organismos para formar conchas y estructuras físicas como los corales. Muchas de esas criaturas extraen calcio y carbonato de iones de bicarbonato disueltos (HCO 3 —) en el agua del océano. Como se ve en la sección de identificación mineral a continuación, la calcita se disuelve fácilmente en ácido y así se efervescente en ácido clorhídrico diluido (HCl). Los pequeños frascos cuentagotas de ácido clorhídrico diluido a menudo son transportados por geólogos en el campo, así como utilizados en laboratorios de identificación de minerales.
Otras sales incluyen halita (NaCl) en la que el sodio reemplaza al hidrógeno en ácido clorhídrico y yeso (Ca [SO 4] • 2 H 2 O) en el que el calcio reemplaza al hidrógeno en ácido sulfúrico. Tenga en cuenta que algunas moléculas de agua también están incluidas en el cristal de yeso. Las sales a menudo se forman por evaporación y se llaman minerales evaporíticos.
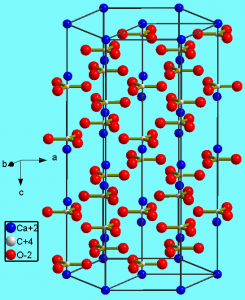
La figura muestra la estructura cristalina de la calcita (CaCo 3). Al igual que el silicio, el carbono tiene cuatro electrones de valencia. La unidad de carbonato consiste en átomos de carbono (pequeños puntos blancos) unidos covalentemente a tres átomos de oxígeno (rojo), uno de oxígeno que comparte dos electrones de valencia con el carbono y los otros dos comparten un electrón de valencia cada uno con el carbono, creando así unidades triangulares con una carga de -2. La unidad de carbonato cargada negativamente forma un enlace iónico con el ion Ca (azul), que como una carga de +2.
Óxidos, haluros y sulfuros

Después de los carbonatos, los siguientes minerales no silicatos más comunes son los óxidos, haluros y sulfuros.
Los óxidos consisten en iones metálicos unidos covalentemente con oxígeno. El óxido más familiar es el óxido, que es una combinación de óxidos de hierro (Fe 2 O 3) y óxidos hidratados. Los óxidos hidratados se forman cuando el hierro se expone al oxígeno y al agua. Los óxidos de hierro son importantes para producir hierro metálico. Cuando se funde óxido o mineral de hierro, produce dióxido de carbono (CO 2) y hierro metálico.
El color rojo en las rocas suele deberse a la presencia de óxidos de hierro. Por ejemplo, los acantilados de arenisca roja en el Parque Nacional Zion y en todo el sur de Utah consisten en granos blancos o incoloros de cuarzo recubiertos con óxido de hierro que sirven como agentes cementantes que mantienen unidos los granos.
![Fuente: Por Dave Dyet http://www.shutterstone.com http://www.dyet.com (Obra propia) [Dominio público], <a data-cke-saved-href=” https://commons.wikimedia.org/wiki/File%3AHematite_-_oolitic_with_shale_Iron_Oxide_Clinton%2C_Oneida_County%2C_New_York.jpg "href=” https://commons.wikimedia.org/wiki/File%3AHematite_-_ Oolitic_con_shale_iron_oxide_clinton%2C_oneida_county%2C_new_york.jpg" Una forma roja de hematita llamada oolítica que muestra una masa de pequeños nódulos redondos](http://opengeology.org/textbook/wp-content/uploads/2016/07/03.32_Hematite_-_oolitic_with_shale_Iron_Oxide_Clinton_Oneida_County_New_York-e1512421695503-300x269.jpg) vía Wikimedia Commons" width="315px" height="282px" src="https://geo.libretexts.org/@api/deki...03-300x269.jpg">
vía Wikimedia Commons" width="315px" height="282px" src="https://geo.libretexts.org/@api/deki...03-300x269.jpg">
Otros óxidos de hierro incluyen limonita, magnetita y hematita. La hematita se presenta en muchas formas cristalinas diferentes. La forma masiva no muestra estructura externa. La hematita botrioidal muestra grandes manchas concéntricas. La hematita especular parece una masa de cristales metálicos brillantes. La hematita oolítica parece una masa de huevos de pescado rojo opaco. Estas diferentes formas de hematita son polimorfos y todas tienen la misma fórmula, Fe 2 O 3.
Otros minerales comunes de óxido incluyen:
- Hielo (H 2 O), un óxido de hidrógeno
- Bauxita (Al 2 H 2 O 4), óxidos hidratados de aluminio, un mineral para producir aluminio metálico
- Corindón (Al 2 O 3), que incluye piedras preciosas de rubí y zafiro.

Los haluros consisten en halógenos en la columna VII, generalmente flúor o cloro, unidos iónicamente con sodio u otros cationes. Estos incluyen halita o cloruro de sodio (NaCl), sal de mesa común; silvita o cloruro de potasio (KCl); y fluorita o fluoruro de calcio (CaF 2).
 CC BY-SA 4.0], via Wikimedia Commons" width="291px" height="213px" src="https://geo.libretexts.org/@api/deki...el-300x220.jpg">
CC BY-SA 4.0], via Wikimedia Commons" width="291px" height="213px" src="https://geo.libretexts.org/@api/deki...el-300x220.jpg">

Los minerales halogenados generalmente se forman a partir de la evaporación del agua de mar u otros cuerpos aislados de agua. Un ejemplo bien conocido de depósitos minerales halogenados creados por la evaporación es el Bonneville Salt Flats, ubicado al oeste del Great Salt Lake en Utah (ver figura).
 CC BY-SA 3.0], via Wikimedia Commons" width="241px" height="255px" src="https://geo.libretexts.org/@api/deki...e1-283x300.jpg">
CC BY-SA 3.0], via Wikimedia Commons" width="241px" height="255px" src="https://geo.libretexts.org/@api/deki...e1-283x300.jpg">
Muchos minerales metálicos importantes son los sulfuros, en los que los metales están unidos al azufre. Ejemplos significativos incluyen galena (sulfuro de plomo), esfalerita (sulfuro de zinc), pirita (sulfuro de hierro, a veces llamado “oro tonto”) y calcopirita (sulfuro de hierro-cobre). Los sulfuros son bien conocidos por ser minerales minerales importantes. Por ejemplo, la galena es la principal fuente de plomo, la esfalerita es la principal fuente de zinc, y la calcopirita es el principal mineral de cobre extraído en depósitos de pórfido como la mina de Bingham (ver capítulo 16). Las mayores fuentes de níquel, antimonio, molibdeno, arsénico y mercurio también son los sulfuros.
Sulfatos

Los minerales sulfato contienen un ion metálico, como el calcio, unido a un ion sulfato. El ion sulfato es una combinación de azufre y oxígeno (SO 4 — 2). El yeso mineral sulfato (CaSO 4 2H 2 O) se utiliza en materiales de construcción como yeso y yeso. El yeso a menudo se forma a partir del agua evaporada y generalmente contiene moléculas de agua en su estructura cristalina. El 2H 2 O en la fórmula indica que las moléculas de agua son enteras H 2 O. Esto es diferente de minerales como el anfíbol, que contienen un ion hidróxido (OH —) que se deriva del agua pero que le falta un ión hidrógeno (H +). El sulfato de calcio sin agua es un mineral diferente al yeso llamado anhidrita (CaSO 4).
Fosfatos

Los minerales de fosfato tienen una unidad de fosfato tetraédrico (PO 4 -3) combinada con diversos aniones y cationes. En algunos casos, el arsénico o el vanadio pueden sustituir al fósforo. Los fosfatos son un ingrediente importante de los fertilizantes, así como de los detergentes, pinturas y otros productos. El mineral fosfato más conocido es la apatita, Ca 5 (PO 4) 3 (F, Cl, OH), cuyas variaciones se encuentran en dientes y huesos. La piedra preciosa turquesa [CuA 6 (PO 4) 4 (OH) 8 ·4H2O] es un mineral de fosfato rico en cobre que, al igual que el yeso, contiene moléculas de agua.
Minerales Elementos Nativos
Los minerales de elementos nativos, generalmente metales, ocurren en la naturaleza en un estado puro o casi puro. El oro es un ejemplo de un elemento mineral nativo; no es muy reactivo y rara vez se une con otros elementos por lo que generalmente se encuentra en estado aislado o puro. El carbono mineral no metálico y poco reactivo a menudo se encuentra como un elemento nativo, como el grafito y los diamantes. Los metales levemente reactivos como la plata, el cobre, el platino, el mercurio y el azufre a veces ocurren como minerales de elementos nativos. Los metales reactivos como el hierro, el plomo y el aluminio casi siempre se unen a otros elementos y rara vez se encuentran en estado nativo.




