3.3: Diagrama de fases para vapor de agua - Ecuación Clausius Clapeyron
- Page ID
- 88843
La ecuación Clausius—Clapeyron
Podemos derivar la ecuación para e s usando dos conceptos de los que quizás hayas oído hablar y que aprenderás más adelante: la entropía y la energía libre de Gibbs, que no vamos a entrar aquí. En cambio, citaremos el resultado, que se llama la Ecuación Clausius—Clapeyron,
\[\frac{1}{e_{s}} \frac{d e_{s}}{d T}=\frac{l_{v}}{R_{v} T^{2}} \label{3.9}\]
donde\(l_v\) está la entalpía de vaporización (a menudo llamado el calor latente de vaporización, aproximadamente 2.5 x 10 6 J kg —1), R v es la constante de gas para el vapor de agua (461.5 J kg —1 K —1), y T es la temperatura absoluta. La entalpía de vaporización (es decir, calor latente de vaporización) es solo la cantidad de energía requerida para evaporar una cierta masa de agua líquida.
¿Cuál es el significado físico? El lado derecho de la Ecuación\ ref {3.9} es siempre positivo, lo que significa que la presión de vapor de saturación siempre aumenta con la temperatura (es decir, de s/dT > 0). Esta pendiente positiva tiene sentido porque sabemos que a medida que sube la temperatura del agua, la evaporación es más rápida (porque las moléculas de agua tienen más energía y así una mayor probabilidad de romper los enlaces que las sujetan a otras moléculas de agua en un líquido o en hielo). A la saturación, la condensación equivale a evaporación, y como la evaporación es mayor, la condensación también debe ser mayor. Gran parte de la mayor condensación proviene de tener más moléculas de vapor de agua golpeando la superficie del líquido, lo que de acuerdo con la Ley de Gas Ideal, significa que la presión del vapor de agua es mayor.
Esta expresión se puede integrar, asumiendo que l v es una constante con la temperatura (¡no es del todo constante!) para dar la ecuación:
\[e_{s}=e_{s o} \exp \left(\frac{l_{v}}{R_{v} T_{o}}\right) \exp \left(\frac{-l_{v}}{R_{v} T}\right)\]
Generalmente T o se toma para ser 273 K y e así es entonces 6.11 hPa.
Notas:
- e s depende sólo de T, la temperatura absoluta. Es esencialmente independiente de la presión atmosférica, o de cualquier otro factor.
- l v no es constante con la temperatura sino que cambia ligeramente (de 2.501 x 10 6 J kg —1 a 0 o C a 2.257 x 10 6 J kg —1 a 100 o C).
- Así, las formas más precisas de la Ecuación Clausius—Clapeyron integrada son más complicadas pero fáciles de manejar cuando se usa una computadora.
¿Qué aspecto tiene la trama de esta ecuación?
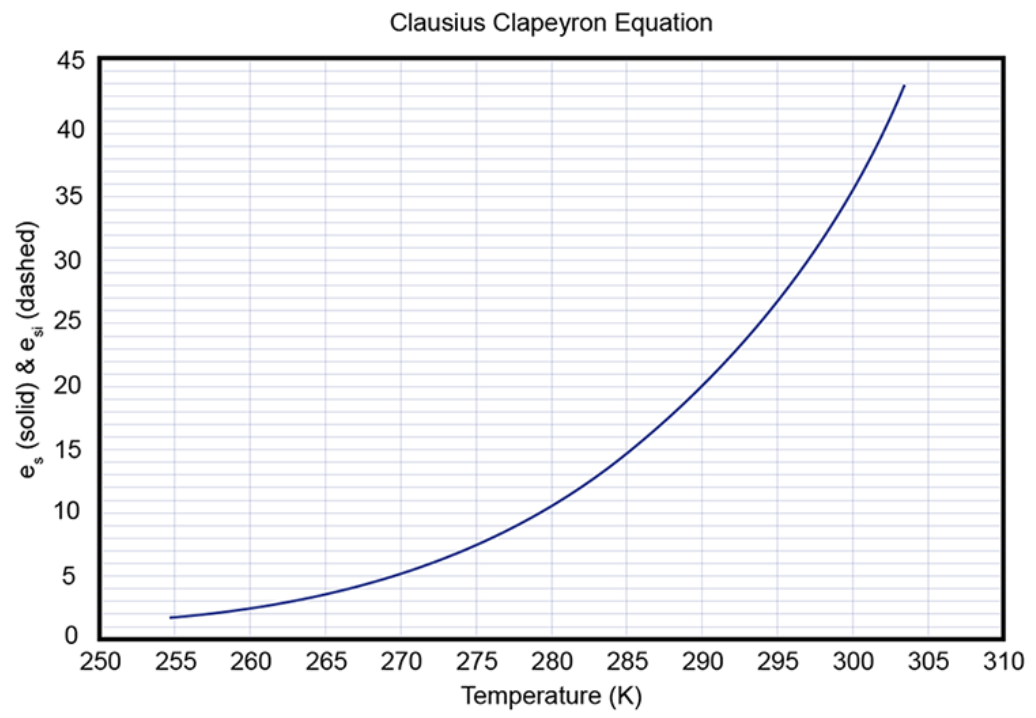
¿Qué pasa entre vapor y hielo? Se pueden aplicar los mismos métodos y se obtienen las mismas ecuaciones básicas, excepto con una constante diferente:
\[e_{s i}=e_{s o} \exp \left(\frac{l_{s}}{R_{v} T_{o}}\right) \exp \left(\frac{-l_{s}}{R_{v} T}\right)\]
donde e si es la presión de vapor de saturación para el equilibrio de vapor de hielo y l s es la entalpía de sublimación (intercambio directo entre agua sólida y vapor = 2.834 x 10 6 J kg —1).
Ecuaciones para e s y e si que dan cuenta de variaciones con la temperatura de l v y l s, respectivamente, se pueden encontrar en Bohren y Albrecht ( Termodinámica Atmosférica, Oxford University Press, Nueva York, 1998, ISBN 0-19-509904-4):
\[e_{s}=e_{s o} \exp \left[(6808 \mathrm{K})\left(\frac{1}{T_{o}}-\frac{1}{T}\right)-5.09 \ln \frac{T}{T_{o}}\right]\]
\[e_{s i}=e_{s o} \exp \left[(6293 \mathrm{K})\left(\frac{1}{T_{o}}-\frac{1}{T}\right)-0.555 \ln \frac{T}{T_{o}}\right]\]
donde\(T_{o}=273 \mathrm{K}, \quad e_{s o}=6.11 \mathrm{hPa}\)
Tenga en cuenta que e así es la presión de vapor de saturación a T o y que e so = 6.11 hPa y T o = 273 K. Observe cómo las constantes son ligeramente diferentes porque el calor latente de vaporización para el agua líquida es diferente del calor latente de vaporización para el hielo. Tenga en cuenta que T en estas ecuaciones debe estar en Kelvin.
Temperatura del punto de condensación como medida del vapor de agua
En pocas palabras, la temperatura del punto de rocio es la temperatura a la que se saturaría el vapor de agua de la atmósfera. Siempre es menor o igual a la temperatura real. Matemáticamente,
\[w(T)=w_{s}\left(T_{d}\right)\]
lo que significa que la presión de vapor de agua a alguna temperatura T (no multiplicada por T) es igual a la presión de saturación de vapor de agua a la temperatura del punto de rocio, T d. Entonces vemos que debido a que w s depende únicamente de T d a una presión dada, T d es un buen método para designar la cantidad absoluta de vapor de agua.
El diagrama de fases para el agua
Podemos dibujar el diagrama de fases para el agua. Hay tres líneas de equilibrio que se encuentran en el punto triple, donde existen las tres fases (e s = 6.1 hPa; T = 273.14 K). A lo largo de la línea para e s, vapor y líquido están en equilibrio, y la evaporación equilibra la condensación. A lo largo de la línea para e si, el vapor y el hielo están en equilibrio y la sublimación equivale a deposición. A lo largo de la línea para e sm, líquido y hielo están en equilibrio y fusión de equilibrios de fusión.
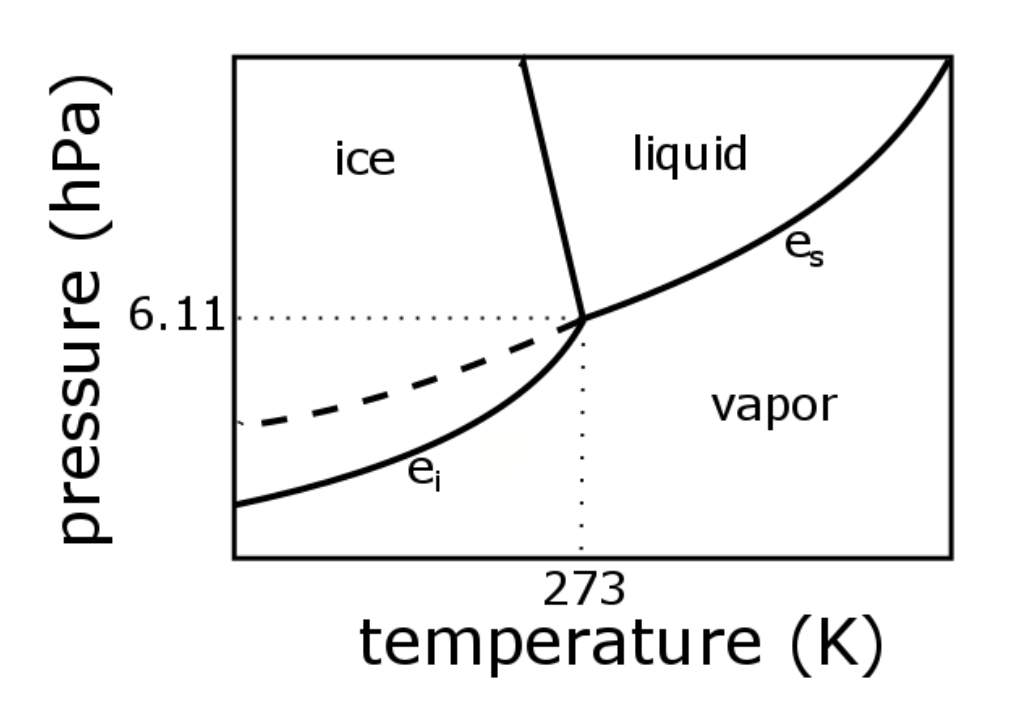
¿Es posible tener agua en una sola fase? ¡Sí!
El caso más sencillo es cuando toda el agua es vapor, lo que ocurre cuando la presión del vapor de agua es lo suficientemente baja y la temperatura (y por lo tanto la presión de vapor de saturación) es lo suficientemente alta como para que toda el agua del sistema se evapola y en la fase vapor.
Pensemos en lo que se necesitaría para tener toda el agua en fase líquida. Supongamos que tenemos un cilindro cerrado en un extremo y un pistón sellado en el otro que está en un baño de temperatura para que podamos sostener el cilindro y su contenido a una temperatura fija (es decir, isotérmica). Inicialmente, llenamos el cilindro con agua líquida y tenemos un pequeño volumen de vapor de agua puro en la parte superior. Si establecemos la temperatura del baño en, digamos, 280 K y dejamos que el sistema se asiente por un tiempo, el vapor se saturará, que está en la línea e s. Para la compresión isotérmica, en la que la energía es eliminada del sistema por el baño para mantener constante la temperatura, un empuje en el pistón elevará ligeramente la presión de vapor por encima de e s y habrá condensación neta hasta que se obtenga nuevamente el equilibrio. Si seguimos empujando lentamente el pistón, eventualmente todo el volumen del cilindro se llenará con agua líquida y el cilindro contendrá solo una fase: líquido. Si seguimos empujando el pistón y el baño mantiene constante la temperatura, entonces la presión del agua aumentará.
En la atmósfera, el hielo o líquido casi siempre tiene una superficie que está expuesta a la atmósfera y así existe la posibilidad de que el agua pueda sublimar o evaporarse en este gran volumen. Tenga en cuenta que la presencia o ausencia de aire seco tiene poco efecto sobre la condensación y evaporación del agua, por lo que no es la presencia de aire lo que es importante, sino que es el gran volumen para el vapor de agua lo que es importante.
Pueden existir condiciones en la atmósfera para la cual la presión y la temperatura del agua están en la parte líquida o a veces sólida del diagrama de fases. Pero estas condiciones son inestables y habrá condensación o deposición hasta que la condensación y evaporación o sublimación y deposición entren en equilibrio, igual que en el caso del pistón anterior. Así, más agua entrará en la fase líquida o hielo para que la presión del vapor de agua baje hasta el valor de saturación. Cuando la presión del agua aumenta a una temperatura dada para poner el sistema en la región líquida del diagrama de fases del agua, se dice que el vapor de agua está sobresaturado. Esta condición no durará mucho, pero es esencial en la formación de nubes, como veremos en la lección sobre física de nubes.
Tenga en cuenta también que la línea de equilibrio para hielo y vapor se encuentra por debajo de la línea de equilibrio para líquido superenfriado y vapor para cada temperatura. Así e si < e s para cada temperatura por debajo de 0 o C porque l s > l v en la Ecuación Clausius—Clapeyron. Esta pequeña diferencia entre e si y e s puede ser muy importante en las nubes, como también veremos en la lección sobre física de nubes.


