4.4: Formación de ozono estratosférico
- Page ID
- 88820
El ozono es ozono sin importar dónde se encuentre en la atmósfera. El buen ozono es bueno sólo porque está en la estratosfera donde no podemos respirarlo (Figura\(\PageIndex{1}\)). El mal ozono también absorbe la luz ultravioleta solar, pero está abajo cerca de la superficie de la Tierra donde podemos respirarla. Para la protección UV, nos interesa el número total de moléculas de ozono entre nosotros y el Sol. El 90% de las moléculas de ozono están en la estratosfera y el 10% están en la troposfera, algunas abajo cerca de la superficie de la Tierra donde podemos respirarlas. Hay temas importantes que afectan la salud humana y ecológica tanto para el ozono bueno como para el ozono malo. Para un buen ozono, los temas más importantes son la reducción del ozono a nivel mundial, el Agujero de Ozono Antártico y la pérdida de ozono en el Ártico que es causada por los clorofluorocarbonos. La reducción del ozono significa que más rayos UV solares llegan al suelo causando más cáncer de piel. Para el mal ozono, los temas más importantes incluyen la producción de demasiado ozono en ciudades y regiones cercanas que es causada por demasiados contaminantes del tráfico, procesos industriales, generación de energía y otras actividades humanas. El aumento de ozono significa que más personas tienen problemas respiratorios y cardíacos. Veamos tanto lo bueno como lo malo, empezando por el ozono estratosférico.
- Haga clic para obtener una descripción de texto de la imagen de sección transversal.
-
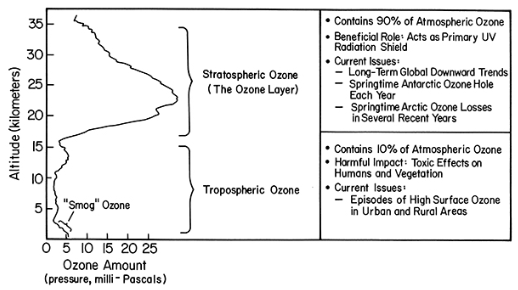
Diagrama explicativo del perfil de ozono vertical típico para los trópicos
El ozono estratosférico (la capa de ozono, ~15-35 km) contiene 90% del ozono atmosférico papel beneficioso: actúa como escudo primario contra la radiación UV
- tendencias globales a la baja a largo
- Agujero de ozono antártico de primavera cada año
- pérdidas de ozono ártico primaverales en varios años recientes
- episodios de alta capa de ozono superficial en zonas urbanas y rurales
El Ozono Troposférico (0-15 km) contiene 10% del impacto nocivo del ozono atmosférico: efectos tóxicos en humanos y vegetación temas de actualidad
Para obtener la cantidad total de ozono entre nosotros y el Sol, simplemente sumamos la cantidad de ozono comenzando en la superficie y subiendo hasta la parte superior de la capa de ozono. Observe cuánto más ozono hay en la estratosfera. En latitudes más altas, el fondo de la capa de ozono estratosférico se encuentra aproximadamente a 10-12 km. Recordemos la siguiente imagen de la Lección 2:
El proceso de formación de ozono estratosférico comienza con el ozono (O 3), el cual es hecho por la luz solar ultravioleta en la estratosfera (pero no la troposfera, como veremos). Las dos reacciones son:
\[O_{2}+\operatorname{hard} U V \rightarrow O+O\]
\[O+O_{2}+N_{2} \rightarrow O_{3}+N_{2}\]
Tenga en cuenta que N 2 realmente no reacciona en esta última ecuación química, sino que simplemente choca con la molécula O 3 a medida que se está formando y la estabiliza eliminando parte de la energía del O 3. Llamamos a O 3 un oxidante porque puede reaccionar con algunos compuestos y oxidarlos.
Este O 3 se puede romper por la luz ultravioleta para hacer O 2 y O. Por lo general, O se combina con O 2 para formar O 3 de esta manera: O+O 2 +N 2 →O 3 +N 2, así que nada sucede realmente, excepto que la energía solar que rompe aparte el O 2 termina como energía extra para el O 3 y para el N 2 colisionante y, como resultado, termina calentando el aire. A veces O choca con O 3 y reacciona: O+O 3 →O 2 +O 2. Al juntar todas las reacciones, podemos ver el ciclo de vida químico del ozono en la estratosfera. Este conjunto de reacciones fue propuesto en la década de 1930 por Chapman:
| O 2 + UV duro → O + O | producción |
|---|---|
| 2 (O + O 2 + N 2 → O 3 + N 2) | ciclismo |
| O 3 + UV → O 2 + O | ciclismo |
| O + O 3 → O 2 + O 2 | pérdida |
| Neto: UV → T superior |
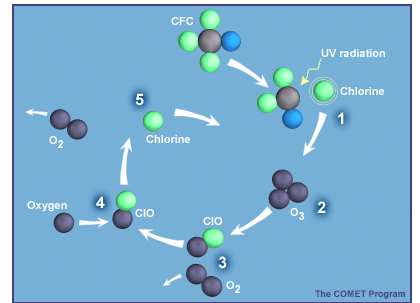
Estas cuatro reacciones podrían producir las características básicas de la capa de ozono como lo fue en la década de 1940 hasta la década de 1970. Sin embargo, esta teoría produjo niveles pico de ozono que fueron 50 mili-pascales, no los 25-30 mili-pascales vistos en la primera figura anterior. Así, los niveles medidos de ozono estratosférico fueron aproximadamente la mitad de los predichos por la teoría de Chapman; era un verdadero rompecabezas. Sin embargo, en la década de 1970, los científicos propusieron nuevos conjuntos de reacciones por otros gases que lograron los mismos resultados que la reacción de pérdida mostrada anteriormente. Un ejemplo famoso fue el cloro, que proviene principalmente de clorofluorocarbonos (CFC) hechos por el hombre:
| CFC + UV → producto + Cl | producción |
|---|---|
| Cl + O 3 → ClO + O 2 | ciclismo |
| ClO + O → Cl + O 2 | ciclismo |
| Cl + CH 4 → HCl + CH 3 | pérdida |
| Neto O 3 +O: O 3 + O → O 2 + O 2 |
Durante el ciclo, el cloro (Cl) y el monóxido de cloro (ClO) no se destruyen sino que solo se reciclan entre sí. Con cada ciclo, se pierden dos moléculas de ozono (una directamente y una segunda porque O casi siempre reacciona con O 2 para formar O 3). Este ciclo puede funcionar cientos de miles de veces antes de que el Cl se ate en HCl. Por lo que los niveles de ClO y Cl de decenas de partes por billón de aire (10 -12) son capaces de destruir varios por ciento de las pocas partes por millón de O 3. Sherry Rowland y Mario Molina descubrieron este ciclo y escribieron un artículo al respecto en 1974. Recibieron el Premio Nobel de Química en 1995 por esta obra. Cuando los ciclos catalíticos que involucran cloro, óxidos de nitrógeno y OH se incluyen con la teoría, la concordancia entre la teoría y las mediciones mejora mucho.
Ejercicio
Tenga en cuenta que la cantidad total de ozono en latitudes medias es mayor que la cantidad en los trópicos. Esto debería parecerle extraño porque la UV solar que forma parte del mecanismo Chapman es más fuerte en los trópicos. ¿Por qué crees que el ozono total se distribuye de esta manera?
- Haga clic para obtener la respuesta.
-
RESPUESTA: La distribución del ozono se debe al movimiento del aire a través de la estratosfera. El aire viene de la troposfera a la estratosfera principalmente en los trópicos y, a medida que se mueve rápidamente de oeste a este, se mueve lentamente desde los trópicos hasta cerca de los polos, donde vuelve a entrar en la troposfera. Por lo que la mayor parte del ozono se produce en los trópicos a mayores altitudes y luego parte de este ozono es destruido por reacciones químicas ya que el ozono se transporta hacia los polos y hacia abajo. Entonces, mientras la relación de mezcla de ozono disminuye ligeramente desde los trópicos a latitudes altas, la concentración de ozono (moles por volumen) aumenta a medida que se transporta a altitudes más bajas donde la presión y el número de moles es mayor, más del doble de grande (ver la imagen de la Lección 2 anterior).
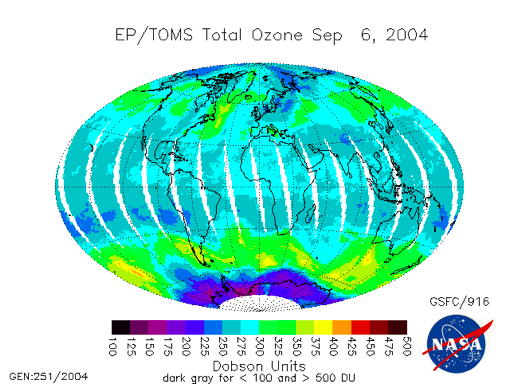
El bajo nivel de ozono sobre la Antártida arriba es el Agujero de Ozono Antártico; el siguiente video (:31) titulado “Mínimos de ozono con gráfico” (de la NASA) muestra cambios en la concentración de ozono entre 1979 y 2013. El video no se narra:
El agujero de ozono antártico es un ejemplo extremo del poder destructivo de los ciclos catalíticos de cloro. Diferentes ciclos catalíticos dominan la destrucción del ozono sobre la Antártida y, en menor medida, sobre el Ártico. Pero, cuando es ayudado por la química en las superficies de las nubes estratosféricas polares de origen natural, se libera todo el Cl en forma de HCl para que los ciclos catalíticos polares sean capaces de destruir un poco por ciento del ozono por día en un tapón del tamaño de la Antártida desde una altitud de 12 km hasta 20 km.
Afortunadamente, la cantidad de cloro que se inyecta en la estratosfera está disminuyendo debido al Protocolo de Montreal, el primer tratado ambiental mundial internacional del mundo.


