5.5: Efecto Curvatura - Efecto Kelvin
- Page ID
- 88895
Veamos primero el efecto de curvatura (Figura\(\PageIndex1\)). Considera las fuerzas que mantienen unidas una gota de agua para una superficie plana y una curva. Las fuerzas sobre los enlaces de hidrógeno en el líquido dan una fuerza neta de atracción hacia adentro a las moléculas en el límite entre el líquido y el vapor. La fuerza neta hacia adentro, dividida por la distancia a lo largo de la superficie, se denomina tensión superficial,\(σ\) con unidades de N/m o J/m 2.
Si la superficie es curva, entonces se reduce la cantidad de unión que puede ocurrir entre cualquier molécula de agua en la superficie y sus vecinos. Como resultado, existe una mayor probabilidad de que cualquier molécula de agua pueda escapar del líquido y entrar en la fase vapor. Así, la tasa de evaporación aumenta. Cuanto mayor sea la curvatura, mayor será la probabilidad de que las moléculas de agua superficial puedan escapar. Por lo tanto, se necesita menos energía para eliminar una molécula de una superficie curva que de una superficie plana.
Cuando trabajamos a través de las matemáticas, llegamos a la Ecuación Kelvin:
\[e_{s c}(T)=e_{s}(T) \cdot \exp \left(\frac{2_{\sigma}}{n_{L} \cdot R \cdot T \cdot r_{d}}\right)\]
donde e sc es la presión de vapor de equilibrio sobre una superficie curva de agua pura, e s es la presión de vapor de equilibrio sobre una superficie plana de agua pura, ambas funciones de temperatura, aunque e sc también es función del radio de caída, n L es el número de moles por volumen de agua (55.5 moles L -1). R* es la constante molar del gas, σ es la tensión superficial del agua y r es el radio de la gota.
\[\left(\frac{2 \sigma}{n_{L} \cdot R^{*}}\right)=3.3 \times 10^{-7} \mathrm{m} K^{-1}\]
Dado que la evaporación es mucho, mucho mayor sobre una superficie curva, la condensación también debe ser mucho, mucho mayor para mantener la condensación = evaporación, que se requiere para la saturación (es decir, equilibrio). Así, la presión de vapor de saturación sobre una superficie curva es mucho mayor que la presión de vapor de saturación sobre una superficie plana de agua pura. Cuando trazamos esta ecuación, obtenemos la gráfica en la Figura\(\PageIndex2\):
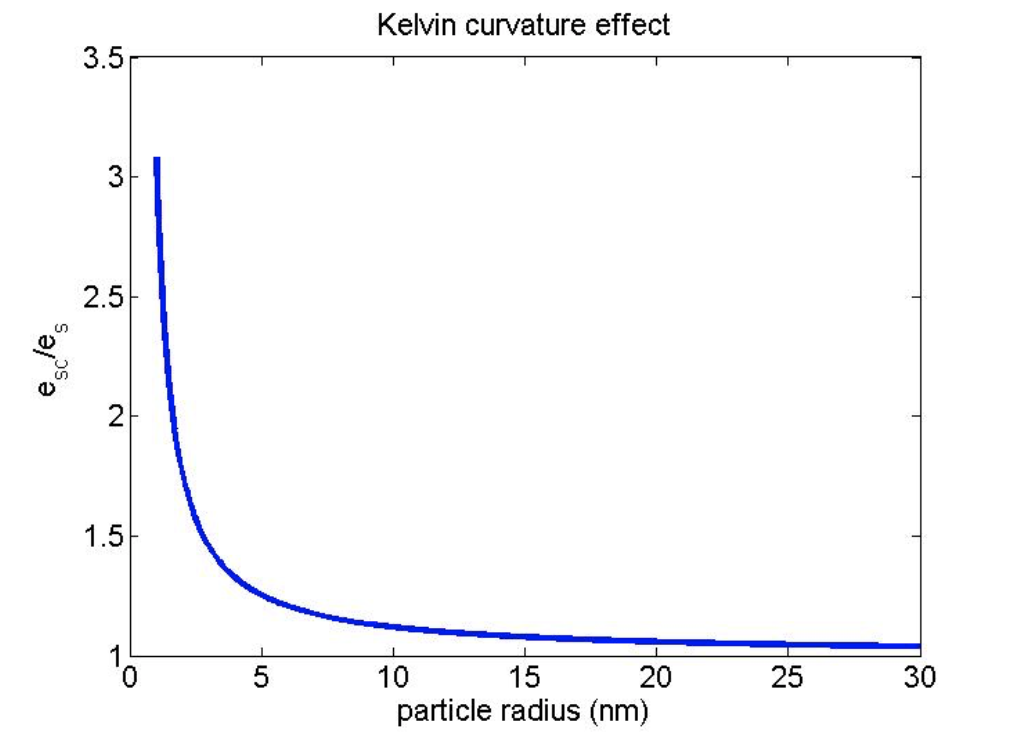
Obsérvese el rápido aumento en la presión de vapor de equilibrio para partículas que tienen radios menores a 10 nm. Por supuesto, todos los pequeños racimos de vapor de agua y CCN comienzan en este pequeño tamaño y crecen agregando agua.
La Ecuación Kelvin se puede aproximar expandiendo el exponencial en una serie:
\[e_{s c}(T)=e_{s}(T) \cdot\left(1+\frac{2 \sigma}{n_{L} \cdot R^{*} \cdot T \cdot r_{d}}\right)=e_{s}(T) \cdot\left(1+\frac{a_{K}}{r_{d}}\right), \quad\]
donde
\[a_{K}=\frac{2 \sigma}{n_{L} \cdot R^{*} \cdot T}\]
Resumen
Las caídas de nubes comienzan como gotas esféricas muy pequeñas, pero la presión de vapor requerida para que se formen es mucho mayor que e s hasta que se acercan a 10 -2 μm de tamaño. El efecto Kelvin es importante solo para gotas diminutas; es importante porque todas las gotas comienzan como gotas diminutas y deben pasar por esa etapa. A medida que las gotas se hacen más grandes, su radio aumenta y e sc se acerca a e s.
Entonces, ¿es posible formar una nube caída de agua pura? Este proceso se denomina nucleación homogénea. La única manera de que esto suceda es que dos moléculas se peguen entre sí, luego agreguen otra, luego otra, etc. pero el radio de la caída de nucleación es tan pequeño que la presión de vapor debe ser muy grande. Resulta que las gotas probablemente puedan nuclearse a una velocidad razonable cuando la humedad relativa es de aproximadamente 440%. ¿Alguna vez has oído hablar de una humedad relativa tan alta?
Entonces, la lección aquí es que la nucleación homogénea es muy poco probable debido al efecto Kelvin.


