6.10: ¿Por qué los objetos absorben de la manera en que lo hacen?
- Page ID
- 88824
Vemos que hay una cantidad significativa de absorción de radiación en el infrarrojo pero más bien poco en lo visible. También, vemos que los gases absorben fuertemente en algunas longitudes de onda y no en otras. ¿Por qué es esto?
Para responder a esta pregunta, necesitamos mirar las configuraciones de los electrones que están haciendo zoom alrededor de átomos y moléculas. Hace más de 100 años, los científicos comenzaron a utilizar prismas para dispersar la luz del sol y de las llamas que contenían diferentes elementos. Mientras que el sol daba los colores del arco iris, las llamas tenían luz en líneas o bandas muy distintas. Este rompecabezas finalmente se resolvió hace poco más de 100 años con la invención de la mecánica cuántica, que básicamente dice que los electrones que hacen zoom alrededor de átomos y moléculas y las vibraciones y rotaciones de las moléculas pueden tener solo energías discretas que se rigen por reglas de conservación de angular ímpetu.

La siguiente lista con viñetas es un curso intensivo de absorción por los electrones en átomos y moléculas. Consulte la figura debajo del cuadro.
Curso intensivo: Absorción por los Electrones en Átomos y Moléculas
- Los enlaces químicos y la mecánica cuántica juntos determinan los niveles de energía en los que puede estar cualquier electrón, átomo o molécula.
- La energía molecular es una suma de la energía relacionada con la posición del electrón en relación con el estado electrónico de tierra estable, la vibración molecular y la rotación molecular.
- La absorción ocurre cuando la energía del fotón coincide con la diferencia entre dos niveles de energía en una molécula, Δ E = E final — E inicial = hc/λ.
- Las reglas establecidas por la conservación del momento angular y el espín electrónico determinan qué transiciones están permitidas.
- La cantidad de absorción, llamada simplemente la sección transversal de absorción, σ, proviene de muchos factores, pero varía significativamente de molécula a molécula y de transición a transición. La sección transversal tiene dimensiones de área y comúnmente tiene unidades de cm 2.
- Las transiciones electrónicas ocurren cuando los electrones realmente saltan a otras órbitas alrededor de los núcleos. Tienen energías que son equivalentes a la radiación (es decir, fotones) en las longitudes de onda ultravioleta a visibles.
- Las transiciones vibracionales ocurren cuando la molécula vibra a una frecuencia diferente o de una manera diferente. Las moléculas diatómicas (por ejemplo, O 2 y N 2) solo tienen una forma de vibrar: de un lado a otro a lo largo del enlace químico que las une. Pero las moléculas más complicadas (por ejemplo, H 2 O y CO 2) pueden vibrar no solo con los núcleos acercándose y alejándose entre sí, sino también doblándose en tres direcciones. Estas transiciones vibracionales, acompañadas de movimientos que combinan vibración y rotación, tienen energías equivalentes a la radiación infrarroja cercana y media (es decir, fotones).
- Las transiciones rotacionales ocurren cuando una molécula cambia su velocidad de rotación. Estas transiciones tienen energías equivalentes a la radiación (es decir, fotones) en las longitudes de onda del infrarrojo lejano a las ondas de radio.
- Las energías traslacionales de las moléculas en la atmósfera terrestre, ~ kT, son generalmente un poco más grandes que la energía requerida para pasar de un nivel de rotación a otro, 10—100 veces menos que la energía requerida para pasar de un nivel vibracional a otro, y cientos a miles de veces menos de lo que se requiere para pasar de un nivel electrónico a otro.
- Ya hemos visto que algunas moléculas y átomos tienen más energía cinética que otros. Todas las moléculas con energía cinética mayor que la diferencia de energía entre los niveles rotacionales pueden colisionar con la molécula y darle suficiente energía rotacional para cambiar a un nivel de rotación más alto. Así, vemos que la energía rotacional se distribuye en muchos niveles rotacionales, pero que los niveles vibracionales y electrónicos suelen ser los niveles de tierra (energía más baja).
- Los átomos no tienen vibraciones y rotaciones similares a moléculas porque tienen un solo núcleo, por lo que sus espectros consisten únicamente en transiciones electrónicas.
- Una transición brusca de un nivel discreto a otro, que aparece como una línea en un espectro, ocurre en un rango estrecho de energías alrededor de la diferencia de energía de transición. La radiación resultante se produce en una banda estrecha de longitudes de onda alrededor de la longitud de onda central de la línea. El ancho de esta línea (medido a la mitad de la altura máxima de la línea) se denomina ancho de línea.
- Este ancho de línea natural se puede ampliar por el movimiento de la molécula, llamado ensanchamiento Doppler, o por colisiones, llamado ensanchamiento de presión.
- Alto en la atmósfera, el ensanchamiento Doppler es dominante porque la presión es baja, pero menor en la atmósfera, el ensanchamiento de presión se vuelve dominante a pesar de que el ensanchamiento Doppler también aumenta. Entonces las líneas de absorción son más amplias cerca de la superficie de la Tierra que más altas en la atmósfera.
La sección transversal de absorción, σ, varía significativamente a lo largo del ancho de la línea de absorción. Por lo que es posible que toda la radiación sea absorbida en el medio de la línea pero muy poco absorbida en las “alas”.
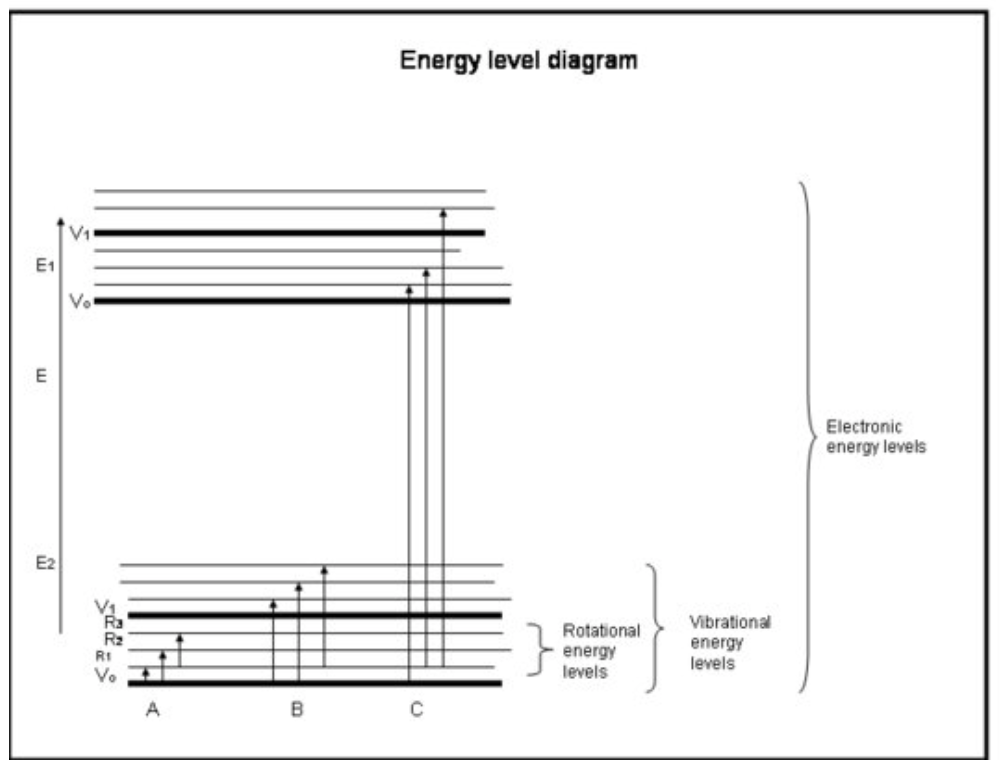
Interpretación Física
Los átomos y las moléculas pueden absorber radiación (un fotón) solo si su estructura tiene una diferencia de energía entre niveles que coincide con la energía del fotón (hc/λ). De lo contrario, el átomo o molécula no absorberá la luz. Una vez que la molécula ha absorbido el fotón, puede perder un fotón y volver a su nivel de energía inferior original; o puede romperse si la energía del fotón es mayor que el enlace químico que mantiene unida a la molécula; o puede chocar con otras moléculas, como N 2 u O 2, y transferirles energía mientras vuelve a su nivel de energía más bajo. Las colisiones ocurren a menudo, por lo que la energía del fotón absorbido a menudo se transfiere a la energía térmica.
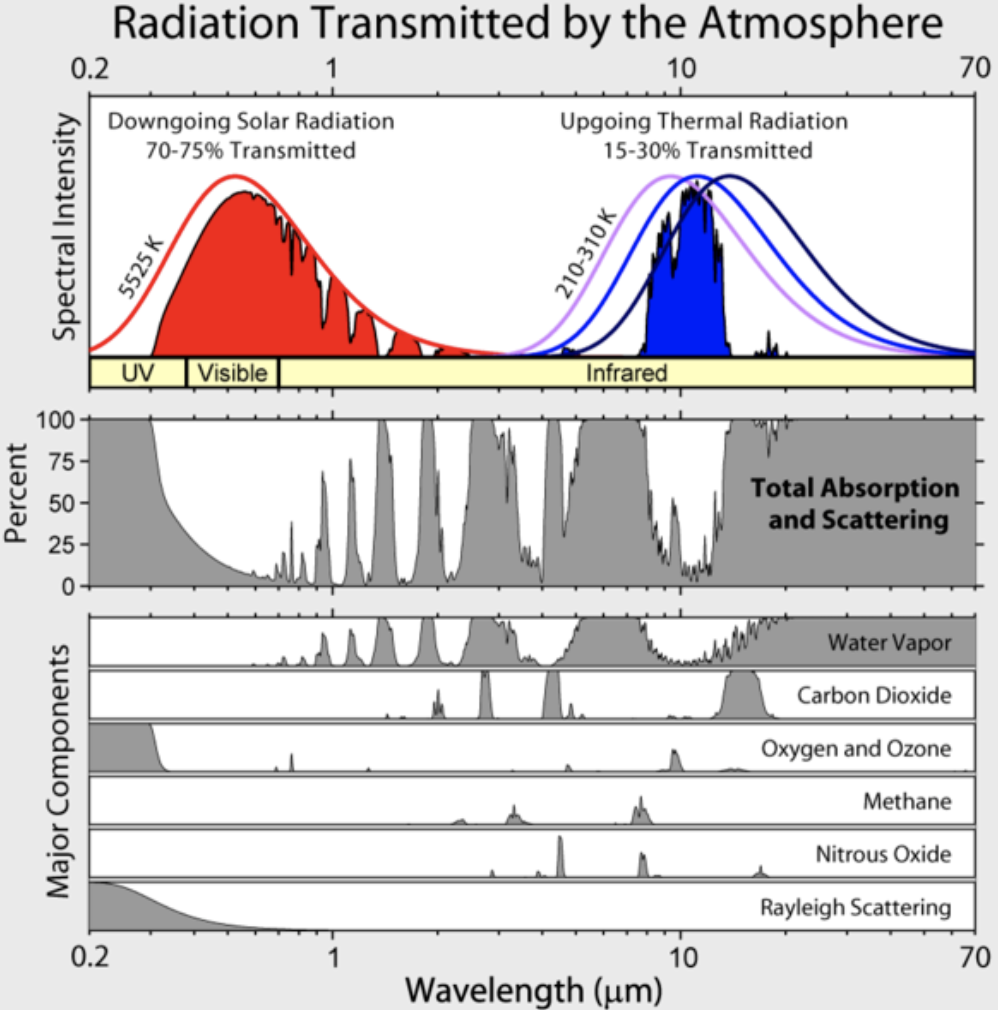
Tenga en cuenta que la irradiación infrarroja ascendente de la Tierra se limita a unas pocas “ventanas” atmosféricas y la irradiancia en todas las demás longitudes de onda es fuertemente absorbida, principalmente por vapor de agua, pero también por dióxido de carbono, ozono, óxido nitroso, metano y otros gases más traza que no se muestran en la figura anterior.

