7.7: Otro gran golpe para los arrecifes de coral: ¿aumentar el dióxido de carbono atmosférico?
- Page ID
- 89129
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)

Figura 7-1: una toma de parte del acuario HUB en Penn State en la que hay un “arrecife” de coral vivo y próspero. ¡Ven a visitarnos!
Sí, incluso en Penn State sin salida al mar, tenemos un pedazo de ambientes marinos poco profundos, justo en medio del bullicio del Edificio Hetzel Union (HUB) en el campus. Gracias a la clase del 99, un dedicado miembro de la facultad de Química y una serie de estudiantes dedicados, este acuario y sus habitantes continúan prosperando. Aquí (el enlace es externo) hay un breve artículo sobre el acuario (2002) con imágenes. Una de las cosas aprendidas en el mantenimiento de ecosistemas tan pequeños es la necesidad de amortiguar los cambios en ciertos sustratos químicos, particularmente el carbono disuelto, el pH y los iones de calcio, todos los cuales son esenciales para permitir que los corales precipiten sus esqueletos de aragonita (CaCo 3). El acuario mantiene un lecho de piedra caliza granulada a través del cual circulan los fluidos antes de que ingresen al tanque. Esto permite que parte de la piedra caliza se disuelva, si es necesario, aportando los iones esenciales de Ca 2+ y CO 3 -2 para su incorporación mediante el cultivo, esqueletizando corales. La reacción química sería:
Ca 2+ + CO 3 2- —> CaCo 3 (s) (aragonita) (esta reacción se rige, por supuesto, por una “constante” de equilibrio sensible a la temperatura)
Como aprendiste en la lección de química marina, las soluciones deben estar en o por encima de la saturación con respecto a un mineral dado para permitir que precipite. Sin embargo, sin embargo, estamos comenzando a bajar el nivel de saturación del océano superficial con respecto a la aragonita, y esto dificultará que los corales y otros organismos aragoníticos precipiten conchas o esqueletos. ¿Cómo funciona esto?
Primero, probablemente hayas visto varias versiones de la Figura 7-2.
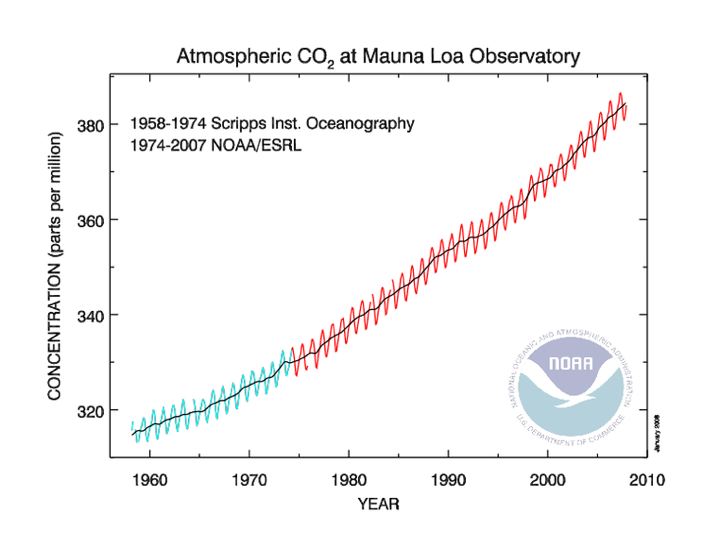
Figura 7-2: Concentración de dióxido de carbono en la atmósfera (partes por millón; ppm) de 1958-2008 de monitoreo en la cima de Mauna Loa en Hawai.
Fuente: NOAA
Este registro ilustra un incremento en el promedio (los pequeños meneo son variaciones estacionales) PCo 2 (presión parcial de dióxido de carbono en la atmósfera) de alrededor del 19 por ciento durante el último medio siglo. Por supuesto, es a este incremento al que se le ha atribuido el calentamiento global, pero hay otro tema. Incluso si pudiéramos mitigar el calentamiento global por algún milagro de ingeniería (espejos en el espacio, etc.), el aumento en PCo 2 probablemente conseguiría finalmente los corales. ¿Por qué? Debido a que el incremento de PCo 2 y su penetración en la superficie oceánica disminuye el pH del océano, disminuyendo la concentración de carbonato y, en última instancia, disminuyendo la saturación con respecto a la aragonita. La Figura 7-3 muestra cómo funciona esto con algunos cálculos simples al duplicar PCo 2.

Figura 7-3
Fuente: NOAA/PMEL
Tenga en cuenta que a través de las reacciones mostradas (equilibrios de ácido carbónico en agua de mar) duplicar el PCo 2 de su nivel preindustrial (280 ppm) a 560 ppm disminuye sustancialmente el pH (en 0.24 unidades) y la concentración de iones carbonato (en aproximadamente un 34%); por supuesto, ¡todavía no hemos llegado a ese punto! Tenga en cuenta, sin embargo, que el CO 2 atmosférico derivado de los combustibles fósiles (¿cómo sabemos esto?) se ha mezclado en aguas superficiales y penetrado más profundamente en el océano (¿recuerdas la circulación profunda?) en algunas regiones como se muestra en la Figura 7-4. Esto está provocando una disminución en el pH.

Figura 7-4
Fuente: Scientific American, 2006
Chris Langdon (Observatorio Lamont Doherty Earth, Universidad de Columbia) cultivó corales artificialmente en Biosfera 2, Arizona y los sometió a diferentes niveles de PCo 2. Encontró que su tasa de crecimiento disminuyó al aumentar el PCo 2 como se muestra en la Figura 7-5.

Figura 7-5: Tasa de calcificación (precipitación de aragonita) de corales en agua de mar a temperatura constante en función de pCO2 atmosférico en experimentos de Biosfera 2 (sistema cerrado) realizados por Chris Langdon (LDEO). Anotar tasa decreciente de calcificación y puntos de referencia para el futuro. Parece que los corales ya pueden estar teniendo problemas, al menos en relación con el mundo preindustrial. ¿Qué opinas?


