5.2: Origen de los Océanos
- Page ID
- 89480
Entonces, ¿cómo se formaron los océanos en primer lugar? Recordemos de la sección 3.1 que la Tierra primitiva se formó a través de la acreción de diversos materiales, y que siguió un período de fusión e intensa actividad volcánica. Los materiales que se acumularon en la Tierra primitiva contenían los componentes que eventualmente se convertirían en nuestros océanos y atmósfera. Bajo las altas presiones que se encuentran en el interior de la Tierra, los gases permanecen disueltos en el magma. A medida que estos magmas suben a la superficie a través de la actividad volcánica, la presión se reduce y los gases se liberan a través de un proceso llamado desgasificación. La actividad volcánica libera muchos gases diferentes, incluyendo vapor de agua, dióxido de carbono (CO 2), dióxido de azufre (SO 2), monóxido de carbono (CO), sulfuro de hidrógeno (H 2 S), gas hidrógeno, nitrógeno y metano (CH 4). Los gases más ligeros como el hidrógeno y el helio se disiparon al espacio, pero los gases más pesados permanecieron y formaron la atmósfera temprana de la Tierra.
El aumento del oxígeno atmosférico
A medida que la Tierra temprana se enfriaba, el vapor de agua en la atmósfera se condensó y cayó como lluvia. Hace cerca de 4 mil millones de años, las primeras acumulaciones permanentes de agua estaban presentes en la Tierra, formando los océanos y otros cuerpos de agua. El agua se mueve entre estos diferentes embalses a través del ciclo hidrológico. El agua se evapora de los océanos, lagos, arroyos, la superficie de la tierra y las plantas (transpiración) por la energía solar (Figura\(\PageIndex{1}\)). Se mueve a través de la atmósfera por los vientos y se condensa para formar nubes de gotas de agua o cristales de hielo. Vuelve a bajar como lluvia o nieve y luego fluye a través de arroyos y ríos, hacia lagos, y eventualmente de regreso a los océanos. El agua en la superficie y en arroyos y lagos se infiltra en el suelo para convertirse en agua subterránea. El agua subterránea se mueve lentamente a través de la roca y los materiales superficiales; algunos regresan a otros arroyos y lagos, y algunos regresan directamente a los océanos.
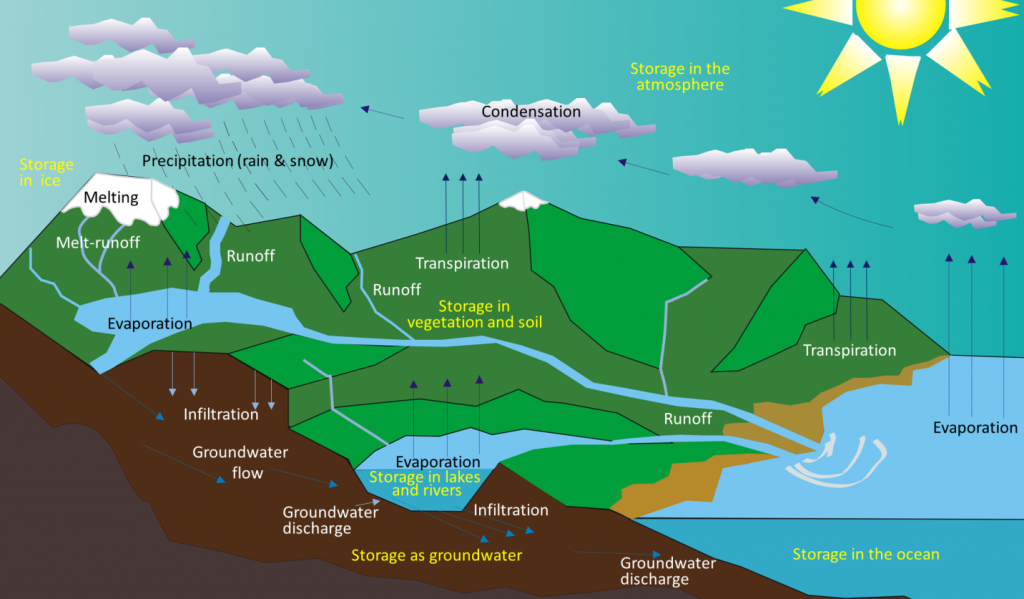
El agua se almacena en diversos embalses a medida que se mueve a través de este ciclo. El más grande, con mucho, son los océanos, representando 97% del volumen (Figura\(\PageIndex{2}\)). Por supuesto, esa agua es salada. El 3% restante es agua dulce. Dos tercios de nuestra agua dulce se almacena en el suelo y un tercio se almacena en hielo. El agua dulce restante —aproximadamente 0.03% del total— se almacena en lagos, arroyos, vegetación y la atmósfera.
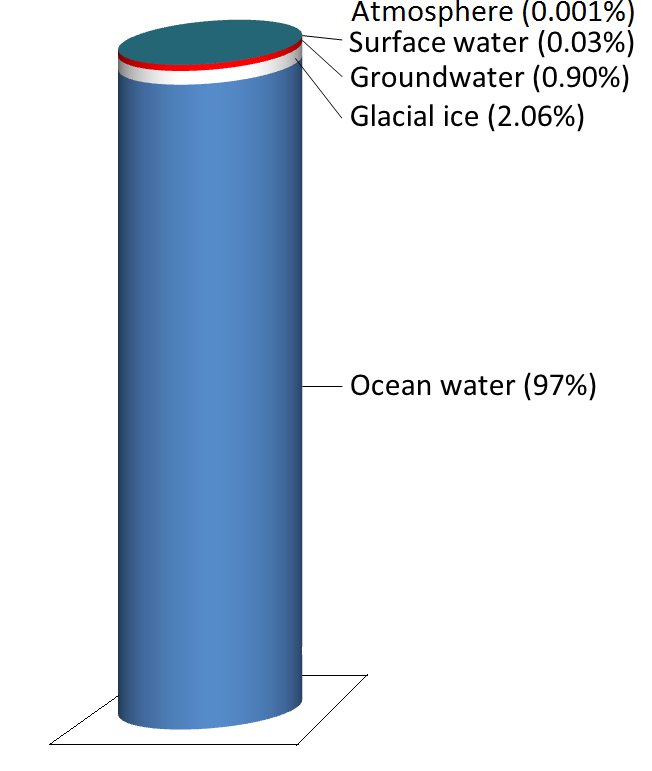
Para poner eso en perspectiva, pensemos en poner toda el agua de la Tierra en una jarra de 1 L. Comenzamos casi llenando la jarra con 970 ml de agua y 34 g de sal. Luego agregamos un cubito de hielo de tamaño regular (~20 mL) (que representa hielo glacial) y dos cucharaditas (~10 mL) de agua subterránea. Toda el agua que vemos a nuestro alrededor en lagos y arroyos y arriba en el cielo se puede representar agregando tres gotas más de un cuentagotas.
Si bien la proporción de agua de la Tierra que se encuentra en la atmósfera es pequeña, el volumen real es enorme. En un momento dado, existe el equivalente a aproximadamente 13,000 km 3 de agua en el aire en forma de vapor de agua y gotas de agua en nubes. El agua se evapora de los océanos, la vegetación y los lagos a una velocidad de 1,580 km 3 diarios, y casi exactamente el mismo volumen cae que la lluvia y la nieve todos los días, tanto sobre los océanos como sobre la tierra. La precipitación que cae sobre tierra se remonta al océano en forma de flujo de arroyo (117 km 3 /día) y flujo de agua subterránea (6 km 3 /día).
¿Cómo se salaron los océanos?
La desgasificación fue la responsable de la formación del océano, pero ¿cómo se saló el agua del océano? La mayoría de las sales y elementos disueltos en el océano probablemente fueron desgasificados junto con el vapor de agua, por lo que el océano probablemente siempre ha sido casi tan salado como lo es ahora. Pero sabemos que las lluvias y otros procesos meteoralizan rocas en la superficie de la Tierra, y la escorrentía transporta sustancias disueltas al océano, contribuyendo a su salinidad. Sin embargo, a pesar de este aporte constante, la composición de sal del océano sigue siendo esencialmente la misma. Por lo tanto, la tasa de entrada de nuevo material debe equilibrarse con la tasa de remoción; es decir, los océanos se encuentran en estado estacionario en lo que respecta a la salinidad.
Existen múltiples vías a través de las cuales los iones disueltos ingresan al océano; escorrentía de arroyos y ríos, actividad volcánica, respiraderos hidrotermales (ver sección 4.11), disolución o descomposición de sustancias en el océano y entrada de agua subterránea. Los iones se eliminan del agua de mar a medida que son incorporados por organismos vivos (por ejemplo, en la producción de conchas) o sedimentos, pulverización de mar, percolación de agua en la corteza o cuando el agua de mar se aísla del océano y se evapora.
La relación entre la entrada y la remoción de un ion puede examinarse a través del concepto de tiempo de residencia, que es el tiempo promedio de tiempo que un solo átomo de un elemento permanece en el océano antes de ser removido. El tiempo de residencia se calcula como:

Existe una gran variación en los tiempos de residencia para diferentes sustancias (Cuadro 5.2.1). En términos generales, las sustancias que se utilizan fácilmente en procesos biológicos tienen tiempos de residencia cortos, ya que se agotan a medida que están disponibles. Las sustancias con tiempos de residencia más largos son menos reactivas y pueden formar parte de ciclos geológicos a gran escala.
[tabla id=4/]
Entonces, ¿qué pasa con los lagos? Están sometidos a escorrentía y entrada fluvial, entonces, ¿por qué no son salados como los océanos? Una razón es que en comparación con los océanos, los lagos y estanques son fenómenos relativamente temporales, por lo que no duran lo suficiente como para acumular los mismos niveles de iones que los océanos. Además, los lagos a menudo tienen ríos que fluyen tanto dentro como fuera de ellos, por lo que muchos iones se eliminan a través de la salida, finalmente encontrando su camino hacia los océanos. Los océanos solo reciben entrada fluvial; no hay ríos que fluyan fuera del océano para eliminar estos materiales, por lo que se encuentran en mayor abundancia en el agua de mar. Cabe señalar que existen algunos lagos que contienen agua cuyo contenido de sal puede rivalizar o superar al del océano; estos lagos suelen carecer de desembocadura fluvial. El Gran Lago Salado en el oeste de Estados Unidos es un ejemplo.
*” Geología Física” de Steven Earle utilizada bajo licencia internacional CC-BY 4.0. Descarga este libro gratis en http://open.bccampus.ca


