5.1: Propiedades del Agua
- Page ID
- 89478
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La característica más obvia de los océanos es que contienen agua. El agua es tan ubicua que puede no parecer una sustancia muy interesante, pero tiene muchas propiedades únicas que impactan en los procesos oceanográficos y climatológicos globales. Muchos de estos procesos se deben a la formación de enlaces de hidrógeno entre las moléculas de agua.
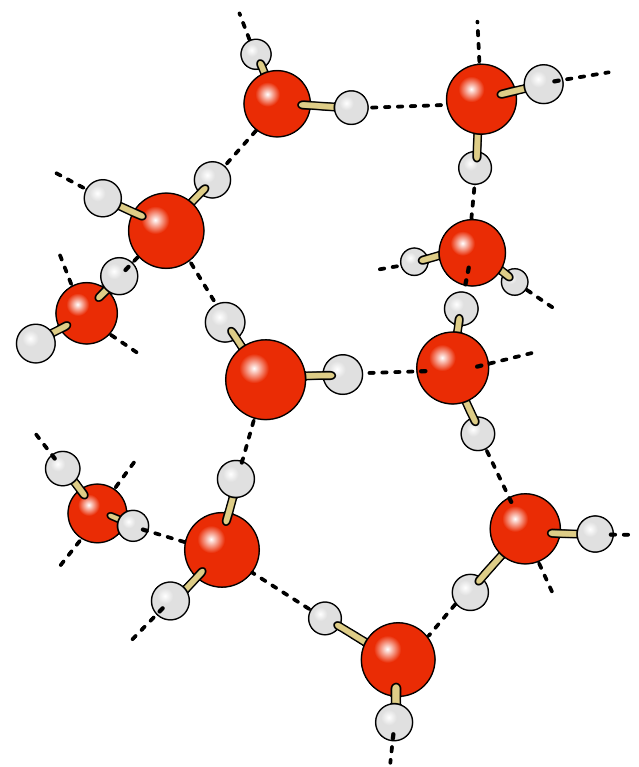
La molécula de agua consta de dos átomos de hidrógeno y un átomo de oxígeno. Los electrones responsables de los enlaces entre los átomos no se distribuyen por igual a lo largo de la molécula, de manera que los extremos de hidrógeno de las moléculas de agua tienen una ligera carga positiva, y el extremo de oxígeno tiene una ligera carga negativa, haciendo del agua una molécula polar. El lado de oxígeno negativo de la molécula forma una atracción hacia el extremo positivo de hidrógeno de una molécula vecina. Esta fuerza de atracción bastante débil se llama enlace de hidrógeno (Figura\(\PageIndex{1}\)). Si no fuera por los enlaces de hidrógeno, el agua se vaporizaría a -68 o C, lo que significa que el agua líquida (y así la vida) no podría existir en la Tierra. Estos enlaces de hidrógeno son responsables de algunas de las propiedades únicas del agua:
1. El agua es la única sustancia que existe naturalmente en forma sólida, líquida y gaseosa bajo el rango normal de temperaturas y presiones que se encuentran en la Tierra. Esto se debe a los puntos de congelación y vaporización relativamente altos del agua (ver más abajo).
2. El agua tiene una alta capacidad calorífica, que es la cantidad de calor que se debe agregar para elevar su temperatura. El calor específico es el calor requerido para elevar la temperatura de 1 g de una sustancia en 1 o C. El agua tiene el calor específico más alto de cualquier líquido excepto el amoníaco (Cuadro 5.1.1).
[tabla id=3/]
Por lo tanto, el agua es uno de los líquidos más difíciles de calentar o enfriar; puede absorber grandes cantidades de calor sin aumentar su temperatura. Recuerde que la temperatura refleja la energía cinética promedio de las moléculas dentro de una sustancia; cuanto más vigoroso es el movimiento, mayor es la temperatura. En el agua, las moléculas se mantienen unidas por enlaces de hidrógeno, y estos enlaces deben superarse para permitir que las moléculas se muevan libremente. Cuando se agrega calor al agua, la energía primero debe ir a romper los enlaces de hidrógeno antes de que la temperatura pueda comenzar a subir. Por lo tanto, gran parte del calor agregado se absorbe rompiendo los enlaces H, no aumentando la temperatura, dando al agua una alta capacidad calorífica.
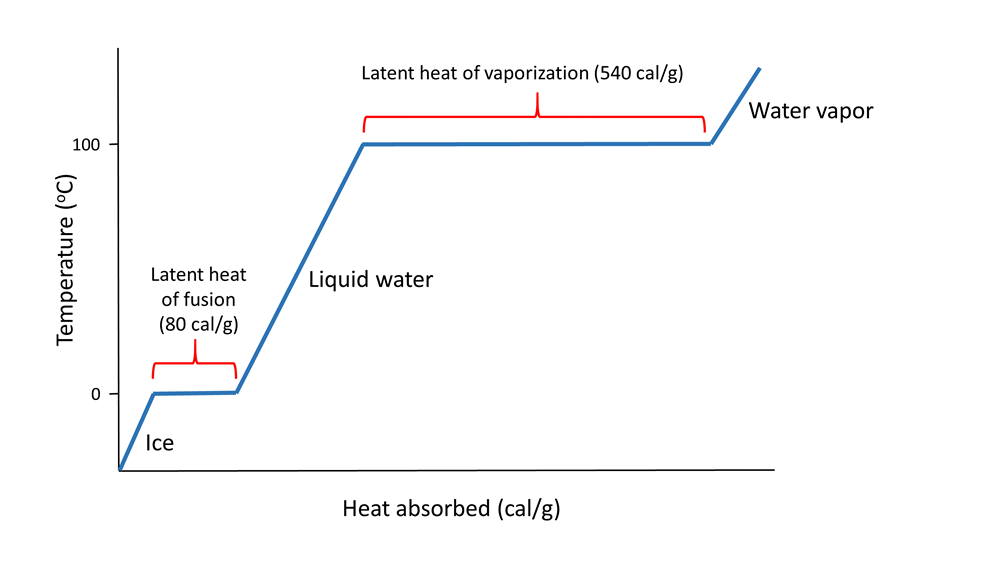
Los enlaces de hidrógeno también dan al agua un alto calor latente; el calor requerido para sufrir un cambio de fase de sólido a líquido, o líquido a gas. El calor latente de fusión es el calor requerido para pasar de sólido a líquido; 80 cal/g en el caso de que el hielo se derrita al agua. El hielo es un sólido porque los enlaces de hidrógeno mantienen las moléculas de agua en una red cristalina sólida (ver más abajo). A medida que se calienta el hielo, la temperatura sube hasta 0 o C. En ese punto, cualquier calor adicional va a fundir el hielo rompiendo los enlaces de hidrógeno, no a aumentar la temperatura. Por lo que mientras haya hielo presente, la temperatura del agua no aumentará. Es por ello que tu bebida permanecerá fría siempre y cuando contenga hielo; cualquier calor absorbido va a fundir el hielo, no a calentar la bebida.
Cuando todo el hielo se derrita, el calor adicional aumentará la temperatura del agua 1 o C por cada caloría de calor añadida, hasta que alcance los 100 o C. En ese punto, cualquier calor adicional va a superar los enlaces de hidrógeno y convertir el agua líquida en vapor de agua, en lugar de aumentando la temperatura del agua. El calor requerido para evaporar el agua líquida en vapor de agua es el calor latente de vaporización que tiene un valor de 540 cal/g (Figura\(\PageIndex{2}\)).
La alta capacidad calorífica del agua ayuda a regular el clima global, ya que los océanos absorben y liberan calor lentamente, evitando rápidos cambios de temperatura (ver sección 8.1). También significa que los organismos acuáticos no están tan sometidos a los mismos cambios rápidos de temperatura que los organismos terrestres. Un organismo oceánico profundo puede no experimentar más de un cambio de temperatura de 0.5 o C a lo largo de toda su vida, ¡mientras que una especie terrestre puede encontrar cambios de más de 20 o C en un solo día!
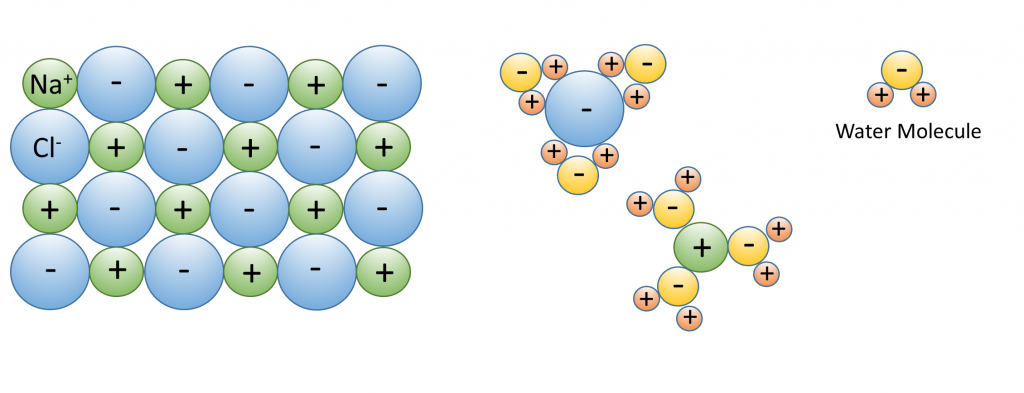
3. El agua disuelve más sustancias que cualquier otro líquido; es un “solvente universal”, razón por la cual tantas sustancias se disuelven en el océano. El agua es especialmente buena para disolver sales iónicas; moléculas hechas de iones cargados opositamente como NaCl (Na + y Cl —). En el agua, los iones cargados atraen a las moléculas polares de agua. Los iones quedan rodeados por una capa de moléculas de agua, debilitando el enlace entre los iones hasta 80 veces. Con los enlaces debilitados entre iones, la sustancia se disuelve (Figura\(\PageIndex{3}\)).
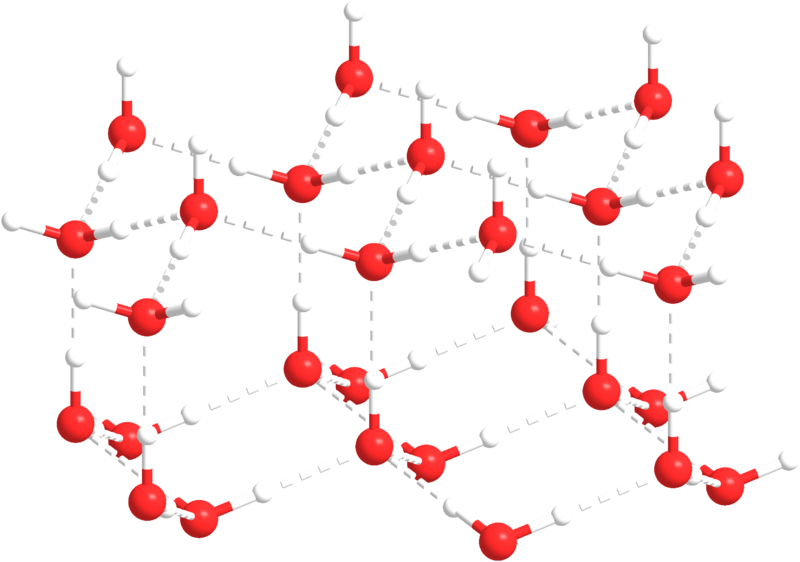
4. La fase sólida es menos densa que la fase líquida. En otras palabras, el hielo flota. La mayoría de las sustancias son más densas en forma sólida que en forma líquida, ya que sus moléculas están más estrechamente empaquetadas como un sólido. El agua es una excepción: la densidad del agua dulce es de 1.0 g/cm 3, mientras que la densidad del hielo es de 0.92 g/cm 3, y una vez más, esto se debe a la acción de los enlaces de hidrógeno.
A medida que la temperatura del agua se enfría, las moléculas disminuyen la velocidad, con el tiempo lo suficiente como para que se puedan formar enlaces de hidrógeno y mantener las moléculas de agua en una red cristalina. Las moléculas en la red están más espaciadas que las moléculas en el agua líquida, lo que hace que el hielo sea menos denso que el agua líquida (Figura\(\PageIndex{4}\)). Esto es familiar para cualquiera que alguna vez haya dejado una botella de agua llena en el congelador, solo para que estalle a medida que el agua se congela y se expande.
Pero la relación entre temperatura y densidad del agua no es simple lineal. A medida que el agua se enfría, su densidad aumenta como se esperaba, a medida que las moléculas de agua disminuyen la velocidad y se acercan. Sin embargo, el agua dulce alcanza su densidad máxima a una temperatura de 4 o C, y a medida que se enfría más allá de ese punto su densidad disminuye a medida que comienzan a formarse los enlaces de hidrógeno y aumenta el espaciamiento intermolecular (Figura\(\PageIndex{5}\) recuadrada). La densidad continúa disminuyendo hasta que la temperatura alcanza los 0 o C y se forman cristales de hielo, reduciendo drásticamente la densidad (Figura\(\PageIndex{5}\)).
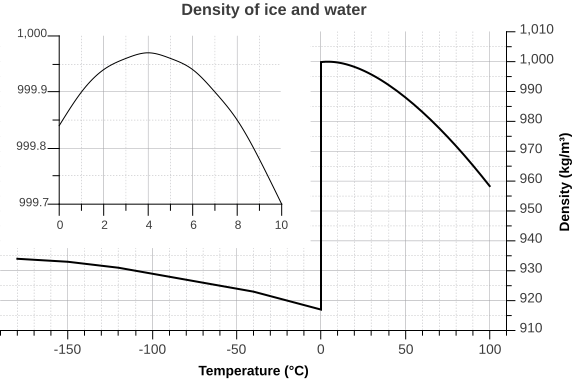
Hay una serie de implicaciones importantes para que el hielo sea menos denso que el agua. El hielo que flota en la superficie del océano ayuda a regular la temperatura del océano, y por lo tanto el clima global, al influir en la cantidad de luz solar que se refleja en lugar de absorberse (ver sección 8.1). En menor escala, el hielo superficial puede evitar que los lagos y estanques se congelen sólidos durante el invierno. A medida que el agua dulce de la superficie se enfría, el agua se vuelve más densa y se hunde hasta el fondo. El nuevo agua superficial luego se enfría y se hunde, y el proceso se repite en lo que se conoce como vuelco, con agua más densa que se hunde y agua menos densa que se mueve a la superficie solo para enfriarse y hundirse. De esta manera, todo el cuerpo de agua se enfría de manera algo uniforme. Este proceso continúa hasta que el agua superficial se enfría por debajo de 4 o C. Por debajo de 4 o C, el agua se vuelve menos densa a medida que se enfría, por lo que ya no se hunde. En cambio, permanece como superficie, haciéndose más fría y menos densa, hasta que se congela a 0 o C. Una vez que el agua dulce se congela, el hielo flota y aísla el resto del agua debajo de ella, reduciendo aún más el enfriamiento. El agua de fondo más densa aún está a 4 o C, por lo que no se congela, permitiendo que el fondo de un lago o estanque permanezca descongelado (lo cual es una buena noticia para los animales que viven allí) sin importar lo frío que haga afuera.
Las sales disueltas en el agua de mar inhiben la formación de la red cristalina y, por lo tanto, dificultan la formación de hielo. Por lo que el agua de mar tiene un punto de congelación de aproximadamente -2 o C (dependiendo de la salinidad), y se congela antes de que se alcance una temperatura de densidad máxima. Así el agua de mar seguirá hundiéndose a medida que se enfríe, hasta que finalmente se congela.
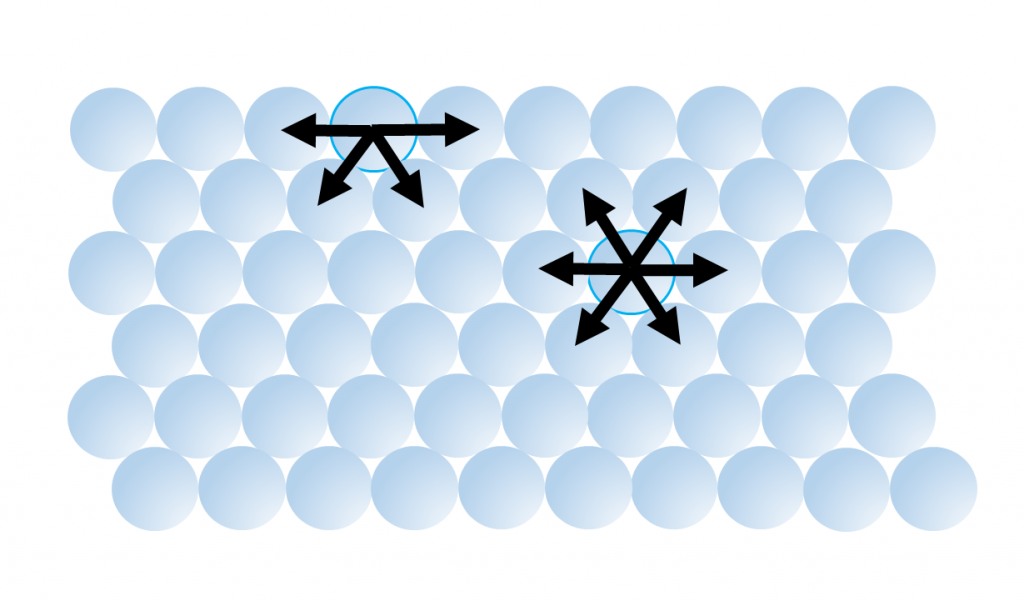
5. El agua tiene una tensión superficial muy alta, la más alta de cualquier líquido excepto el mercurio (Cuadro 5.1.2). Las moléculas de agua son atraídas entre sí por enlaces de hidrógeno. Para las moléculas que no están en la superficie del agua, están rodeadas por otras moléculas de agua en todas las direcciones, por lo que las fuerzas atractivas se distribuyen uniformemente en todas las direcciones. Pero para las moléculas en la superficie hay pocas moléculas adyacentes por encima de ellas, solo por debajo, por lo que todas las fuerzas atractivas se dirigen hacia adentro, lejos de la superficie (Figura\(\PageIndex{6}\)). Esta fuerza hacia adentro es lo que hace que las gotas de agua tomen una forma esférica, y que el agua se acumule sobre una superficie, ya que la forma esférica proporciona el área superficial mínima posible. Estas fuerzas atractivas también hacen que la superficie del agua actúe como una “piel” elástica que permite que cosas como insectos se asienten en la superficie del agua sin hundirse.
[tabla id=8/]


