7.9: Gases disueltos en agua de mar
- Page ID
- 89672
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Gases Disueltos en Agua de Mar
Las concentraciones de oxígeno (O 2) en el aire es de aproximadamente 21% de oxígeno, en el agua es una pequeña fracción de 1%. Esta gran diferencia en las concentraciones de oxígeno obliga al oxígeno a disolverse en agua a lo largo del límite entre el aire y el agua. Cuando el viento sopla creando olas, aumenta la superficie, permitiendo que se produzca más difusión.
El dióxido de carbono (CO 2) es mucho más soluble en agua que en oxígeno, pero las concentraciones en la atmósfera son comparativamente muy bajas. Cuando se disuelve en agua se convierte en un ion bicarbonato (- HCO 3), por lo que el dióxido de carbono se difunde fácilmente a la atmósfera si no se consume en la producción de carbonato de calcio (CaCo 3). La respiración biológica libera - HCO 3 que se combina con calcio disuelto disponible que el organismo excreta o incorpora a su estructura esquelética si las condiciones ambientales son lo suficientemente cálidas para que el CaCo 3 persista. Una de las preocupaciones más graves sobre la quema de combustibles fósiles es que está aumentando la concentración de dióxido de carbono en el agua de mar, por lo que los organismos que producen conchas de carbonato y esqueletos se ven afectados negativamente.
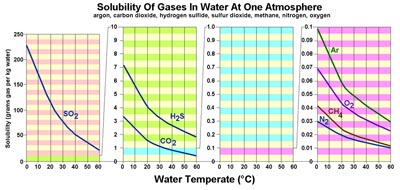 Figura 7.28. La solubilidad de los gases en el agua se ve afectada por la temperatura. Los gases son mucho más solubles en agua fría que en agua tibia. En contraste, la mayoría de los materiales sólidos (orgánicos e inorgánicos; ejemplos sal y azúcar) son más solubles en agua caliente. La solubilidad de los elementos en el agua de mar es compleja y depende de muchos factores, incluyendo pH (ácido-base), eH (oxidación-reducción), temperatura, presión e interacciones entre otros compuestos disueltos en agua de mar.
Figura 7.28. La solubilidad de los gases en el agua se ve afectada por la temperatura. Los gases son mucho más solubles en agua fría que en agua tibia. En contraste, la mayoría de los materiales sólidos (orgánicos e inorgánicos; ejemplos sal y azúcar) son más solubles en agua caliente. La solubilidad de los elementos en el agua de mar es compleja y depende de muchos factores, incluyendo pH (ácido-base), eH (oxidación-reducción), temperatura, presión e interacciones entre otros compuestos disueltos en agua de mar.
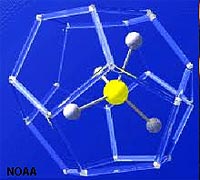
El metano (CH 4) tiene muy baja solubilidad en agua de mar, sin embargo, es muy abundante en sedimentos ricos en materia orgánica. En entornos fríos, el metano, el dióxido de carbono y el agua forman una forma inusual de hielo llamada hidrato de metano (Figuras 7-29 y 7-30).
Un clatrato es un compuesto en el que moléculas de un componente quedan atrapadas físicamente dentro de la estructura cristalina de otro, en este caso CO 2 y CH 4 quedan atrapadas en la estructura cristalina del hielo bajo cierta presión y temperatura condición que existen en el fondo marino en aguas frías, principalmente en las plataformas continentales exteriores y laderas en regiones polares. El calentamiento global de los océanos puede provocar la liberación de tremendas cantidades de CO 2 y CH 4 del fondo marino, contribuyendo a condiciones de anoxia, con posibles consecuencias catastróficas. Lea sobre la "Hipótesis del arma de clatrato" (Wikipedia).
 |
 |
| Figura 7.29. Estructura de clatrato de metano-hielo | Figura 7.30. ¡Los clatratos de metano-hielo arderán! |
El dióxido de azufre (SO 2) es extremadamente soluble en agua. El dióxido de azufre es un gas que huele a huevos podridos. Se libera en grandes cantidades por erupciones volcánicas, incendios forestales y por la quema de carbón y petróleo. SO 2 es extremadamente soluble en agua donde se combina con moléculas de agua para formar iones sulfato (-HSO 4). Cuando se concentra (cuando se elimina el agua), la solución se convierte en ácido sulfúrico (H 2 SO 4). Cuando se concentra por evaporación de agua de mar (donde están presentes calcio disuelto y otros iones metálicos) los iones sulfato precipitan como las sales yeso (CaSO 4 ·2H 2 O), anhidrita (CaSO 4 ), sal epson (MgSO 4 ·7H 2 O) y otros minerales salinos.



