8.2: Propiedades del Agua
- Page ID
- 81106
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
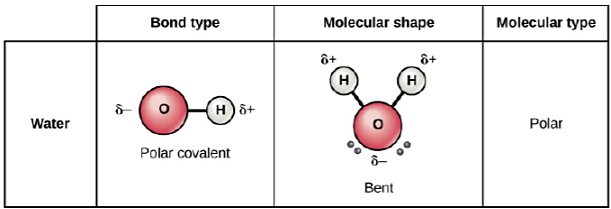
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Una molécula de agua está compuesta por un átomo de oxígeno y dos átomos de hidrógeno que están unidos entre sí por enlaces covalentes polares. Covalente significa que los átomos comparten electrones, en lugar de renunciar completamente a los electrones entre sí. Polar significa que los electrones no se comparten por igual. Estos enlaces covalentes polares (Figura 8.2.1), junto con la forma molecular, hacen que la molécula de agua tenga una carga ligeramente positiva en el extremo hidrógeno y una carga ligeramente negativa en el lado del oxígeno. Las cargas de agua se generan porque el oxígeno es más electronegativo que el hidrógeno, lo que hace más probable que se encuentre un electrón compartido cerca del núcleo de oxígeno que el núcleo de hidrógeno, generando así la carga negativa parcial cerca del oxígeno. Esto le da a las moléculas de agua sus propiedades de atracción.
.png)
Enlaces de hidrógeno
Debido a la polaridad del agua, cada molécula de agua atrae a otras moléculas de agua ya que los extremos de las moléculas con carga de oposición se atraen entre sí. Cuando esto sucede, se produce una interacción débil entre el extremo positivo de hidrógeno de una molécula y el extremo negativo de oxígeno de otra molécula. Esta interacción se llama un enlace de hidrógeno. Este enlace de hidrógeno contribuye a las siguientes propiedades únicas del agua.
1. El agua es el solvente universal
2. Existe en la naturaleza como sólido, líquido y gas
3. La densidad del hielo es menor que el agua líquida
4. El agua tiene una alta tensión superficial
5. El agua tiene una alta capacidad calorífica
6. El agua existe como líquido a temperatura ambiente Es importante señalar aquí que incluso solo nos estamos enfocando en el agua en este libro de texto, los enlaces de hidrógeno también se producen en otras sustancias que tienen moléculas polares.
Estado Físico del Agua en la Tierra
El agua en la Tierra puede existir naturalmente como sólida, líquida o gaseosa dependiendo de las condiciones de temperatura y presión predominantes. La formación de enlaces de hidrógeno (descrita anteriormente) es una cualidad importante del agua líquida que es crucial para la vida tal como la conocemos en la Tierra. A medida que las moléculas de agua forman enlaces de hidrógeno entre sí, el agua líquida adquiere algunas características físicas y químicas únicas en comparación con otros líquidos. En el agua líquida, los enlaces de hidrógeno se forman constantemente y se rompen a medida que las moléculas de agua se deslizan unas junto a otras. La energía de las moléculas de agua en movimiento (energía cinética) es responsable de romper los enlaces. Cuando se agrega calor al agua (aumentando la temperatura), la energía cinética de las moléculas sube y se rompen más enlaces. A medida que se agrega más calor al agua hirviendo, la mayor energía cinética de las moléculas de agua hace que los enlaces de hidrógeno se rompan por completo y les permitan escapar al aire como vapor de agua. Por otro lado, cuando la temperatura del agua se reduce y el agua se congela, las moléculas de agua forman una estructura cristalina mantenida por enlaces de hidrógeno (ya que no hay suficiente energía para romper los enlaces de hidrógeno). La estructura cristalina, el hielo, tiene una estructura más abierta que la forma líquida del agua. La estructura abierta del hielo (Figura\(\PageIndex{2}\)) hace que el hielo sea menos denso que el agua líquida, fenómeno que no se ve en la solidificación de otros líquidos.
La menor densidad de hielo, ilustrada en la Figura\(\PageIndex{2}\), hace que flote en la superficie del agua líquida, como un iceberg en el océano o cubitos de hielo en un vaso de agua helada. En lagos y estanques, se formará hielo en la superficie del agua creando una barrera aislante que protege de la congelación a los animales y a la vida vegetal que viven en el agua. Sin esta capa de hielo aislante, las plantas y animales que viven en el agua se congelarían en el bloque sólido de hielo y no sobrevivirían. Los cristales de hielo que se forman al congelarse romperían las delicadas membranas esenciales para la función de las células vivas, dañándolas irreversiblemente.
.png)
Alta capacidad calorífica
El agua tiene la mayor capacidad calorífica específica de cualquier líquido. La alta capacidad calorífica del agua es una propiedad causada por los enlaces de hidrógeno entre las moléculas de agua. El calor específico se define como la cantidad de calor que un gramo de una sustancia debe absorber o perder para cambiar su temperatura en un grado Celsius. Para el agua, esta cantidad es de una caloría. El agua tarda mucho en calentarse y mucho tiempo enfriarse. De hecho, la capacidad calorífica específica del agua es aproximadamente cinco veces más que la de la arena. Esto explica por qué la tierra se enfría más rápido que el mar. Debido a su alta capacidad calorífica, los animales de sangre caliente utilizan el agua para dispersar el calor de manera más uniforme y mantener la temperatura en sus cuerpos: actúa de manera similar al sistema de enfriamiento de un automóvil, transportando calor de lugares cálidos a lugares fríos, haciendo que el cuerpo mantenga una temperatura más uniforme.
Calor de Vaporización
El agua también tiene un alto calor de vaporización, la cantidad de energía requerida para cambiar un gramo de una sustancia líquida a un gas. Se requiere una cantidad considerable de energía térmica (586 calorías) para lograr este cambio en el agua. Este proceso ocurre en la superficie del agua. A medida que el agua líquida se calienta, los enlaces de hidrógeno dificultan la separación de las moléculas de agua líquida entre sí, lo que se requiere para que entre en la fase gaseosa (vapor). Así, el agua actúa como disipador de calor y requiere mucho más calor para hervir que líquidos como el etanol, cuyos enlaces de hidrógeno son más débiles. Eventualmente, a medida que el agua alcanza su punto de ebullición de 100° Celsius (212° Fahrenheit), el calor puede romper los enlaces de hidrógeno entre las moléculas de agua, y la energía cinética entre las moléculas de agua les permite escapar del líquido como un gas. Incluso cuando están por debajo de su punto de ebullición, las moléculas individuales del agua adquieren suficiente energía de otras moléculas de agua de manera que algunas moléculas de agua superficial pueden escapar y vaporizarse: este proceso se conoce como evaporación.
Dado que los enlaces de hidrógeno necesitan romperse para que el agua se evapore significa que se usa una cantidad sustancial de energía en el proceso de evaporación. A medida que el agua se evapora, la energía es absorbida por el proceso, enfriando el ambiente donde se está produciendo la evaporación. En muchos organismos vivos, incluso en los humanos, la evaporación del sudor, que es 90 por ciento de agua, permite que el organismo se enfríe para que se pueda mantener la homeostasis de la temperatura corporal.
El agua es un solvente
Dado que el agua es una molécula polar con cargas ligeramente positivas y ligeramente negativas, los iones y las moléculas polares pueden disolverse fácilmente en ella. El agua es, por lo tanto, referida como solvente, porque es capaz de disolver más sustancias (sustancias polares) que cualquier otro líquido. Las cargas asociadas a estas moléculas formarán enlaces de hidrógeno con el agua, rodeando la partícula con moléculas de agua. Esto es muy importante ya que permite que el agua disuelva diversos químicos y los distribuya dentro de los organismos vivos, incluida la extracción de sustancias tóxicas de los seres vivos, y en el medio ambiente.
Propiedades cohesivas y adhesivas del agua
¿Alguna vez has llenado un vaso de agua hasta la parte superior y luego lentamente agregaste algunas gotas más? Antes de que se desborde, el agua forma una forma de cúpula sobre el borde del vidrio (Figura\(\PageIndex{3}\))
.png)
Esta agua puede permanecer por encima del vidrio debido a sus propiedades cohesivas. En cohesión, las moléculas de agua son atraídas entre sí (debido a los enlaces de hidrógeno), manteniendo las moléculas juntas en la interfaz líquido-gas (agua-aire), aunque no hay más espacio en el vidrio. La cohesión permite el desarrollo de tensión superficial, la capacidad de una sustancia para resistir la ruptura cuando se coloca bajo tensión o tensión. Esta es también la razón por la que el agua forma gotitas cuando se coloca sobre una superficie seca en lugar de aplanarse por gravedad (Figura\(\PageIndex{3}\))
.png)
Cuando una aguja de acero se coloca cuidadosamente sobre el agua, no se hunde aunque el acero sea más denso (más pesado) que el agua. La cohesión y la tensión superficial mantienen intactos los enlaces de hidrógeno de las moléculas de agua y soportan el artículo flotando en la parte superior. Incluso es posible que un insecto “flote” en el agua si se sienta suavemente sin romper la tensión superficial, como se muestra en la Figura\(\PageIndex{5}\).
.png)
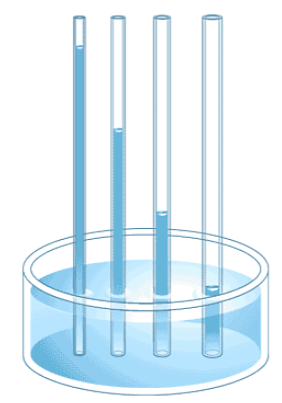
Otra propiedad importante del agua es la adhesión, o la atracción entre las moléculas de agua y otras moléculas. Esta atracción es a veces más fuerte que las fuerzas cohesivas del agua, especialmente cuando el agua se expone a superficies cargadas como en el interior de tubos de vidrio delgados conocidos como tubos capilares. La adherencia se observa cuando el agua “sube” por el tubo colocado en un vaso de agua: observe que el agua parece estar más alta en los lados del tubo que en el medio. Esto se debe a que las moléculas de agua son atraídas por las paredes de vidrio cargadas del tubo capilar más de lo que son entre sí y, por lo tanto, se adhieren a él. Este tipo de adhesión se denomina acción capilar, y se ilustra en la Figura\(\PageIndex{6}\). Este proceso también está involucrado en el movimiento de agua y nutrientes desde el suelo alrededor de los sistemas radiculares a otras partes de las plantas por encima del suelo.
.png)

