2.2: Sensores espectroscópicos ópticos visibles y de infrarrojo cercano para ingeniería de biosistemas
- Page ID
- 80982
Nathalie Gorretta
Universidad de Montpellier, InRae y SuPAgro
Montpellier, Francia
Aoife A. Gowen
UCD Escuela de Biosistemas e Ingeniería de Alimentos
University College Dublin, Irlanda
Variables
Introducción
Los sensores ópticos son una amplia clase de dispositivos para detectar la intensidad de la luz. Esto puede ser un componente simple para notificar cuando la intensidad de la luz ambiental sube por encima o cae por debajo de un nivel prescrito, o un dispositivo altamente sensible con la capacidad de detectar y cuantificar diversas propiedades de la luz como intensidad, frecuencia, longitud de onda o polarización. Entre estos sensores, los sensores espectroscópicos ópticos, donde la interacción de la luz con una muestra se mide a muchas longitudes de onda diferentes, son herramientas populares para la caracterización de recursos biológicos, ya que facilitan un monitoreo integral, no invasivo y no destructivo. Los sensores ópticos son ampliamente utilizados en el control y caracterización de diversos entornos biológicos, incluyendo procesamiento de alimentos, agricultura, clasificación de desechos orgánicos y control de digestatos.
La teoría de la espectroscopia comenzó en el siglo XVII. En 1666, Isaac Newton demostró que la luz blanca del sol podría dispersarse en una serie continua de colores (Thomas, 1991), acuñando la palabra espectro para describir este fenómeno. Muchos otros investigadores contribuyeron entonces al desarrollo de esta técnica al mostrar, por ejemplo, que la radiación del sol no se limitaba a la porción visible del espectro electromagnético. William Herschel (1800) y Johann Wilhelm Ritter (1801) demostraron que la radiación del sol se extendía hacia el infrarrojo y ultravioleta, respectivamente. Una importante contribución de Joseph Fraunhofer en 1814 sentó las bases para la espectrometría cuantitativa. Extendió el descubrimiento de Newton al observar que el espectro del sol estaba atravesado por un gran número de finas líneas oscuras ahora conocidas como líneas Fraunhofer. También desarrolló un elemento esencial de futuras herramientas de medición del espectro (espectrómetros) conocido como la rejilla de difracción, una matriz de hendiduras que dispersa la luz. A pesar de estos grandes avances, Fraunhofer no pudo dar una explicación sobre el origen de las líneas espectrales que había observado. Fue solo más tarde, en la década de 1850, cuando Gustav Kirchoff y Robert Bunsen demostraron que cada átomo y molécula tiene su propio espectro característico. Sus logros establecieron la espectroscopia como una herramienta científica para sondear la estructura atómica y molecular (Thomas, 1991; Bursey, 2017).
Muchos términos se utilizan para describir la medición de energía electromagnética a diferentes longitudes de onda, como espectroscopia, espectrometría y espectrofotometría. La palabra espectroscopia se origina a partir de la combinación de spectro (del vocablo latino specere, que significa “mirar”) con scopy (del vocablo griego skopia, que significa “ver”). Siguiendo los logros de Newton, el término espectroscopia se aplicó por primera vez para describir el estudio de la luz visible dispersada por un prisma en función de su longitud de onda. El concepto de espectroscopia se extendió, durante una conferencia de Arthur Schuster en 1881 en la Royal Institution, para incorporar cualquier interacción con la energía radiativa según su longitud de onda o frecuencia (Schuster, 1911). La espectroscopia, entonces, puede resumirse como el estudio científico de la radiación electromagnética emitida, absorbida, reflejada o dispersada por átomos o moléculas. La espectrometría o espectrofotometría es la medición cuantitativa de la energía electromagnética emitida, reflejada, absorbida o dispersada por un material en función de la longitud de onda. El sufijo “- foto” (originario del término griego phôs, que significa “luz”) se refiere a la observación visual, por ejemplo, impresión en película fotográfica, proyección en una pantalla, o el uso de un alcance de observación, mientras que el sufijo “- metría” (del término griego metria, es decir, el proceso de medición) se refiere a la grabación de una señal por un dispositivo (plotter o grabación electrónica).
Los datos espectroscópicos se representan típicamente por un espectro, una gráfica de la respuesta de interés (por ejemplo, reflectancia, transmitancia) en función de la longitud de onda o frecuencia. El instrumento utilizado para obtener un espectro se denomina espectrómetro o espectrofotómetro. El espectro, que representa la interacción de la radiación electromagnética con la materia, puede analizarse para obtener información sobre la identidad, estructura y niveles de energía de átomos y moléculas en una muestra.
Se han definido dos tipos principales de espectroscopía, atómica y molecular. La espectroscopia atómica se refiere al estudio de la radiación electromagnética absorbida o emitida por los átomos, mientras que la espectroscopia molecular se refiere al estudio de la luz absorbida o emitida por las moléculas. La espectroscopia molecular proporciona información sobre las funciones químicas y la estructura de la materia, mientras que la espectroscopia atómica proporciona información sobre la composición elemental de una muestra. Este capítulo se centra en la espectroscopia molecular, particularmente en la región de longitud de onda del infrarrojo visible-cercano debido a su relevancia en la ingeniería de biosistemas.
Conceptos
Interacción Luz y Materia
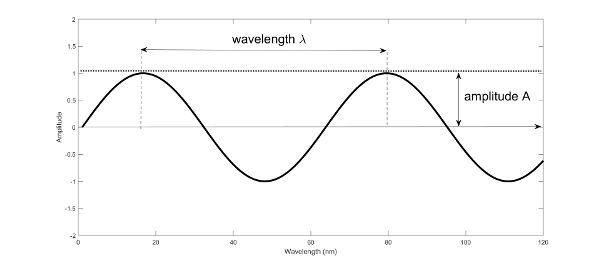
La espectroscopia se basa en la forma en que la energía electromagnética interactúa con la materia. Toda la luz se clasifica como radiación electromagnética consistente en campos eléctricos y magnéticos alternos y se describe clásicamente por un movimiento continuo sinusoidal ondulatorio de los campos eléctrico y magnético que se propagan transversalmente en el espacio y el tiempo. El movimiento de las olas puede describirse por su longitud de onda\(\lambda\) (nm), la distancia entre máximos o mínimos sucesivos, o por su frecuencia ν (Hz), el número de oscilaciones del campo por segundo (Figura 2.2.1). La longitud de onda se relaciona con la frecuencia a través de la velocidad de la luz c (3 × 10 8 m s −1) de acuerdo con la relación dada en la Ecuación 2.2.1.
\[ \lambda = \frac{c}{v} \]
A veces es conveniente describir la luz en términos de unidades llamadas “números de onda”, donde el número de onda es el número de ondas en un centímetro. Por lo tanto, los números de onda se utilizan frecuentemente para caracterizar la radiación infrarroja. El número de onda,\(\bar{\nu}\) se define formalmente como el inverso de la longitud de onda,\(\lambda\) expresado en centímetros:
\[ \bar{\nu}=\frac{1}{\lambda} \]
Por lo tanto, el número de onda es directamente proporcional a la frecuencia, ν:
\[ v = c\bar{\nu} \]
lo que lleva a las siguientes relaciones de conversión:
\[ \bar{\nu} (\text{cm}^{-1}) = \frac{10^{7}}{\lambda{\text{(nm)}}} \]
\[ \lambda{\text{(nm)} = \frac{10^{7}}{\bar{\nu}(\text{cm}^{-1})}} \]
La propagación de la luz es descrita por la teoría de las ondas electromagnéticas propuesta por Christian Huygens en 1878 (Huygens, 1912). Sin embargo, la interacción de la luz con la materia (emisión o absorción) también conduce a la naturaleza de partículas de la luz y las ondas electromagnéticas tal como propusieron Planck y Einstein a principios del siglo XX. En esta teoría, se considera que la luz consiste en partículas llamadas fotones, que se mueven a la velocidad c. Los fotones son “paquetes” de energía elemental, o cuanta, que se intercambian durante la absorción o emisión de luz por la materia.
| Longitud de onda \(\lambda\) |
Onda \(\bar{\nu}\) |
Relación | |
|---|---|---|---|
|
Unidad |
cm |
cm −1 |
\(\bar{\nu}= \frac{1}{\lambda}\) |
|
nm |
cm −1 |
\(\bar{\nu}= \frac{10^{7}}{\lambda}\) |
La energía de los fotones de luz es directamente proporcional a su frecuencia, como lo describe la relación fundamental de Planck (Ecuación 2.2.6). Así, la radiación de alta energía (como los rayos X) tiene altas frecuencias y longitudes de onda cortas y, inversamente, la radiación de baja energía (como las ondas de radio) tiene frecuencias bajas y longitudes de onda largas.
\[ E =h\nu=\frac{hc}{\lambda}=hc\bar{\nu} \]
donde E = energía de fotones de luz (J)
h = Constante de Plank = 6.62607004 × 10 −34 J·s
ν = frecuencia (Hz)
c = velocidad de la luz (3 ×10 8 m s −1)
\(\lambda\)= longitud de onda (m)
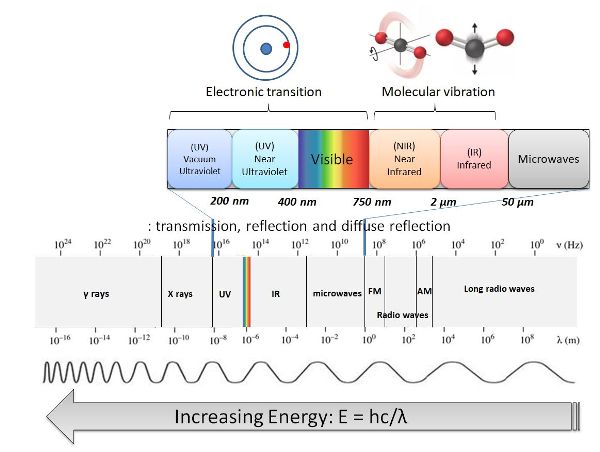
El espectro electromagnético es la división de la radiación electromagnética según sus diferentes componentes en términos de frecuencia, energía fotónica o longitudes de onda asociadas, como se muestra en la Figura 2.2.2. La radiación de mayor energía corresponde a la región de rayos γ del espectro. En el otro extremo del espectro electromagnético, las frecuencias de radio tienen muy baja energía (Pavía et al., 2008). La región visible solo constituye una pequeña parte del espectro electromagnético y oscila entre 400 y aproximadamente 750 nm. La región espectral infrarroja (IR) es adyacente a la región espectral visible y se extiende desde aproximadamente 750 nm hasta aproximadamente 5 × 10 6 nm. Se puede subdividir además en la región del infrarrojo cercano (NIR) de aproximadamente 750 nm a 2,500 nm que contiene el infrarrojo de onda corta (SWIR) de 1100—2500 nm, la región del infrarrojo medio (MIR) de 2,500 nm a 5 × 10 4 nm, y el infrarrojo lejano (FIR) ) de 5 × 10 4 nm a 5 × 10 6 nm (Osborne et al., 1993).
Cuando la radiación electromagnética choca con una molécula, se modifica la configuración electrónica de la molécula. Esta modificación está relacionada con la longitud de onda de la radiación y consecuentemente con su energía. La interacción de una ola con la materia, cualquiera que sea su energía, se rige por el modelo atómico de Bohr y las leyes derivadas establecidas por Bohr, Einstein, Planck y De Broglie (Bohr, 1913; De Broguie, 1925). Los átomos y las moléculas sólo pueden existir en ciertos estados energéticos cuantificados. Los intercambios de energía entre la materia y la radiación pueden, por lo tanto, solo hacerse por cantidades específicas de energía o cuanta\( \Delta{E} =h\nu \). Estos intercambios de energía se pueden llevar a cabo de tres formas principales (Figura 2.2.3): absorción, emisión o difusión.
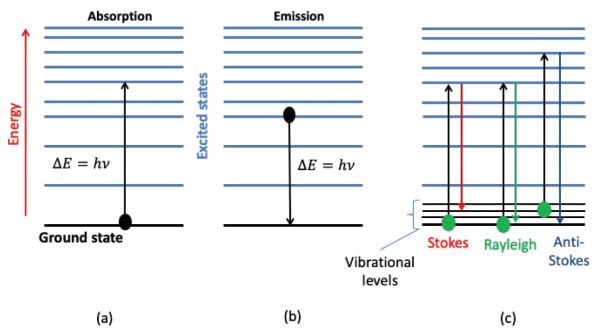
En la espectroscopia de absorción, un fotón es absorbido por una molécula, la cual experimenta una transición de un estado de menor energía E i a un estado de mayor energía o excitado E j tal que E j — E i = h ν. En espectroscopia de emisión, un fotón puede ser emitido por una molécula que experimenta una transición de un estado de energía superior E j a un estado de energía inferior E i tal que E j — E i = h ν. En la espectroscopia de difusión o dispersión, una parte de la radiación que interactúa con la materia es dispersada en muchas direcciones por las partículas de la muestra. Si, después de una interacción, la energía fotónica no se modifica, la interacción se conoce como elástica. Esto corresponde a Rayleigh o dispersión elástica, que mantiene la frecuencia de la onda incidente. Cuando el fotón toma o le da energía a la materia y sufre un cambio de energía, la interacción se denomina inelástica, correspondiente, respectivamente, a la dispersión de Stokes o Raman anti-Stokes. Las transiciones entre estados de energía se denominan líneas de absorción o emisión para espectroscopía de absorción y emisión, respectivamente.
Espectrometría de Absorción
En la espectrometría de absorción, las transiciones entre estados de energía se denominan líneas de absorción. Estas líneas de absorción se clasifican típicamente por la naturaleza del cambio de configuración electrónica inducido en la molécula (Sun, 2009):
- • Las líneas de rotación ocurren cuando se cambia el estado rotacional de una molécula. Se encuentran típicamente en la región espectral de microondas que oscilan entre 100 μm y 1 cm.
- • Las líneas vibracionales ocurren cuando se cambia el estado vibratorio de la molécula. Se encuentran típicamente en el IR, es decir, en el rango espectral entre 780 y 25,000 nm. Los armónicos y combinaciones de las vibraciones fundamentales en el IR se encuentran en el rango NIR (Figura 2.2.2).
- • Las líneas electrónicas corresponden a un cambio en el estado electrónico de una molécula (transiciones de los niveles energéticos de los orbitales de valencia). Se encuentran típicamente en la región ultravioleta (aprox. 200—400 nm) y visible (aprox. 200—400 nm). En la región visible (350—800 nm), moléculas como carotenoides y clorofilas absorben la luz debido a su estructura molecular. Este rango espectral visible también se utiliza para evaluar el color (por ejemplo, de alimentos o vegetación). En el rango espectral ultravioleta se puede observar fluorescencia y fosforescencia. Si bien la fluorescencia y la fosforescencia son ambas emisión espontánea de radiación electromagnética, difieren en la forma en que la molécula excitada pierde su energía después de haber sido irradiada. El resplandor de la fluorescencia se detiene justo después de que se apaga la fuente de radiación excitatoria, mientras que para la fosforescencia, una posluminiscencia puede durar desde fracciones de segundo hasta horas.
Los rangos espectrales seleccionados para la medición y análisis dependen de la aplicación y los materiales a caracterizar. La espectroscopia de absorción en el visible y el NIR se usa comúnmente para la caracterización de sistemas biológicos debido a las muchas ventajas asociadas con este rango de longitud de onda, incluyendo rapidez, no invasividad, medición no destructiva y penetración significativa de ondas incidentes. Además, el rango NIR permite sondear moléculas que contienen enlaces C-H, N-H, S-H y O-H, que son de particular interés para la caracterización de muestras biológicas (Pasquini, 2018; 2003). Además de la caracterización química de materiales, es posible cuantificar la concentración de ciertas moléculas utilizando la ley Beer-Lambert, descrita con detalle a continuación.
Ley Beer-Lambert
La radiación incidente que pasa por un medio sufre varios cambios, cuya extensión depende de las propiedades físicas y químicas del medio. Normalmente, parte del haz incidente se refleja, otra parte es absorbida y transformada en calor por la interacción con el material, y el resto pasa por el medio. La transmitancia se define como la relación entre la intensidad de la luz transmitida y la intensidad de la luz incidente (Ecuación 2.2.7). La absorbancia se define como el logaritmo de la inversa de la transmitancia (Ecuación 2.2.8). La absorbancia es un valor positivo, sin unidades. Debido a la relación inversa entre ellos, la absorbancia es mayor cuando la luz transmitida es baja.
\[ T= \frac{I}{I_{0}} \]
\[ A=log(\frac{1}{T})=log(\frac{I_{0}}{I}) \]
donde T = transmitancia
I = intensidad de luz transmitida
I 0 = intensidad de luz incidente
A = absorbancia (sin unidad)
La ley Beer-Lambert (Ecuación 2.2.9) describe la relación lineal entre absorbancia y concentración de una especie absorbente. A una longitud de onda dada λ, la absorbancia A de una solución es directamente proporcional a su concentración (C) y a la longitud de la trayectoria óptica (b), es decir, la distancia sobre la que pasa la luz a través de la solución (Figura 2.2.4, Ecuación 2.2.9). Cuando la concentración se expresa en moles por litro (mol L −1), la longitud de la trayectoria óptica en centímetros (cm), la absortividad molar o el coeficiente de extinción molar ε se expresa en L mol −1 cm −1.
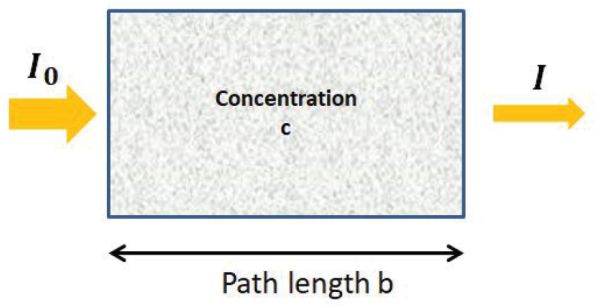
La absortividad molar es una medida de la probabilidad de la transición electrónica y depende de la longitud de onda pero también del soluto responsable de la absorción, la temperatura y, en menor medida, la presión.
\[ A=\epsilon bC \]
donde A = absorbancia (sin unidad)
ε = absortividad molar o coeficiente de extinción molar = constante de proporcionalidad Beer-Lambert (L mol −1 cm −1)
b = longitud de trayectoria de la muestra (cm)
C = concentración (mol L −1)
Limitaciones de la Ley Beer-Lambert
Bajo ciertas circunstancias, la relación lineal entre la absorbancia, la concentración y la longitud de la trayectoria de la luz puede descomponerse debido a factores químicos e instrumentales. Entre las causas de no linealidad se incluyen las siguientes:
- • Desviación del coeficiente de absortividad: La ley Beer-Lambert es capaz de describir el comportamiento de una solución que contiene una baja concentración de un analito. Cuando la concentración de analito es demasiado alta (típicamente >10 mM), las interacciones electrostáticas entre moléculas cercanas entre sí dan como resultado desviaciones en los coeficientes de absortividad.
- • Las altas concentraciones de analito también pueden alterar el índice de refracción de la solución, lo que a su vez podría afectar la absorbancia obtenida.
- • Dispersión: Las partículas en la muestra pueden inducir la dispersión de la luz.
- • Fluorescencia o fosforescencia de la muestra.
- • Radiación no monocromática debido a la instrumentación utilizada.
La no linealidad se puede detectar como desviaciones de la linealidad cuando se representa gráficamente la absorbancia en función de la concentración (ver ejemplo 1). Esto generalmente se supera reduciendo la concentración de analito a través de la dilución de la muestra.
Mediciones espectroscópicas
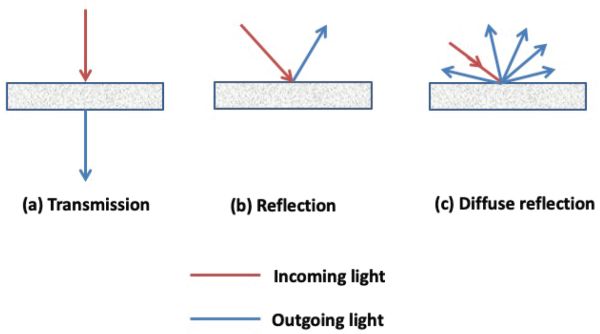
Los espectrómetros son instrumentos ópticos que detectan y miden la intensidad de la luz a diferentes longitudes de onda. Hay diferentes modos de medición disponibles, incluyendo transmisión, reflexión y reflexión difusa (Figura 2.2.5). En modo de transmisión, el espectrómetro captura la luz transmitida a través de una muestra, mientras que en modo de reflectancia, el espectrómetro captura la luz reflejada por la muestra. En algunas situaciones, por ejemplo, para muestras difusoras de luz como polvos, la luz reflejada no proviene únicamente de la superficie frontal del objeto; la radiación que penetra en el material puede reaparecer después de la dispersión de la reflexión dentro de la muestra. Estas radiaciones se denominan reflexión difusa.
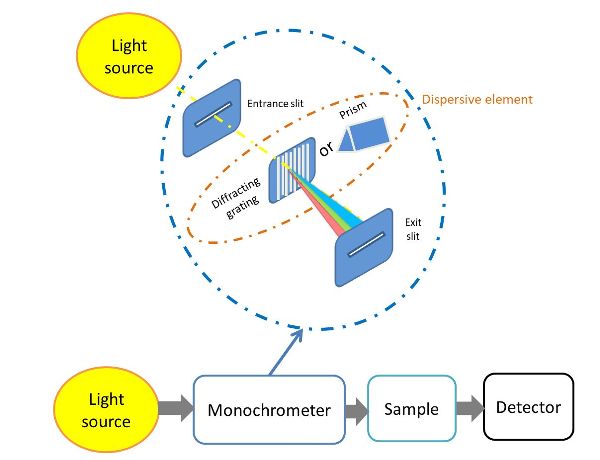
Los espectrómetros comparten varios componentes básicos comunes, incluyendo una fuente de energía luminosa, un medio para aislar un rango estrecho de longitudes de onda (típicamente un elemento dispersivo) y un detector. El elemento dispersivo debe permitir separar la luz de diferentes longitudes de onda (Figura 2.2.6).
La fuente de luz es posiblemente el componente más importante de cualquier espectrofotómetro. La fuente ideal es una fuente continua que contiene radiación de intensidad uniforme en un amplio rango de longitudes de onda. Otras propiedades deseables son la estabilidad a lo largo del tiempo, la larga vida útil y el bajo costo. Las lámparas halógenas de cuarzo-tungsteno se usan comúnmente como fuentes de luz para las regiones visibles (Vis) y NIR, y se pueden usar lámparas de deuterio o diodos emisores de luz de alta potencia para la región ultravioleta.
La luz producida por la fuente de luz es entonces enfocada y dirigida al monocromador por una hendidura de entrada. Luego se utiliza un elemento de difracción de rejilla para dividir la luz blanca de la lámpara en sus componentes. La distancia entre las líneas en las rejillas (“paso de rejilla”) es del mismo orden de magnitud que la longitud de onda de la luz a analizar. Las longitudes de onda separadas luego se propagan hacia el compartimento de muestra a través de la ranura de salida.
Dependiendo de la tecnología utilizada para el detector, la muestra se puede colocar antes o después del monocromador. Por simplicidad, este capítulo describe un posicionamiento de la muestra después del monocromador; toda la operación descrita anteriormente es válida independientemente del posicionamiento de la muestra.
En algunos espectrómetros, se usa un interferómetro (por ejemplo, Fabry-Pérot o interferómetro de transformada de Fourier para el rango espectral UV e IR, respectivamente) en lugar de una rejilla de difracción para obtener mediciones espectrales. En este caso, el haz de luz inicial se divide en dos haces con diferentes trayectorias ópticas mediante el uso de disposiciones de espejo. Estos dos haces se recombinan luego antes de llegar al detector. Si las longitudes de trayectoria óptica de los dos haces no difieren demasiado, se produce un patrón de interferencia. Luego se aplica una operación matemática (transformada de Fourier) al patrón de interferencia obtenido (interferograma) para producir un espectro.
Una vez que los haces de luz hayan pasado por las muestras, continuarán hacia el detector o fotodetector. Un fotodetector absorbe la energía óptica y la convierte en energía eléctrica. Un fotodetector es un detector multicanal y puede ser una matriz de fotodiodos, un dispositivo de carga acoplada (CCD) o un sensor semiconductor de óxido metálico complementario (CMOS). Si bien los fotodetectores se pueden caracterizar de muchas maneras diferentes, el diferenciador más importante es el material detector. Los dos materiales semiconductores más comunes utilizados en los espectrómetros Vis-NIR son el silicio (Si) y el arseniuro de indio galio (InGaAs).
Imágenes espectrales
La imagen espectral es una técnica que integra imágenes convencionales y espectroscopía para obtener información espacial y espectral de un objeto. La imagen multiespectral generalmente se refiere a imágenes espectrales en las que <10 spectral bands are collected, while hyperspectral imaging is the term used when > se recogen 100 bandas espectrales contiguas El término imagen espectral es más general. Las imágenes espectrales se pueden representar como bloques tridimensionales de datos, que comprenden dos dimensiones espaciales y una longitud de onda.
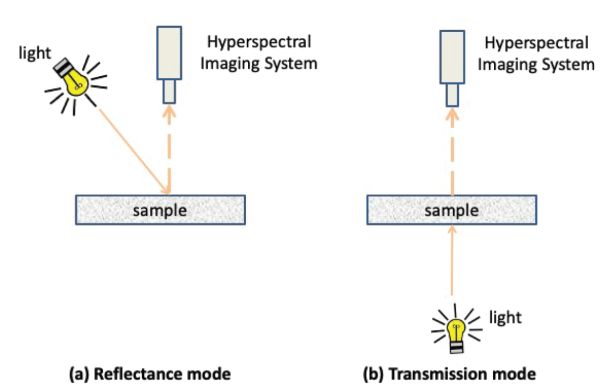
Se utilizan comúnmente dos modos de detección para adquirir imágenes hiperespectrales, es decir, los modos de reflectancia y transmisión (Figura 2.2.7). El uso de estos modos depende de los objetos a caracterizar (por ejemplo, transparentes u opacos) y de las propiedades a determinar (por ejemplo, tamaño, forma, composición química, presencia de defectos). En el modo de reflectancia, el sensor hiperespectral y la luz se ubican en el mismo lado del objeto y el sistema de imágenes adquiere la luz reflejada por el objeto. En este modo, el sistema de iluminación debe diseñarse para evitar cualquier reflexión especular. La reflexión especular ocurre cuando una fuente de luz puede verse como una reflexión directa sobre la superficie de un objeto. Se caracteriza por un ángulo de reflexión que es igual al ángulo de incidencia de la fuente de luz entrante en la muestra. La reflexión especular aparece como puntos saturados brillantes en las imágenes adquiridas impactando su calidad. En el modo de transmitancia, el detector se ubica en el lado opuesto de la fuente de luz y captura la luz transmitida a través de la muestra.
Aplicaciones
Monitoreo de Vegetación en Agricultura
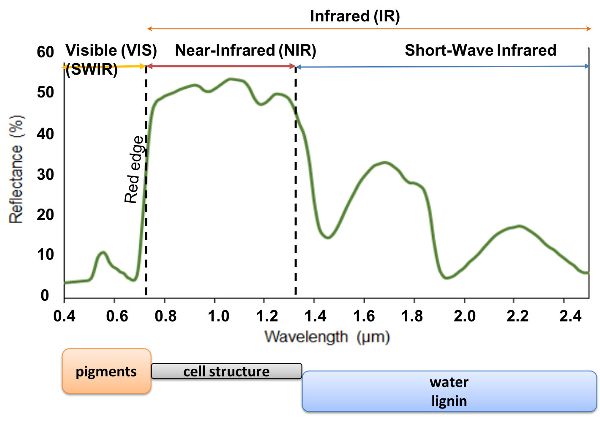
La propagación de la luz a través de las hojas de las plantas se rige principalmente por interacciones de absorción y dispersión y se relaciona con la composición química y estructural de las hojas. Las características espectrales de la radiación reflejada, transmitida o absorbida por las hojas pueden proporcionar una comprensión más profunda de las respuestas fisiológicas a las condiciones de crecimiento y las adaptaciones de las plantas al ambiente. En efecto, los componentes bioquímicos y la estructura física de la vegetación están relacionados con su estado de crecimiento y salud. Por ejemplo, los pigmentos foliares que incluyen clorofila a y b, carotenoides y antocianinas son absorbentes fuertes en la región Vis y abundan en vegetación sana, lo que provoca que los espectros de reflectancia de las plantas sean bajos en el Vis en relación con el rango de longitud de onda NIR (Asner, 1998; Ollinger, 2011) (Figura 2.2.8). Los pigmentos de clorofila absorben la luz azul violeta y roja para la fotosíntesis, proceso por el cual las plantas utilizan la luz solar para sintetizar materia orgánica. La luz verde no es absorbida por la fotosíntesis y los espectros de reflectancia de la vegetación verde en el rango visible son máximos alrededor de 550 nm. Es por ello que las hojas sanas parecen ser verdes. El borde rojo se refiere al área del aumento repentino en la reflectancia de la vegetación verde entre 670 y 780 nm. La reflectancia en la meseta NIR (800—1100 nm) es una región donde las absorciones bioquímicas son limitadas y se ve afectada por la dispersión de la luz dentro de la hoja, cuya extensión está relacionada con la estructura interna de la hoja. La reflectancia en el IR de onda corta (1100—2500 nm) se caracteriza por una fuerte absorción de agua y pequeñas absorciones de otros contenidos bioquímicos foliares como lignina, celulosa, almidón, proteína y celulosa.
Las condiciones de estrés en las plantas, como sequía y patógenos, inducirán cambios en la reflectancia en el dominio espectral Vis y NIR debido a la degradación de la estructura foliar y al cambio de la composición química de ciertos tejidos. En consecuencia, al medir la reflectancia de los cultivos en las regiones Vis y NIR del espectro, los sensores espectrométricos son capaces de monitorear y estimar el rendimiento de los cultivos y los requerimientos de agua de los cultivos y detectar tensiones bióticas o abióticas en la vegetación. Los índices de vegetación (VI), que son combinaciones de imágenes de reflectancia a dos o más longitudes de onda diseñadas para resaltar una propiedad particular de la vegetación, se pueden calcular sobre estas imágenes para monitorear los cambios o propiedades de la vegetación a diferentes escalas espaciales.
El índice normalizado de vegetación diferencial (NDVI) (Rouse et al., 1974) es la relación de la diferencia entre NIR y reflectancia roja, dividida por la suma de los dos:
\[ NDVI = \frac{R_{NIR}-R_{R}}{R_{NIR}+R_{R}} \]
donde R NIR = reflectancia en la región espectral NIR (una longitud de onda seleccionada sobre el rango espectral de 750—870 nm) y R R = reflectancia en la región espectral roja (una longitud de onda seleccionada sobre el rango espectral de 580—650 nm). Dividir por la suma de las dos bandas reduce las variaciones de luz sobre el campo de visión de la imagen. Así, NDVI mantiene un valor relativamente constante independientemente de la iluminación general, a diferencia de la simple diferencia que es muy sensible a los cambios en la iluminación. Los valores de NDVI pueden oscilar entre −1 y +1, con valores negativos correspondientes a superficies distintas a la cubierta vegetal, como nieve o agua, para las cuales la reflectancia roja es mayor que la del NIR. Suelos desnudos, que tienen reflectancia roja y NIR aproximadamente del mismo orden de magnitud, los valores de NDVI son cercanos a 0. Los toldos de vegetación tienen valores positivos de NDVI, generalmente en el rango de 0.1 a 0.7, correspondiendo los valores más altos a la cobertura de vegetación más densa.
El NDVI puede correlacionarse con muchas propiedades de las plantas. Se ha utilizado, y sigue siendo, para caracterizar el estado de salud de las plantas, identificar cambios fenológicos, estimar biomasa verde y rendimientos, y en muchas otras aplicaciones. Sin embargo, el NDVI también tiene algunas debilidades. Las condiciones atmosféricas y las capas de nubes delgadas pueden influir en el cálculo de NDVI a partir de datos satelitales. Cuando la cobertura vegetal es baja, todo bajo el dosel influye en la señal de reflectancia que se registrará. Esto puede ser suelo desnudo, hojarasca u otra vegetación. Cada uno de estos tipos de cobertura del suelo tendrá su propia firma espectral, diferente a la de la vegetación en estudio. Se han propuesto otros índices para corregir defectos de NDVI o para estimar otros parámetros de vegetación, como el índice normalizado de diferencia de agua o NDWI (Gao, 1996), que utiliza dos longitudes de onda localizadas respectivamente en las regiones NIR y SWIR (750—2500 nm) para rastrear cambios en el contenido de humedad de la planta y el agua estrés (Ec. 2.2.11). Ambas longitudes de onda se encuentran en una meseta de alta reflectancia (Fig. 2.2.8) donde se espera que las propiedades de dispersión de la vegetación sean aproximadamente las mismas. La reflectancia SWIR se ve afectada por el contenido de agua de la vegetación. La combinación de la longitud de onda NIR y SWIR no es sensible a la estructura interna de la hoja pero se ve afectada por el contenido de agua de la vegetación. El índice de agua de diferencia normalizada es:
\[ NDWI=\frac{R_{NIR}-R_{SWIR}}{R_{NIR}+R_{SWIR}} \]
donde R NIR es la reflectancia en la región espectral NIR (una longitud de onda seleccionada sobre el rango espectral de 750-870 nm) y R SWIR es la reflectancia en la región espectral SWIR alrededor de 1240 nm (banda de absorción de agua). Gao (1996) propuso usar R NIR igual a reflectancia a 860 nm y R SWIR a 1240 nm.
La espectroscopia de absorción es ampliamente utilizada para monitorear y caracterizar la vegetación a diferentes escalas espaciales, espectrales y temporales. Los sensores están disponibles principalmente para la adquisición de datos multiespectrales de banda ancha o hiperespectrales de banda estrecha. Las plataformas son espaciales para sensores basados en satélites, aerotransportadas para sensores en aviones tripulados y no tripulados y terrestres para sensores de campo y laboratorio.
Los satélites se han utilizado para imágenes de teledetección en la agricultura desde principios de la década de 1970 (Bauer y Cipra, 1973; Doraiswamy et al., 2003) cuando se lanzó Landsat 1 (originalmente conocido como Earth Resources Technology Satellite 1). Equipado con un escáner multiespectral con cuatro canales de longitud de onda (uno verde, uno rojo y dos bandas IR), este satélite pudo adquirir imágenes multiespectrales con resolución espacial de 80 m y tiempo de revisita de 18 días (Mulla 2013). Hoy en día, numerosos sensores satelitales multiespectrales están disponibles y proporcionan observaciones útiles para evaluar las propiedades de la vegetación mucho mejor que Landsat 1. Landsat 8, por ejemplo, lanzado en 2013, ofrece nueve bandas espectrales en el rango espectral Vis a IR de onda corta (es decir, 400—2500 nm) con una resolución espacial de 15—30 m y un tiempo de revisión de 16 días. Los sensores Sentinel-2A y Sentinel-2B lanzados en 2015 y 2017, respectivamente, tienen 13 bandas espectrales (400—2500 nm) y ofrecen una cobertura global multiespectral de 10—30 m y un tiempo de revisión de menos de 10 días. Sin embargo, los sensores hiperespectrales siguen estando poco disponibles en los satélites debido a su costo y su vida útil relativamente corta. Entre ellos, Hyperion (plataforma EO-1) tiene 220 bandas espectrales en el rango espectral de 400—2500 nm, una resolución espacial de 30 m y una resolución espectral de 10 nm. La siguiente generación, como PRISMA (Precursore iPerpettrale della Missione Applicativa) con una resolución espacial de 30 m y un rango de longitud de onda de 400—2505 nm y el EnMAP (Environmental Mapping and Analysis Program) con una resolución espacial de 30 m y un rango de longitud de onda de 400—2500 nm (Transon et al., 2018), indican el futuro de esta tecnología.
Algunas empresas ahora utilizan imágenes satelitales para brindar un servicio que ayude a los agricultores a administrar las parcelas agrícolas. Farmstar (www.myfarmstar.com/web/es) y Oenoview (https://www.icv.fr/en/viticulture-oenology-consulting/oenoview), por ejemplo, apoyan el manejo de insumos y ganadería en cultivos de cereales y vides, respectivamente. Sin embargo, los sensores basados en satélites a menudo tienen una resolución espacial inadecuada para aplicaciones agrícolas de precisión. Algunas decisiones de manejo de fincas, como la detección y manejo de malezas, requieren imágenes con una resolución espacial del orden de un centímetro y, para situaciones emergentes (como monitorear el estrés nutrimental y la enfermedad), una resolución temporal de menos de 24 horas (Zhang y Kovacs, 2012).
Los sensores aerotransportados hoy en día son capaces de producir datos desde sensores multiespectrales hasta sensores hiperespectrales con longitudes de onda que van desde Vis a MIR, con resoluciones espaciales que van desde submetro hasta kilómetros y con frecuencias temporales que van desde 30 min hasta semanas o meses. Los avances significativos en la tecnología de vehículos aéreos no tripulados (UAV), así como en sensores hiperespectrales y multiespectrales (en términos de peso y modos de adquisición de imágenes) permiten que la combinación de estas herramientas se use rutinariamente para aplicaciones agrícolas de precisión. La flexibilidad de estos sensores, su disponibilidad y las altas resoluciones espaciales alcanzables (cm) los convierten en una alternativa a los sensores satelitales. Los sensores multiespectrales incrustados en plataformas UAV se han utilizado en diversos estudios agrícolas, por ejemplo, para detectar enfermedades en árboles cítricos (Garcia-Ruiz et al., 2013), rendimiento de grano en arroz (Zhou et al., 2017) y para mapear el vigor del viñedo (Primicerio et al., 2012). Los sistemas UAV con capacidad de imagen multiespectral son utilizados rutinariamente por las empresas para estimar las necesidades de nitrógeno de las plantas. Esta información, entregada casi en tiempo real a los agricultores, les ayuda a tomar decisiones sobre la gestión. La información extraída de imágenes aerotransportadas también se utiliza para la agricultura de precisión para mejorar la planificación de las intervenciones agrícolas o el manejo de la producción agrícola a escala de campos agrícolas.
También se han desarrollado sensores espectroscópicos terrestres para fines agrícolas. Recogen datos de reflectancia a distancias cortas y pueden montarse en tractores o sujetarse con la mano. Por ejemplo, el clip de hoja de herramienta manual Dualex Force A (https://www.force-a.com/fr/produits/dualex) está adaptado para determinar la absorbancia óptica de la epidermis de una hoja en el rango óptico ultravioleta (UV) a través de la medición diferencial de la fluorescencia de la clorofila así como la contenido de clorofila de la hoja usando diferentes longitudes de onda en los rangos rojo y NIR. Mediante la calibración interna del modelo, esta herramienta calcula el contenido de clorofila foliar, la absorbancia UV epidérmica y un índice de balance de nitrógeno (NBI). Esta información podría ser utilizada para obtener valiosos indicadores de fertilización nitrogenada, senescencia de plantas o susceptibilidad a patógenos. Otros ejemplos son los sensores de nitrógeno desarrollados por Yara (https://www.yara.fr/fertilisation/outils-et-services/n-sensor/) que permiten ajustar la tasa de aplicación de nitrógeno en tiempo real y en cualquier punto del campo, según las necesidades del cultivo.
Aplicaciones relacionadas con alimentos
Los métodos espectroscópicos convencionales, no imagenológicos, son ampliamente utilizados para el análisis rutinario y el control de procesos en la industria agroalimentaria. Por ejemplo, la espectroscopia NIR se usa comúnmente en la predicción del contenido de proteínas, humedad y grasa en una amplia gama de materias primas y productos procesados, como líquidos, geles y polvos (Porep et al., 2015). La espectroscopia Ultraviolet-Vis (UV-Vis) es una herramienta valiosa en el monitoreo de bioprocesos, como el desarrollo de compuestos fenólicos coloreados durante la fermentación de uvas en el proceso de vinificación (Aleixandre-Tudo et al., 2017). La ley Beer-Lambert (Ecuación 2.2.9) puede utilizarse para predecir la concentración de un compuesto dado dada su absorbancia a una longitud de onda específica.
Si bien los métodos espectroscópicos convencionales son útiles para caracterizar productos homogéneos, la falta de resolución espacial conduce a una evaluación incompleta de productos heterogéneos, como muchos alimentos. Esto es particularmente problemático en el caso de contaminación superficial, donde se requiere información sobre la ubicación, extensión y distribución de contaminantes sobre una muestra de alimento. Las aplicaciones de imágenes espectrales Vis-NIR para la calidad e inocuidad de los alimentos están muy extendidas en la literatura científica y están surgiendo en la industria alimentaria comercial. El mayor interés en esta técnica está impulsado principalmente por la naturaleza no destructiva y rápida de la imagen espectral, y el potencial de reemplazar los métodos analíticos actuales que requieren mucho tiempo y mano de obra en el proceso de producción.
Esta sección proporciona una breve descripción de la gama y alcance de tales aplicaciones. Para una descripción más completa de estas y aplicaciones relacionadas, se han publicado varias revisiones informativas que describen avances en imágenes hiperespectrales para la detección de contaminantes (Vejarano et al., 2017), autenticación de alimentos (Roberts et al., 2018) y control de calidad de los alimentos (Gowen et al. 2007; Baiano, 2017).
Detección de Contaminantes
La capacidad de la imagen espectral para detectar variaciones espaciales en un campo de visión, combinada con la sensibilidad química, la convierte en una herramienta prometedora para la detección de contaminantes. Los principales contaminantes que se pueden detectar en la cadena alimentaria mediante Vis-NIR incluyen polímeros, papel, insectos, suelo, huesos, piedras y materia fecal. La reflectancia difusa es, con mucho, el modo de imagen espectral más común utilizado para este propósito, lo que significa que principalmente solo se puede detectar contaminación superficial o periférica. Es motivo de preocupación en la industria alimentaria el crecimiento de microorganismos deteriorados y patógenos tanto en las etapas de procesamiento previo como posterior a la cosecha, ya que estos generan pérdidas económicas y potencialmente resultan en riesgos para la salud humana. Se han demostrado métodos de imagen espectral Vis-NIR para la detección previa a la cosecha de infección viral y crecimiento fúngico en plantas, como maíz (maíz) y trigo. Por ejemplo, se encontró que disminuciones en la absorción de luz en bandas de onda relacionadas con la clorofila estaban relacionadas con la destrucción de cloroplastos en mazorcas de maíz por infección por Fusarium (Bauriegel et al., 2011). La contaminación fecal actúa como un ambiente favorable para el crecimiento microbiano, por lo que muchos estudios se han centrado en la detección de dicha contaminación en una amplia variedad de alimentos, incluyendo productos frescos, carne y superficies de aves de corral. Por ejemplo, se ha demostrado que tanto las modalidades de fluorescencia como de reflectancia son capaces de detectar contaminación fecal en manzanas con altos niveles de precisión (Kim et al., 2007). Estudios recientes han utilizado imágenes de transmitancia de imágenes espectrales para la detección de insectos dentro de frutas y verduras, resultando en altos niveles de detección (> 80% clasificación correcta) (Vejarano et al., 2017).
Autenticación alimentaria
La autenticación de ingredientes alimentarios es necesaria para que la cadena de suministro global en constante expansión garantice el cumplimiento del etiquetado, la legislación y la demanda de los consumidores. Debido a la sensibilidad de la espectroscopia vibracional a la estructura molecular y al desarrollo de técnicas avanzadas de análisis de datos multivariados como la quimiometría, la espectroscopia NIR y MIR se han utilizado con éxito en la autenticación de la pureza y origen geográfico de muchos alimentos, entre ellos la miel, vino, queso y aceite de oliva. La imagen espectral, que tiene la dimensión espacial agregada, se ha utilizado para analizar muestras no homogéneas, donde la variación espacial podría mejorar la información sobre la autenticación o procesamiento previo del producto alimenticio, por ejemplo, en la detección de carne fresca y congelada-descongelada o en adulteración de harinas ( Roberts et al., 2018).
Control de Calidad de los Alimentos
La imagen espectral Vis-NIR se ha aplicado en una amplia gama de temas de control de calidad de los alimentos, como la detección de hematomas en hongos, manzanas y fresas, y en la predicción de la distribución del contenido de agua, proteína o grasa en productos heterogéneos como carne, pescado, queso y pan (Liu et al., 2017). La característica dominante en el espectro NIR de los alimentos con alto contenido de humedad es el pico relacionado con el enlace oxígeno-hidrógeno (OH) centrado alrededor de 1450 nm. La forma e intensidad de este pico es sensible al ambiente local de la matriz alimentaria, y puede proporcionar información sobre los cambios en el agua presente en los productos alimenticios. Esto es útil ya que muchos procesos bioquímicos deteriorantes, como el crecimiento microbiano y el pardeamiento no enzimático, dependen de la disponibilidad de agua libre en los alimentos. También se ha aplicado la imagen espectral Vis-NIR a la evaluación de la calidad de alimentos semisólidos, según lo revisado por Baiano (2017). Por ejemplo, la imagen espectral de transmitancia se ha utilizado para evaluar de manera no destructiva la calidad interior de los huevos (Zhang et al., 2015), mientras que la imagen espectral de reflectancia difusa se ha utilizado para estudiar la microestructura del yogur (Skytte et al., 2015) y productos lácteos (Abildgaard et al., 2015).
Ejemplos
Ejemplo\(\PageIndex{1}\)
Ejemplo 1: Uso de la ley Beer-Lambert para predecir la concentración de una solución desconocida
Problema:
Los datos se obtuvieron de un instrumento de absorción óptica UV-Vis, como se muestra en la Tabla 2.2.2. La absorbancia de luz se midió a 520 nm para diferentes concentraciones de un compuesto que tiene un color rojo. La longitud del camino fue de 1 cm. El objetivo es utilizar la ley Beer-Lambert para calcular el coeficiente de absortividad molar y determinar la concentración de una solución desconocida que tiene una absorbancia de 1.52.
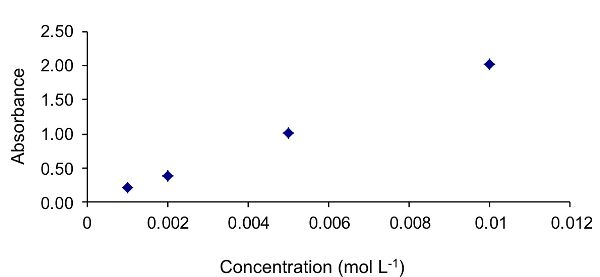
| Concentración (mol L −1) | Absorbancia a 520 nm |
|---|---|
|
0.001 |
0.21 |
|
0.002 |
0.39 |
|
0.005 |
1.01 |
|
0.01 |
2.02 |
Solución
El primer paso requerido para calcular el coeficiente de absortividad molar es graficar una gráfica de absorbancia en función de la concentración, como se muestra en la Figura 2.2.9. Los datos siguen una tendencia lineal, indicando que se cumplen los supuestos de la ley Beer-Lambert.
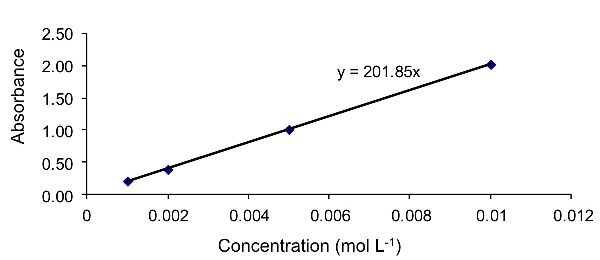
Para calcular el coeficiente de absortividad molar, primero es necesario calcular la línea de mejor ajuste lineal a los datos. Esto se logra aquí usando la función “agregar línea de tendencia” en Excel. La línea resultante de mejor ajuste se muestra en la Figura 2.2.10. La ecuación de esta línea es y = 201.85x.
Compare esta ecuación con la ley Beer-Lambert (Ecuación 2.2.9):
\( A=\epsilon bC \)(Ecuación\(\PageIndex{9}\)
donde A = absorbancia (sin unidad)
ε = absortividad molar o coeficiente de extinción molar = constante de proporcionalidad Beer-Lambert (L mol −1 cm −1)
b = longitud de trayectoria de la muestra (cm)
C = concentración (mol L −1)
En este ejemplo, ε b = 201.85, donde b es la longitud del camino, definida en el problema como 1 cm. En consecuencia, ε = 201.85 (L mol −1 cm −1). Para calcular la concentración de la solución desconocida, sustituir la absorbancia de la solución desconocida (1.52) en la ecuación de mejor ajuste lineal, resultando en una concentración de 0.0075 mol L −1.
Este tipo de cálculo puede ser utilizado para el control de procesos o calidad en la industria alimentaria o para el monitoreo ambiental como la evaluación de la calidad del agua.
Ejemplo\(\PageIndex{2}\)
Ejemplo 2: Cálculo de índices de vegetación a partir de una imagen espectral
Problema:
El Espectrómetro de Imagen Visible/Infrarrojo Aerotransportado (AVIRIS) desarrollado por la Administración Nacional de Aeronáutica y del Espacio (NASA) es uno de los principales instrumentos de imágenes espectrales para la teledetección de la Tierra (NASA, n. d.). Se recolectó una escena agrícola volando sobre el sitio de prueba Indian Pines en el noroeste de Indiana (EE. UU.) y consta de 145 × 145 píxeles y 224 bandas de reflectancia espectral en el rango de longitud de onda 400—2500 nm. La escena de los pinos indios (disponible gratuitamente en https://doi.org/10.4231/R7RX991C; Baumgardner et al., 2015) contiene dos tercios de tierras agrícolas y un tercio de bosque u otra vegetación natural perenne. También hay dos carreteras principales de doble carril y una línea ferroviaria, así como algunas viviendas de baja densidad, otras estructuras y carreteras más pequeñas presentes en la escena. La imagen de verdad del suelo muestra la designación de diversas parcelas y regiones en la escena, y se designa en dieciséis clases, como se muestra en la Figura 2.2.11. El espectro de radiancia promedio de cuatro clases de cobertura terrestre en la escena se traza en la Figura 2.2.12. En el Cuadro 2.2.3 se muestran los datos correspondientes a las parcelas que se muestran en la Figura 2.2.11. Utilizando los valores medios de radiancia, se calculan los NDVI y NDWI para cada clase de cobertura del suelo. Tenga en cuenta: En este ejemplo, los valores medios de radiancia se están utilizando con fines ilustrativos. Esta simplificación se basa en la suposición de que la recepción de radiación es constante a través de todas las bandas de onda, por lo que se supone que la radiancia es linealmente proporcional a la reflectancia (relación entre la energía reflejada y la energía entrante total). Típicamente, los índices de vegetación se calculan a partir de espectros de reflectancia a nivel de pixeles
| Pasto-Pasto | Árboles de pasto | Céspeda-Pasto-Segado | Hay-windrowed | Torres de piedra-acero | |
|---|---|---|---|---|---|
|
NDVI |
0.38 |
0.24 |
0.03 |
0.09 |
−0.25 |
|
NDWI |
0.5 |
0.38 |
0.45 |
0.35 |
0.35 |
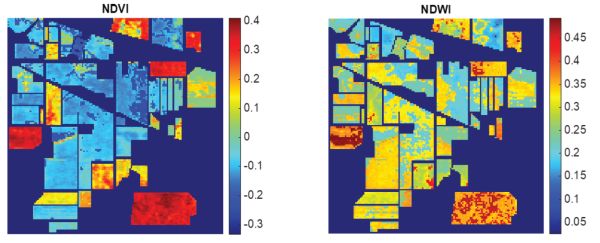
Al aplicar el cálculo a cada espectro de píxeles en la imagen, es posible crear imágenes del NDVI y NDWI, como se muestra en la Figura 2.2.13. El NDVI destaca regiones de vegetación en rojo, regiones de crecimiento de cultivos y suelo en verde-azul claro y regiones de piedra en azul oscuro. El NDWI, sensible a los cambios en el contenido de agua de las marquesinas de vegetación, muestra regiones de alto contenido de agua en rojo, distribuidas irregularmente en las regiones boscosas.
Créditos de imagen
Figura 1. Gorretta, N. (CC Por 4.0). (2020). Esquema de una onda sinusoidal descrita por su longitud de onda.
Figura 2. Gorretta, N. (CC Por 4.0). (2020). Espectro electromagnético.
Figura 3. Gorretta, N. (CC Por 4.0). (2020). Diagrama simplificado de energía que muestra (a) absorción, (b) emisión de un fotón por una molécula, (c) proceso de difusión.
Figura 4. Gorretta, N. (CC Por 4.0). (2020). Absorción de luz por una muestra.
Figura 5. Gorretta, N. (CC Por 4.0). (2020). Diagrama esquemático que muestra la trayectoria de la luz para diferentes modos de medición de la luz, es decir, (a) transmisión, (b) reflexión y (c) reflexión difusa.
Figura 6. Gorretta, N. (CC Por 4.0). (2020). Configuración del espectrómetro: rejilla de difracción de transmisión.
Figura 7. Gorretta, N. (CC Por 4.0). (2020). Modo de detección de imágenes hiperespectrales: (a) modo de reflectancia, (b) modo de transmisión.
Figura 8. Gorretta, N. (CC Por 4.0). (2020). Un espectro de vegetación verde.
Figura 9. Gowen, A. A. (CC Por 4.0). (2020). Gráfica de absorbancia a 520 nm en función de la concentración.
Figura 10. Gowen, A. A. (CC Por 4.0). (2020). Gráfica de absorbancia a 520 nm en función de la concentración mostrando línea y ecuación de mejor ajuste lineal a los datos.
Figura 11. Gowen, A. A. (CC Por 3.0). (2015). Pinos indios tierra la imagen de la verdad que muestra diversas parcelas y regiones en la escena, designadas en dieciséis clases. La cita podría ser: Baumgardner, M. F., L. L. Biehl, y D. A. Landgrebe. 2015. “220 Banda AVIRIS Conjunto de Datos de Imagen Hiperespectral: 12 de Junio de 1992 Pino Indio Sitio de Prueba 3.” Repositorio de Investigación de la Universidad Purdue. doi:10.4231/R7Rx991c. Este artículo tiene licencia CC BY 3.0.
Figura 12. Gowen, A. A. (CC Por 4.0). (2020). El espectro de reflectancia promedio de los pinos indios de cuatro clases de cobertura terrestre en la escena mostrada en la figura 11.
Figura 13. Gowen, A. A. (CC BY 4.0). (2020). Cálculo NDVI y NDVI de imágenes de Indian Pines.
Referencias
Abildgaard, O. H., Kamran, F., Dahl, A. B., Skytte, J. L., Nielsen, F. D., Thomsen, C. L.,. Frisvad, J. R. (2015). Evaluación no invasiva de productos lácteos mediante espectroscopia de reflectancia difusa espacialmente resuelta. Appl. Espectrosc. , 69 (9), 1096—1105. https://doi.org/10.1366/14-07529.
Aleixandre-Tudo, J. L., Buica, A., Nieuwoudt, H., Aleixandre, J. L., & du Toit, W. (2017). Análisis espectrofotométrico de compuestos fenólicos en uvas y vinos. J. Agric. Alimentos Chem. , 65 (20), 4009-4026. https://doi.org/10.1021/acs.jafc.7b01724.
Asner, G. P. (1998). Fuentes biofísicas y bioquímicas de variabilidad en la reflectancia del dosel. Teledetección Environ. , 64 (3), 234-253. https://doi.org/10.1016/S0034-4257(98)00014-5.
Baiano, A. (2017). Aplicaciones de la imagen hiperespectral para la evaluación de la calidad de productos alimenticios líquidos y semilíquidos: Una revisión. J. Food Ing. , 214, 10-15. https://doi.org/10.1016/j.jfoodeng.2017.06.012.
Bauer, M. E., & Cipra, J. E. (1973). Identificación de cultivos agrícolas por procesamiento informático de ERTS MSS Data. Proc. Symp. sobre Resultados Significativos Obtenidos del Satélite Tecnológico de Recursos Terrestres. Recuperado de http://agris.fao.org/agris-search/search.do?recordID=US201302721443.
Baumgardner, M. F., Biehl, L. L., & Landgrebe, D. A. (2015). 220 Banda AVIRIS conjunto de datos de imagen hiperespectral: 12 de junio de 1992 Pino Indio Sitio de Prueba 3. Repositorio de Investigaciones Universitarias Purdue. https://doi.org/10.4231/R7RX991C.
Bauriegel, E., Giebel, A., & Herppich, W. B. (2011). Imágenes hiperespectrales y de fluorescencia de clorofila para analizar el impacto de Fusarium culmorum en la integridad fotosintética de mazorcas de trigo infectadas. Sensores, 11 (4), 3765-3779. https://doi.org/10.3390/s110403765.
Bohr, N. (1913). I. Sobre la constitución de átomos y moléculas. Londres Edimburgo Dublín Revista Filosófica J. Sci. , 26 (151), 1-25. https://doi.org/10.1080/14786441308634955.
Bursey, M. M. (2017). Breve historia de la espectroscopia. Acceder a la ciencia. https://doi.org/10.1036/1097-8542.BR0213171.
De Broguie, L. V. 1925. Sobre la teoría de los cuantos. París, Francia.
Doraiswamy, P. C., Moulin, S., Cook, P. W., & Stern, A. (2003). Evaluación del rendimiento de cultivos a partir de teledetección. Ing. Fotogramétrico Teledetección, 69 (6), 665-674. doi.org/10.14358/pers.69.6.665.
Farmstar. (n. d.). Farmstar: ¡Tienes todo lo que necesitas para gestionar tus cultivos! Recuperado de www.myfarmstar.com/web/es.
Fuerza A. (n. d.). Dualex científico. Recuperado de https://www.force-a.com/fr/produits/dualex.
Gao, B.-c. (1996). NDWI: Un índice normalizado de diferencia de agua para la teledetección de agua líquida de vegetación desde el espacio. Teledetección Environ. , 58 (3), 257-266. https://doi.org/10.1016/S0034-4257(96)00067-3.
García-Ruiz, F., Sankaran, S., Maja, J. M., Lee, W. S., Rasmussen, J., & Ehsani, R. (2013). Comparación de dos plataformas de imagen aérea para la identificación de árboles cítricos infectados por Huanglongbing. Comput. Electrón. Agric. , 91, 106-115. https://doi.org/10.1016/j.compag.2012.12.002.
Gowen, A. A., O'Donnell, C. P., Cullen, P. J., Downey, G., & Frias, J. M. (2007). Imágenes hiperespectrales: una herramienta emergente de análisis de procesos para el control de la calidad y seguridad de los alimentos Tendencias Alimentación Sci. Tecnol. , 18 (12), 590-598. doi.org/10.1016/j.jpgs.2007.06.001.
Huygens, C. (1912). Tratado sobre la luz. Macmillan. Recuperado de http://archive.org/details/treatiseonlight031310mbp.
Kim, M. S., Chen, Y.-R., Cho, B.-K., Chao, K., Yang, C.-C., Lefcourt, A. M., & Chan, D. (2007). Imágenes hiperespectrales de reflectancia y fluorescencia para la inspección en línea de defectos y contaminación fecal de manzanas. Instrumentación de detección Alimentos Qual. Saf. , 1 (3), 151. doi.org/10.1007/s11694-007-9017-x.
Liu, Y., Pu, H., & Dom, D.-W. (2017). Técnica de imagen hiperespectral para evaluar la calidad e inocuidad de los alimentos durante diversos procesos: Una revisión de aplicaciones recientes. Tendencias Alimentación Sci. Tecnol. , 69, 25-35. doi.org/10.1016/j.jpgs.2017.08.013.
Mulla, D. J. (2013). Veinticinco años de teledetección en agricultura de precisión: avances clave y brechas de conocimiento pendientes. Biosyst. Ing. , 114 (4), 358-371. https://doi.org/10.1016/j.biosystemseng.2012.08.009.
NASA (n. d.). Espectrómetro de imagen visible/infrarrojo aerotransportado: visión general de AVIRIS. Laboratorio de Propulsión a Chorro de la NASA, Instituto Tecnológico de California. https://www.jpl.nasa.gov/missions/airborne-visible-infrared-imaging-spectrometer-aviris/.
Ollinger, S. V. (2011). Fuentes de variabilidad en la reflectancia del dosel y las propiedades convergentes de las plantas. Nuevo Phytol. , 189 (2), 375-394. doi.org/10.1111/j.1469-8137.2010.03536.x.
Osborne, B. G., Fearn, T., Hindle, P. H., & Osborne, B. G. (1993). Espectroscopia práctica NIR con aplicaciones en análisis de alimentos y bebidas (Vol. 2). Longman Científico y Técnico.
Pasquini, C. (2003). Espectroscopia de infrarrojo cercano: Fundamentos, aspectos prácticos y aplicaciones analíticas. J. Brazilian Chem. Soc. , 14 (2), 198-219. https://doi.org/10.1590/S0103-50532003000200006.
Pasquini, C. (2018). Espectroscopia de infrarrojo cercano: Una técnica analítica madura con nuevas perspectivas: Una revisión. Anal. Chim. Acta, 1026, 8-36. https://doi.org/10.1016/j.aca.2018.04.004.
Pavía, D. L., Lampman, G. M., Kriz, G. S., & Vyvyan, J. A. (2008). Introducción a la espectroscopia. Aprendizaje Cengage.
Porep, J. U., Kammerer, D. R., & Carle, R. (2015). Aplicación on-line de espectroscopía de infrarrojo cercano (NIR) en la producción de alimentos. Tendencias Alimentación Sci. Tecnol. , 46 (2, Parte A), 211-230. doi.org/10.1016/j.jpgs.2015.10.002.
Primicerio, J., Di Gennaro, S. F., Fiorillo, E., Genesio, L., Lugato, E., Matese, A., & Vaccari, F. P. (2012). Un vehículo aéreo flexible no tripulado para agricultura de precisión. Precisión Agric. , 13 (4), 517-523. doi.org/10.1007/s11119-012-9257-6.
Roberts, J., Power, A., Chapman, J., Chandra, S., & Cozzolino, D. (2018). Una breve actualización sobre las ventajas, aplicaciones y limitaciones de las imágenes hiperespectrales y químicas en la autenticación de alimentos. Appl. Sci. , 8 (4), 505. https://doi.org/10.3390/app8040505.
Rouse Jr., J. W., Haas, R. H., Schell, J. A., & Deering, D. (1974). Monitoreo de sistemas de vegetación en las Grandes Llanuras con ERTS. NASA Special Publ. 351.
Schuster, A. (1911). Enciclopedia Britannica, 2:477.
Skytte, J., Moller, F., Abildgaard, O., Dahl, A., & Larsen, R. (n. d.). Discriminación de la microestructura del yogur mediante imágenes de reflectancia difusa. Proc. Conf. Escandinavo sobre Análisis de Imagen (pp. 192-203). Springer. doi.org/10.1007/978-3-319-19665-7_16.
Dom, D.-W. (2009). Espectroscopia infrarroja para el análisis y control de la calidad de los alimentos. Prensa Académica.
Thomas, N. C. (1991). La historia temprana de la espectroscopia. J. Chem. Educación, 68 (8), 631. https://doi.org/10.1021/ed068p631.
Teledetección, 10 (2). https://doi.org/10.3390/rs10020157.
Vejarano, R., Siche, R., & Tesfaye, W. (2017). Evaluación de contaminantes biológicos en alimentos mediante imágenes hiperespectrales: Una revisión. Int. J. Propiedades Alimentarias, 20 (sup2), 1264-1297. doi.org/10.1080/10942912.2017.1338729.
Zhang, C., & Kovacs, J. M. (2012). La aplicación de pequeños sistemas aéreos no tripulados para la agricultura de precisión: Una revisión. Precisión Agric. , 13 (6), 693-712. doi.org/10.1007/s11119-012-9274-5.
Zhang, W., Pan, L., Tu, S., Zhan, G., & Tu, K. (2015). Evaluación interna no destructiva de la calidad de los huevos mediante síntesis de imágenes hiperespectrales y análisis multivariados. J. Food Ing. , 157, 41-48. https://doi.org/10.1016/j.jfoodeng.2015.02.013.
Zhou, X., Zheng, H. B., Xu, X. Q., He, J. Y., Ge, X. K., Yao, X.,. Tian, Y. C. (2017). Predicción del rendimiento de grano en arroz usando índices de vegetación multitemporal a partir de imágenes multiespectrales y digitales basadas en UAV. ISPRS J. Fotogrametría Teledetección, 130, 246-255. https://doi.org/10.1016/j.isprsjprs.2017.05.003.


