4.5: Medición de las Emisiones Gaseosas de la Vivienda Animal
- Page ID
- 80939
Mélynda Hassouna
UMR Sol, Agro e hidrosistemas y espacialización, InRae, Agrocampus, Francia
Salvador Calvet
Instituto de Ciencia y Tecnología Animal, Universitat Politècnica de València, Valencia, España
Richard S. Gates
Ingeniería Agrícola y Biosystems, y Ciencias Animales, Iowa State University, Ames, Iowa, EE. UU.
Enda Hayes
Centro de Recursos para la Gestión de la Calidad del Aire, Departamento de Geografía y Gestión Ambiental, Universidad del Oeste de Inglaterra, Bristol, Reino Unido
Sabine Schrade
Unidad de Investigación de Rumiantes, Departamento Federal de Asuntos Económicos, Educación e Investigación EAER, Agrocope, Ettenhausen, Suiza
| Términos Clave |
| Procesos de emisión | Balance de masa | Amoníaco |
| Técnicas de medición | Validación | Gases de efecto invernadero |
| Muestreo | Ventilación |
Variables
Introducción
Las instalaciones de alojamiento de animales y almacenamiento de estiércol son dos fuentes principales de emisiones gaseosas a la atmósfera en la granja. Los contaminantes más importantes emitidos son el amoníaco (NH 3), el metano (CH 4) y el óxido nitroso (N 2 O).
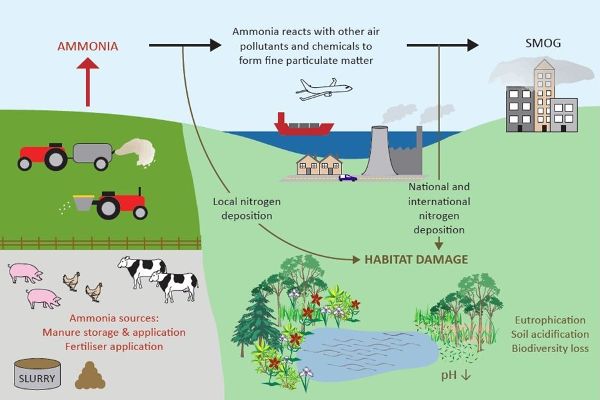
El amoníaco (NH 3) es un gas incoloro con un olor acre que puede tener impactos en la salud ambiental y humana (Figura 4.5.1). El amoníaco es emitido por muchas actividades agrícolas, incluyendo la producción de cultivos, así como la producción animal. El amoníaco juega un papel clave en la formación de partículas secundarias (PM) al reaccionar con especies ácidas como el dióxido de azufre (SO 2) y los óxidos de nitrógeno (NO x) para formar aerosoles finos, y por lo tanto se llama precursor de partículas. El PM creado por la reacción de NH 3 y especies ácidas en la atmósfera contribuye a la mala calidad del aire incluyendo neblina regional. Estas partículas tienen un diámetro aerodinámico de menos de 2.5 micrones y generalmente se denominan “PM-finas”. Se inhalan fácilmente y las poblaciones expuestas a PM-Fine tienen mayores riesgos para la salud respiratoria y cardiovascular como asma, bronquitis, arritmia cardíaca y paro, y muerte prematura. Algunos NH 3 emitidos se depositan posteriormente en tierra y agua a favor del viento de las instalaciones, y pueden acidificar suelos y agua dulce. La adición de nitrógeno disponible (N) a ecosistemas bajos en nutrientes perturba su equilibrio y puede alterar el crecimiento relativo y abundancia de especies de plantas.
El óxido nitroso y el CH 4 son potentes gases de efecto invernadero (GEI) que contribuyen al calentamiento global. El potencial de calentamiento global (GWP) es un factor específico de cada GEI y permite comparar los impactos relativos del calentamiento global entre diferentes GEI. Este factor indica cuánto calor atrapa un gas dado a lo largo de un cierto horizonte de tiempo (generalmente 100 años), en comparación con una masa igual de dióxido de carbono (CO 2). El óxido nitroso GWP para un horizonte temporal de 100 años es de 265 con una vida útil en la atmósfera de 114 años. El GWP de metano para un horizonte temporal de 100 años es 28 con una vida útil en la atmósfera de 12 años.
El óxido nitroso, también conocido como “gas de la risa”, es incoloro e inodoro, y contribuye a la destrucción de la capa de ozono atmosférico. En la agricultura, la principal fuente de emisiones de N 2 O es el suelo, desde el uso de fertilizantes de cultivos, el cultivo del suelo y la propagación de orina y estiércol. Otras fuentes incluyen procesos industriales y procesos naturales que involucran suelos y océanos.
El metano es un compuesto orgánico volátil, inodoro e inflamable. En la agricultura, las principales fuentes son la fermentación entérica (fermentación que tiene lugar en los sistemas digestivos de los animales) y la degradación del estiércol. El metano contribuye a la formación de ozono en la atmósfera inferior y al agotamiento de la capa de ozono en la atmósfera superior.
Investigadores e ingenieros han desarrollado diferentes enfoques para medir y cuantificar de manera confiable las emisiones de NH 3, N 2 O y CH 4 de las instalaciones de producción animal. La implementación de estos métodos ayuda a comprender los procesos de producción, identificar los factores influyentes y desarrollar técnicas o prácticas de mitigación. Las características específicas del alojamiento animal y la variabilidad de las casas y sistemas de producción animal hacen que el desarrollo e implementación de los diferentes métodos sea un verdadero desafío.
Conceptos
Casas de Animales
La vivienda para animales está diseñada para brindar refugio y protección con control del consumo de alimentos, enfermedades, parásitos y el ambiente térmico interior. Una casa para animales está diseñada para tener en cuenta la producción de calor y humedad de los animales, las características del edificio (por ejemplo, aislamiento y volumen) y el clima exterior. Dentro de la casa, los animales producen los siguientes componentes críticos que afectan las emisiones:
- • calor sensible que se transfiere al aire interior por convección, conducción y radiación, y provoca un aumento de la temperatura del aire;
- • calor latente que se genera a través de la evaporación de la humedad de los pulmones, la piel, la orina y la materia fecal, y a través del aumento de la humedad del aire;
- • mezclas de heces y orina, que se convierten en fuente de emisiones gaseosas (NH 3, N 2 O, CO 2, vapor de agua, CH 4), y calor; y
- • CO 2 de la respiración animal.
El control de temperatura, humedad, concentraciones de gas y concentraciones de polvo dentro de la casa es esencial para lograr condiciones óptimas para el crecimiento y producción animal. Las condiciones óptimas varían en función de la edad, la especie y la raza de los animales, y dependen de la implementación de sistemas de ventilación. El sistema de ventilación controla parcialmente la tasa y las emisiones totales del edificio. Existen dos tipos de sistemas de ventilación: mecánicos y naturales. La red europea RAMIRAN (RAMIRAN, 2011) define los dos sistemas como:
- • ventilación mecánica, que es la ventilación de un edificio, generalmente para cerdos, aves de corral o terneros, mediante el uso de ventiladores eléctricos en las paredes o techo que normalmente son controlados por la temperatura en el edificio; y
- • ventilación natural, que es la ventilación de un edificio, por ejemplo, para ganado, por aberturas o huecos diseñados en el techo y/o lados del edificio.
Procesos de Emisiones NH 3, N 2 O y CH 4 en la Vivienda Animal y Factores Influenciantes
El amoníaco se volatiliza como gas durante el manejo del estiércol. Se deriva principalmente de la urea excretada en la orina (o ácido úrico en las heces, en el caso de las aves de corral). El proceso de formación de NH 3 a partir de urea es relativamente rápido y se describe en la Figura 4.5.2. Una vez excretada, la urea se descompone en unas pocas horas a unos días en amonio (NH 4) por medio de la enzima ureasa, la cual está ampliamente presente en heces y suelos. El amonio está en equilibrio con NH 3 disuelto mejorado a valores de pH altos. Existe un segundo equilibrio físico entre NH 3 disuelto y libre en la matriz de estiércol. Por último, el NH 3 gratuito se puede liberar a la atmósfera. Este es un proceso de transferencia de masa afectado por la velocidad del aire, la difusión desde debajo de la superficie y la exposición al aire en la superficie del estiércol.
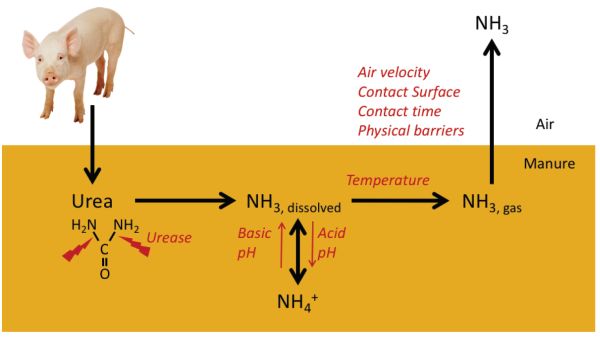
Este es un proceso continuo que inicia en el propio alojamiento animal y continúa durante el manejo del estiércol y la aplicación de la tierra. Varios factores están involucrados en la cantidad de NH 3 emitido a la atmósfera:
- • composición del estiércol; los factores más relevantes son la cantidad de urea excretada por los animales, el pH del estiércol y su contenido de humedad;
- • las condiciones ambientales, particularmente la temperatura y la velocidad del viento por encima de la superficie emisora;
- • las instalaciones para el alojamiento de animales y el manejo del estiércol; y
- • prácticas de manejo, particularmente aquellas que alteran el contacto del estiércol con el aire, y la orina con las heces, al reducir el tiempo de exposición o superficie de contacto.
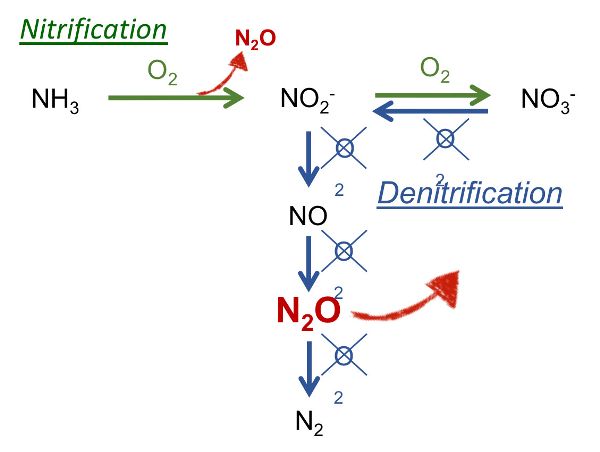
En las fincas, N 2 O se origina a partir del manejo del estiércol y su aplicación a la tierra como fertilizante. La emisión de N 2 O se produce a partir de la nitrificación y desnitrificación sucesivas de NH 4. Se requiere una primera fase aeróbica para la nitrificación, mientras que para la desnitrificación se requieren condiciones anóxicas (Figura 4.5.3). Estas condiciones son características de las siguientes situaciones:
- • compostaje con períodos alternativos de humectación, mezcla y secado;
- • tratamiento aeróbico de lodo;
- • filtros de aire en el escape de aire de la casa de animales basados en el lavado biológico del aire; y
- • aplicación de estiércol al suelo y posteriores eventos de secado-humectación.
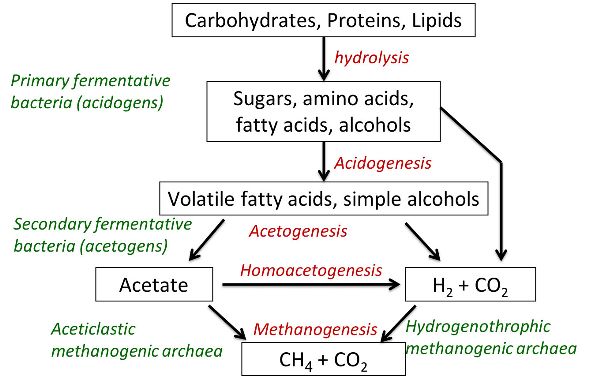
El metano se produce durante la descomposición anaeróbica de la materia orgánica. Esto ocurre principalmente durante la digestión en rumiantes y la descomposición del estiércol. En este proceso, la descomposición microbiana de la materia orgánica ocurre en diferentes etapas, desde moléculas más complejas hasta las más simples. El mecanismo principal se presenta en la Figura 4.5.4. Aparte de la presencia de materia orgánica y condiciones anóxicas, se necesita tiempo (algunas semanas) para completar el proceso, y el proceso puede ser inhibido debido a ciertas condiciones, como la acumulación de NH 3. A diferencia del NH 3, el CH 4 tiene una solubilidad muy baja en agua y, una vez producido, se libera a la atmósfera a través de un burbujeo característico, en el caso de las lechadas.
Para la fermentación entérica en rumiantes, los factores clave son la composición del alimento y la genética. Los alimentos más digeribles reducen la cantidad de CH 4. Los constituyentes de los piensos como lípidos o aceites esenciales pueden reducir la producción de CH 4 a través de la inhibición. La genética también influye en la cantidad de CH 4 producida y puede modificarse a través de la selección genética animal.
La emisión de CH 4 durante el manejo del estiércol se debe a la presencia de materia orgánica sometida a condiciones anaeróbicas por tiempo suficiente (aproximadamente un mes, al menos) para que se desarrollen bacterias metanogénicas. La cantidad y composición de la materia orgánica determina el potencial máximo para la formación de CH 4. Las prácticas de manejo de estiércol que interrumpen las condiciones anaeróbicas, reducen la carga de materia orgánica o presentan captura de biogás son potencialmente efectivas para mitigar las emisiones.
Medición de emisiones de viviendas para animales
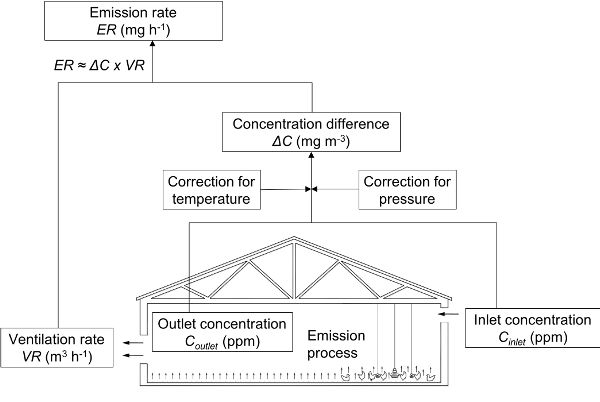
El enfoque más común utilizado para determinar las tasas de emisión de gases de las casas de animales se basa en la cuantificación de las tasas de ventilación y las concentraciones de entrada y salida del gas (Figura 4.5.5). El caudal másico del gas emitido (tasa de emisión o ER) es proporcional a la velocidad de ventilación y la diferencia de concentración entre el aire de escape y el aire exterior. Varias técnicas diferentes están disponibles para medir las concentraciones de gas dentro y fuera de la casa y la tasa de ventilación.
Técnicas de medición de concentración de gas
Las técnicas utilizadas con mayor frecuencia para medir las concentraciones de NH 3, CH 4 y N 2 O de las casas de animales son físicas (óptica, cromatografía de gases, quimioluminiscencia) o químicas (trampas ácidas, tubos colorimétricos activos).
Técnicas ópticas
Las técnicas ópticas se basan en la ley de absorción Beer-Lambert, la cual indica que la cantidad de luz de una longitud de onda dada absorbida está relacionada con el número de moléculas de gas en la trayectoria de la luz que son capaces de absorberla.
Las técnicas ópticas se basan en el uso de una fuente de luz, una cámara para contener la muestra de aire durante la medición y un detector para cuantificar la absorción de gas objetivo. Las principales técnicas utilizadas en las casas de animales son la espectroscopia infrarroja (IR) (fotoacústica o transformada de Fourier), la espectroscopia de absorción láser de diodo sintonizable (TDLAS), la espectroscopia de salida de cavidad integrada fuera del eje (OA-ICOS) y la espectroscopia de anillo descendente de cavidad (CRDS). Las diferencias entre estas técnicas incluyen el principio de detección de absorción y el tipo y longitud de onda de las fuentes de luz (láser de cascada cuántica, láser de diodo sintonizable o fuente IR). Las técnicas que utilizan láseres (una fuente monocromática con una banda estrecha de longitudes de onda) son más selectivas, precisas y estables que las técnicas con una fuente de IR policromática (es decir, banda grande de longitudes de onda) porque la selección de la absorción de una longitud de onda específica de una fuente de IR policromática es difícil de lograr.
Una ventaja principal de las técnicas ópticas es que hacen posible el monitoreo de la dinámica de concentración casi en tiempo real, incluyendo monitorear varios gases con diferentes concentraciones al mismo tiempo (Powers y Capelari, 2016). Las ventajas de los instrumentos ópticos incluyen respuestas lineales en un amplio rango de concentraciones y la capacidad de medir concentraciones tanto dentro (donde podría haber un alto nivel de concentración) como fuera (nivel de concentración baja) de la casa de animales con los mismos instrumentos. La mayoría de los instrumentos ópticos tienen tiempos de respuesta adaptados a la medición en casas de animales. Son portátiles y se pueden utilizar en el sitio. Sin embargo, pueden ser costosos, deben ser calibrados y aún requieren una estimación precisa de la tasa de ventilación.
Cromatografía de gases
Un cromatógrafo de gases separa los componentes de la muestra y mide sus concentraciones. El equipo cuenta con cuatro elementos básicos: un inyector, una columna, un horno que rodea la columna y un detector. La muestra es vaporizada en el inyector y barrida por el gas portador a través de una columna calentada. La columna separa cada compuesto según su polaridad y punto de ebullición. El detector identifica y cuantifica los compuestos separados. Los detectores incluyen un detector de ionización de llama para CH 4 y CO 2 y un detector de captura de electrones para N 2 O. Esta técnica es precisa si el detector ha sido calibrado para el rango de concentraciones medidas. Requiere el uso de un gas portador y calibración regular, lo que dificulta la implementación in situ y la medición continua. A menudo se utiliza para medir muestras previamente recolectadas.
Quimioluminiscencia
La quimioluminiscencia se utiliza para medir la concentración de NH 3. El NH 3 en la muestra se oxida primero a N 2 O por un convertidor catalítico, y luego el N 2 O se oxida adicionalmente a óxido nítrico (NO) a alta temperatura y un estado energético elevado. A medida que las moléculas vuelven a un estado de menor energía, liberan radiación electromagnética a una longitud de onda específica, la cual se mide y cuantifica.
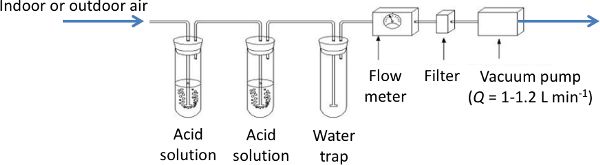
Trampas de ácido
Una trampa de ácido es una técnica de referencia estándar para medir NH 3. Un volumen conocido de aire se bombea a través de una solución ácida y se registra (Figura 4.5.6). La solución ácida se analiza posteriormente en el laboratorio con un método colorimétrico o fotométrico (Hassouna et al., 2016) para estimar la cantidad de NH 3 atrapado en la solución, como:
\[ NH_{3,trapped} = [N-NH_{4}^{+}]_{acid\ solution} \times m_{acid\ solution} \]
donde NH 3, atrapado = cantidad de NH 3 atrapado en la solución (kg)
[N-NH 4 +] solución ácida = concentración de amonio en la solución ácida (kg kg −1)
m solución ácida = masa de la solución (kg)
A partir de esto, la concentración de NH 3 en la muestra de aire (\(C_{N-NH_{3}, air}\)en kg m −3) se puede calcular como:
\[ C_{N-NH_{3, air}} = \frac{NH_{3, trapped}}{V_{sample}} \]
donde V muestra (m 3) es el volumen de aire que pasó a través de la solución.
Se utilizan soluciones de ácido fuerte, como ácido bórico, ácido ortofosfórico, ácido nítrico y ácido sulfúrico. La trampa se puede usar por unas horas o unos días dependiendo de las concentraciones de NH 3 en el aire entrante, la concentración de ácido y el volumen de solución ácida en los viales. El tiempo de muestreo y la concentración deben determinarse antes del experimento en función de las concentraciones esperadas de NH 3. Dos viales con solución ácida se utilizan secuencialmente para evitar saturar una sola solución. Esta técnica proporciona una concentración media de NH 3 durante el periodo de muestreo y, por lo tanto, no es adecuada para estudios que requieran monitorear dinámicas de concentraciones de NH 3 en una casa. Sin embargo, como no es caro ni consume demasiado tiempo, se puede utilizar para verificar la consistencia de las mediciones realizadas, por ejemplo, con técnicas ópticas.
Tubos Colorimétricos Activos
Los tubos colorimétricos activos son una técnica manual que se puede utilizar para estimar concentraciones de NH 3, NO, compuestos orgánicos volátiles (COV) y CO 2. Los tubos se fabrican para reaccionar a un rango específico de concentraciones de un gas objetivo específico. Antes de la medición, ambos extremos de un tubo de ensayo sellado se abren por corte. El tubo está conectado firmemente a una bomba manual, que aspira aire a través del tubo. Si está presente en el aire, el gas objetivo reacciona con reactivos en el tubo. La fuerza de la reacción es proporcional a la concentración del gas en el aire. Se utiliza una escala graduada para leer el grado de cambio de color en el tubo, lo que indica la concentración del gas objetivo. Muchas de las reacciones utilizadas se basan en indicadores de pH, como el azul de bromofenol para medir las concentraciones de NH 3. La concentración de gas se expresa en ppm o mL m −3. Esta técnica es confiable y simple de usar. Se puede utilizar para estimar concentraciones, pero no para medirlas de manera continua o precisa.
Tasa de Ventilación
En casas ventiladas mecánicamente con modernos sistemas de control de ventilación, la tasa de ventilación podría ser uno de los muchos datos registrados continuamente. En tales situaciones, los datos están así fácilmente disponibles para los cálculos de emisiones. Para otras casas, o si el paso de tiempo de grabación no es adecuado o los datos registrados no son confiables, se debe medir o evaluar la tasa de ventilación. Diferentes métodos para estimar la tasa de ventilación han sido evaluados y descritos en la literatura (Ogink et al., 2013; Wang et al., 2016). El método elegido depende del tipo de ventilación (natural o mecánica), la accesibilidad del escape para realizar mediciones físicas, el nivel de velocidad de ventilación y el grado de precisión deseado. Algunas técnicas son indirectas (gas trazador, balance de calor), mientras que otras son directas (anemómetro de rueda de ventilador, instrumentos especializados).
Técnicas de Gas Trazador Usando Gases Trazadores Artificiales
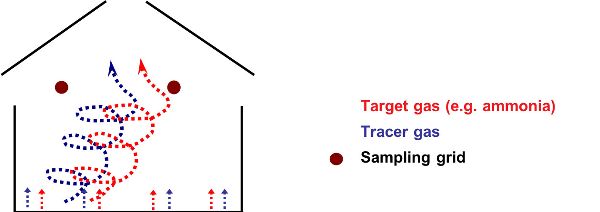
Las técnicas de gas trazador se utilizan comúnmente para cuantificar la tasa de ventilación en muchos tipos de casas, pero principalmente aquellas con ventilación natural. Un gas trazador externo debe ser seguro, inerte, medible, no producido en la casa y económico (Phillips et al., 2001; Sherman, 1990). El gas trazador más común utilizado en las casas de animales es el hexafluoruro de azufre (SF 6) (Mohn et al., 2018). Un requisito crítico es el de una mezcla de aire casi perfecta dentro de la casa de animales para garantizar que el gas trazador y el gas objetivo (para cálculos de emisiones) que se miden se dispersen de manera similar. El aire se puede mezclar artificialmente usando un conducto de ventilación especialmente diseñado (Figura 4.5.7). Los gases trazadores se pueden dosificar automáticamente mediante un controlador de flujo másico y orificios críticos (Figura 4.5.8).

El principio básico para las técnicas de gas trazador es la conservación de la masa (tanto del gas objetivo como del gas trazador). Al monitorear el flujo másico dosificado y la concentración en los puntos de muestreo del gas trazador, se puede determinar la velocidad de ventilación (Figura 4.5.9). Se elige una técnica de liberación de gas trazador en función de la velocidad de ventilación, el límite de detección del dispositivo utilizado para monitorear la concentración de gas trazador y la capacidad de controlar y monitorear el flujo másico dosificado con precisión. Según Ogink et al. (2013), se pueden distinguir tres técnicas de liberación de gas trazador:
- • método de inyección constante: el gas trazador se inyecta a una velocidad constante, y su concentración se mide directamente a lo largo de un período de tiempo y se utiliza para estimar la velocidad de ventilación;
- • método de decaimiento: se inyecta gas trazador hasta que su concentración se estabilice, luego se detiene la inyección y se utiliza la disminución en la concentración para calcular la velocidad de ventilación; y

(a)

b)
Figura\(\PageIndex{8}\): (a) Dosificación de gas trazador mediante tubos de acero con orificios críticos protegidos por elementos de acero junto a los pisos en una carcasa láctea; (b) botellas de gas con controlador de flujo másico.
- • método de concentración: el gas trazador se distribuye en el aire de una casa a cierta concentración para que sea constante.
Solo el método de inyección constante y el método de decaimiento son comunes para las mediciones en casas de animales.
Para calcular la emisión o flujo másico del gas objetivo (por ejemplo, NH 3, CH 4), primero se debe calcular una corrección de fondo de la concentración (C x) para los gases objetivo y los gases trazadores:
\[ C_{x} = C_{x, id} - C_{x, bgd} \]
donde x = T (gas trazador) o G (gas objetivo)
C x, id = concentración de gas en interiores (μg m −3)
C x, bgd = concentración de gas de fondo (μg m −3)
La relación de las concentraciones de fondo de gas emitido (objetivo), C G, y gas trazador, C T, corresponde entonces a la relación de sus caudales másicos (\(\dot{m}\), g d −1):
\[ \frac{\dot{m}_{G}}{\dot{m}_{T}} = \frac{C_{G}}{C_{T}} \]
y por lo tanto
\[ \dot{m}_{G} = \frac{\dot{m}_{T}C_{G}}{C_{T}} \]
Métodos de balance de masa de dióxido de carbono (CO 2) o gas trazador usando un trazador interno
El método de balance de masas de CO 2 a veces se considera una técnica de gas trazador en la que se utiliza CO 2 como trazador interno, es decir, no dosificado sino producido por la respiración animal y estiércol. Se puede utilizar en casas ventiladas natural o mecánicamente. Se basa en la hipótesis de que la tasa de ventilación determina la relación entre la producción de CO 2 en la casa y la diferencia en las concentraciones de CO 2 entre el interior y el exterior de la casa. Este método ha sido ampliamente descrito (Blanes y Pedersen, 2005; Estellés et al., 2011; Samer et al., 2012) y es más preciso en edificios sin basura y sin sistema de calefacción de gas.
La tasa de ventilación para la casa se puede calcular como:
\[ VR = \frac{\text{total heat per house}\times \text{ventilation flow per hpu}}{1000} \]
donde el calor total producido para toda la casa se expresa en unidades de producción de calor (hpu; 1 hpu es 1 kW de la producción total de calor metabólico animal a 20°C) y el flujo de ventilación por hpu es en m 3 h −1 hpu −1.
La Comisión Internacional de Ingeniería Agropecuaria proporciona un método para calcular la producción total de calor (sensible más latente) para diferentes categorías de animales (Pedersen y Sällvik, 2002). Por ejemplo, para cerdos de engorde, el calor total producido para toda la casa se calcula multiplicando el calor total por animal (en W animal −1) por el número de animales y convirtiendo a unidades de producción de calor como:
\[ \text{total heat per house} = \text{total heat per animal} \times \text{number of animals} \]
\[ \text{total heat per animal} = (5.09\times m^{0.75} +[1-(0.47+0.003 \times m)] \times [(n \times 5.09 \times m^{0.75}) - (5.09\times m^{0.75})] \]
donde m = masa animal (kg)
n = energía de alimentación en relación con la disipación de calor debida al mantenimiento (g d −1)
El flujo de ventilación por hpu varía en función de la actividad animal en diferentes momentos del día y la diferencia entre las concentraciones de CO 2 en interiores y exteriores:
\[ \text{Ventilation flow per hpu} = \frac{c \times (\text{relative animal activity})}{(CO_{2,indoors}-CO_{2,outdoors})\times 10^{-6}} \]
donde c = producción de CO 2 (m 3 h −1 hpu −1); varía en función del tipo animal (Pedersen y Sällvik, 2002; Pedersen et al., 2008).
\( CO_{2, indoors} \text{ and } CO_{2, outdoors} = \text{measured indoor and outdoor } CO_{2} \text{ concentrations at time h (mL m}^{-3}) \)
La actividad animal relativa se calcula como:
\[ \text{Relative animal activity} = 1-a\ sin[(\frac{2\pi}{24} \times (h+6-h_{min})] \]
donde a = amplitud de expresión constante con respecto al valor constante 1, que es un factor de escala basado en la observación empírica y que varía según el tipo de animal (Pedersen et al., 2008)
h = tiempo en el muestreo (esto debe ser un número decimal 0 ≤ h ≤ 24), por ejemplo, (2:10 = 2.2)
h min = factor de actividad que se relaciona con la hora del día con actividad mínima (horas después de medianoche) (Pedersen y Sällvik, 2002)
Uso de Sensores
Los anemómetros de rueda de ventilador o cable caliente se pueden usar para cuantificar la tasa de ventilación en casas ventiladas mecánicamente que extraen el aire de salida a través de conductos o ventiladores de escape. Un requisito importante es tener acceso al flujo de escape donde se van a realizar las mediciones, lo cual no es posible en muchas casas de animales.
El anemómetro mide la velocidad del aire, y la tasa de ventilación (VR) se calcula de la siguiente manera:
\[ VR=sA \]
donde s = velocidad media del aire (m h −1)
A = área transversal del conducto de ventilación o corriente de aire (m 2)
Se deben utilizar métodos adecuados para obtener la velocidad media del aire representativa sobre el área de flujo, por ejemplo, seleccionando un número suficiente de puntos de medición y aplicando reglas log-lineales o log-TchebyCheff (ISO 3966, 2008) para el espaciado de puntos de medición.
No se recomienda el uso de anemómetros en casas con ventilación natural debido a su rápido cambio en los flujos de aire y el gran tamaño del área abierta, lo que requeriría muchos sensores para obtener una estimación representativa de la tasa de ventilación.
En casas ventiladas mecánicamente, se puede utilizar el monitoreo continuo del diferencial de presión estática y el estado de funcionamiento (encendido-apagado) de cada ventilador para estimar la velocidad de ventilación del ventilador en función de sus características de rendimiento teóricas o medidas. Idealmente, el rendimiento in situ de cada ventilador se determina primero, y la tasa de ventilación de la casa se puede estimar sumando todos los caudales del ventilador operativo. Por ejemplo, Gates et al. (2004, 2005) desarrollaron y mejoraron un sistema de numeración de evaluación de ventiladores (FANS) para medir la curva de rendimiento in situ de ventiladores que operan en una casa de animales ventilada mecánicamente con presión negativa (Figura 4.5.10). Esta unidad se coloca contra un ventilador en el interior de la casa, o en el exterior del ventilador con conductos flexibles adecuados (Morello et al., 2014) para dirigir todo el flujo de aire a través de la unidad. Una serie de anemómetros recorren toda el área de flujo para obtener una sola velocidad media del aire, la cual se multiplica por el área de sección transversal de la unidad calibrada. Una serie de estas mediciones tomadas a diferentes presiones estáticas del edificio proporciona una curva empírica de rendimiento del ventilador, obtenida, por ejemplo, de la ecuación de regresión del flujo medido sobre la presión estática del edificio. Luego, se pueden usar mediciones del tiempo de funcionamiento del ventilador y la presión estática concurrente para determinar tasas de flujo de aire razonablemente precisas para cada ventilador, y su suma es la tasa de ventilación del edificio. Trabajos anteriores han demostrado claramente que el descuidar la cuenta de la ventilación del edificio por medio de la medición directa da como resultado una pérdida sustancial en la precisión de las estimaciones para ER, debido a la variación entre los ventiladores.



El enfoque de balance de masas para una estimación global de emisiones de N y C y validación de medición de emisiones
Un enfoque de balance de masas estima las emisiones en función de los cambios en la ganadería a lo largo del tiempo, sin necesidad de medir las emisiones directamente (Figura 4.5.11). El enfoque estima las emisiones totales de N o C en lugar de las emisiones de gases específicos (por ejemplo, N-NH 3, N-N 2 O, N 2, C-CH 4, C-CO 2) o la dinámica de emisiones. La exactitud de los cálculos del balance de masas depende de los datos técnicos y de manejo ganadero disponibles, de la caracterización del estiércol y pienso y, en ciertos casos, de la duración del periodo considerado. Para probar la validez de los datos utilizados para calcular un balance de masas de N o C, se deben calcular los de elementos no volátiles como el fósforo (P) y el potasio (K). Como estos últimos elementos son no volátiles, sus déficits de balance de masas (diferencia entre insumos y salidas) deben ser cero, pero los datos utilizados en los cálculos tendrán incertidumbre, especialmente en condiciones comerciales. Si el déficit de balance de masas para P y K es demasiado alto (e.g., > 15%), entonces se deben reconsiderar las estimaciones de las emisiones totales de N y C.
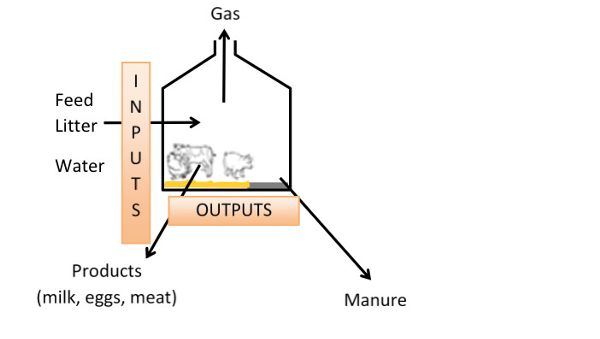
La estimación de las emisiones de N, C o agua (X emisiones, donde X es para N, C o agua) durante el período de producción se puede calcular de acuerdo con la siguiente ecuación:
\[ X_{inputs}-X_{outputs} = X_{emissions} \]
X entradas y X salidas son la cantidad de X en todas las entradas y salidas. La estimación de estas cantidades requiere una cuidadosa recolección de datos (cantidades, composiciones químicas) sobre animales, piensos, huevos o leche (una función de la producción animal), basura, estiércol y mortalidad animal. Se deben utilizar modelos para estimar la cantidad de X en animales en función de su peso.
Aplicaciones
La implementación de los diferentes métodos de medición de emisiones en una casa de animales requiere el desarrollo de un protocolo basado en los objetivos del proyecto, los detalles de la casa de animales, el ambiente interior y el clima al aire libre. Tres puntos importantes que deben considerarse en un protocolo se refieren al muestreo, la adquisición de datos y la verificación de validez de las mediciones.
Muestreo y ubicaciones de sensores
La evaluación de las emisiones de gases requiere medir la concentración de gas de entrada y salida. Se recomienda tomar muestras en entradas o salidas de aire si se pueden identificar, si sus ubicaciones son fijas durante el período de medición y si se puede llegar fácilmente. Cuando estas condiciones no se pueden cumplir, generalmente se seleccionan múltiples ubicaciones dentro de la casa para proporcionar una concentración media en interiores para acomodar la variabilidad espacial de la concentración en interiores. Lo mismo se debe hacer para la concentración al aire libre.
La presencia de animales dentro del área animal hace que la instalación de sensores de gas o tubos de muestreo sea más complicada. Idealmente, deben instalarse cuando no hay animales en la casa, como durante un periodo al aire libre o vacante. Deben ubicarse donde los animales no puedan morderlos, chocar o moverlos, y deben estar cuidadosamente protegidos de los animales (Figura 4.5.12). La colocación exitosa del sensor requiere una compensación entre minimizar las perturbaciones de los animales y maximizar la representatividad de las mediciones.
El ambiente dentro de la carcasa de los animales es generalmente duro para los sensores y el sistema de muestreo de aire. La exposición directa a la combinación de humedad, NH 3 y partículas suspendidas puede dañar los sensores (Figura 4.5.13). Además, el aire interior es generalmente más cálido y húmedo que el aire exterior debido a la producción de calor animal o al uso de un sistema de calefacción o enfriamiento dentro de la casa. Estas diferencias deben considerarse al tomar muestras de aire interior; por ejemplo, los tubos de muestreo deben calentarse y aislarse si las muestras de aire se analizan en un lugar más frío y se puede esperar condensación dentro de las líneas de muestreo.
Adquisición de datos
Durante el periodo de producción, las emisiones pueden variar mucho durante un ciclo de 24 horas y en intervalos de tiempo más largos. La variabilidad se debe a los mismos parámetros que afectan la variabilidad espacial, los cambios en el comportamiento animal, sus patrones de excreción y cantidad, y si tienen o no acceso al aire libre. Por ejemplo, los cerdos y aves de corral de engorde excretarán más nitrógeno amoniacal total (TAN) cada día a medida que crecen, lo que arroja un potencial cada vez mayor de emisiones de NH 3. Estos dos tipos de dinámica temporal (diaria y periodo de producción) deben ser considerados a la hora de medir las emisiones de gases.


También se requiere información relativa a las condiciones de producción (número de animales, consumo de pienso y agua, mortalidad animal) y clima exterior para la validación de las mediciones y comparación con los datos de emisiones ya publicados. Todas las operaciones realizadas por los agricultores u operadores (por ejemplo, cambios de alimentación, suministro de basura o implementación del sistema de enfriamiento) y eventos específicos (por ejemplo, apagado de energía eléctrica) durante el período de medición deben ser señalados porque serán útiles para el análisis e interpretación de datos.

Validación de Mediciones
Para lograr mediciones de buena calidad, los pasos de validación de datos son necesarios en varios niveles:
- • Las mediciones de validación para piezas o toda la configuración de medición deben realizarse con anticipación, especialmente si la configuración, componentes individuales y/o el objetivo de medición (por ejemplo, sistema de carcasa) no se midieron en esta configuración antes.
- • La calibración de los dispositivos analíticos y sensores tiene que realizarse de acuerdo a sus especificaciones. Para algunos instrumentos analíticos, se recomiendan mediciones con un método de referencia (por ejemplo, trampas de ácido para NH 3).
- • Son necesarias comprobaciones frecuentes del modo operativo y los valores de medición, así como las condiciones de vivienda y manejo.
- • Las comprobaciones de plausibilidad de datos brutos y valores de emisión (por ejemplo, comparación de cursos de concentraciones de gas y velocidad del viento, verificación de datos en vista de un rango plausible predeterminado basado en el conocimiento científico y tecnológico del usuario) ayudan a encontrar valores atípicos, valores no lógicos, etc. Estos valores incorrectos tienen que ser eliminado de acuerdo a criterios predefinidos.
- • La redundancia en las mediciones puede mejorar la confiabilidad de los valores. Por ejemplo, las concentraciones de CO 2 podrían medirse tanto con un cromatógrafo de gases como con un analizador óptico de gases durante el arranque o periódicamente durante el proyecto.
- • Comparación de las emisiones acumuladas de N y carbono (C) con los déficits de balance de masa de N y C durante el periodo de medición.
Ejemplos
Ejemplo\(\PageIndex{1}\)
Ejemplo 1: Calcular la tasa de emisión de amoníaco (NH 3) de una casa porcina ventilada mecánicamente utilizando el enfoque de balance de masas de dióxido de carbono
Problema:
El siguiente estudio de caso se basa en un proyecto emprendido en nombre de la Agencia Irlandesa de Protección Ambiental para probar la idoneidad de los factores de emisión de NH 3 existentes que se utilizan actualmente para diferentes etapas de vida de cerdos y explorar el impacto potencial en los sitios Natura 2000 (es decir, Áreas Especiales de Áreas de Conservación y Protección Especial que puedan ser sensibles al N). El equipo de monitoreo es descrito en detalle por Kelleghan et al. (2016).
La casa utilizó ventilación mecánica, con entradas de aire a lo largo del costado de la casa y extractores de techo, pero sin acceso a la corriente de escape para la medición directa de la tasa de ventilación. Las concentraciones de gas se midieron a las 10 de la mañana en una casa con 406 cerdos de engorde de 81.25 kg animal −1 criados en un piso completamente de listones. Las concentraciones interiores de NH 3 en la casa se midieron usando un analizador de amoníaco ultraportátil (UAA) de Los Gatos Research en combinación con una unidad multipuerto de ocho entradas que permite múltiples puntos de muestreo. No se midieron las concentraciones al aire libre; para los propósitos de este estudio y los cálculos, se asumió que eran cero. El CO 2 interior y exterior se midió en el gas de muestra extraído por la UAA usando un sensor K30 CO 2 (Senseair, Suecia). Las concentraciones de gas medidas se presentan en el Cuadro 4.5.1. Parámetros adicionales adaptados para cerdos de acabado se incluyen en la Tabla 4.5.2. Calcular la tasa de ventilación del edificio y la tasa de emisión de NH 3.
Solución
Calcule la tasa de ventilación del edificio utilizando el enfoque de balance de masas de CO 2 expresado por la Ecuación 4.5.6:
| Medido | |
|---|---|
|
CO 2, en interiores |
915 ppm (mL m −3) |
|
CO 2, al aire libre |
403 ppm (mL m −3) |
|
NH 3, en interiores |
3.73 (mg m 3) |
|
NH 3, al aire libre |
0 (mg m 3) |
\( VR=\frac{\text{total heat per house} \times \text{ventilation flow per hpu}}{1000} \)(Ecuación\(\PageIndex{6}\))
Para calcular el calor total por casa, primero, calcular la actividad animal relativa con la Ecuación 4.5.10 usando los valores dados:
| Parámetro | Valor para este experimento |
|---|---|
|
a (Ecuación 4.5.11) |
0.53 |
|
h min (Ecuación 4.5.11) |
1:40 AM = 1.7 en ecuación |
|
n (Ecuación 4.5.9) |
3.38 (g día −1) |
|
c (Ecuación 4.5.10) |
m 3 h −1 hpu −1 |
\( \text{Relative animal activity} = 1-a\ sin[(\frac{2\pi}{24})\times(h+6-h_{min})] \) (Equation \(\PageIndex{10}\))
\( \text{Relative animal activity} = 1-0.53\times sin[(\frac{2\pi}{24})\times(10+6-1.7)] = 1.2994 \)
A continuación, calcule la producción total de calor por animal con la Ecuación 4.5.8:
\( \text{Total heat per animal} = 5.09 \times m^{0.75} + [1-(0.47+0.003\times m)]\times [(n \times 5.09\times m^{0.75})-(5.09\times m^{0.75})] \)(Ecuación\(\PageIndex{8}\))
\( \text{Total heat per animal} = 5.09 \times 81.25^{0.75} + [1-(0.47+0.003\times 81.25)]\times [(0.00338 \times 5.09\times 81.25^{0.75})-(5.09\times 81.25^{0.75})] = 231.6\ W \text{ animal}^{-1} \)
Así, con 406 cerdos, la producción total de calor para la casa es:
\( 406 \times 231.6 = 94026.5\ W \)
A continuación, calcule el flujo de ventilación por unidad productora de calor (hpu) con la Ecuación 4.5.9:
\( \text{Ventilation flow per hpu} = \frac{c \times (\text{relative animal activity})}{CO_{2,indoors}-CO_{2,outdoors} \times 10^{-6}} \)(Ecuación\(\PageIndex{9}\))
\( \text{Ventilation flow per hpu} = \frac{0.185 \times (1.2994)}{(915-403) \times 10^{-6}} = 469.5 \)
El flujo de ventilación por hpu será igual a 469.5 m 3 h −1 hpu −1.
Finalmente, sustituya los valores calculados en la Ecuación 4.5.6 para calcular la tasa de ventilación del edificio:
\( VR = \frac{\text{total heat per house} \times \text{ventilation flow per hpu}}{1000} \)(Ecuación\(\PageIndex{6}\))
\( VR = \frac{94026.5 \times 469.5}{1000} = 44,145.2 \)
La tasa de ventilación del edificio es 44145.2 m 3 h −1.
Para calcular la tasa de emisión de NH 3, tenga en cuenta que la tasa de emisión de NH 3 para la casa es proporcional a la diferencia entre las concentraciones de NH 3 interiores y exteriores multiplicadas por la tasa de ventilación:
\( \frac{(3.73-0)\times 44,145.2}{3600} = 45.7 \)
La tasa de emisión de NH 3 para este ejemplo es 45.7 mL s −1. Esto equivale a 9.7 g día −1 animal −1.
Ejemplo\(\PageIndex{2}\)
Ejemplo 2: Calcular las emisiones de metano (CH 4) de una casa de ganado lechero ventilado naturalmente usando datos de medición de gas trazador (SF 6)
Problema:
Este ejemplo se basa en investigaciones realizadas en viviendas lecheras experimentales para mediciones de emisiones (Mohn et al., 2018). La vivienda consta de dos compartimentos experimentales, cada uno para 20 vacas lecheras, y una sección central para ordeño, instalaciones técnicas, una oficina y análisis. Los compartimentos experimentales son ventilados de forma natural sin aislamiento térmico y con cortinas flexibles como fachadas.
El gas trazador diluido, SF 6, se dosificó continuamente a través de tubos de acero con capilares críticos (cada tres metros) junto a los pasillos para imitar las fuentes de emisión. Los tubos de acero inoxidable y los orificios críticos se protegieron con perfiles metálicos de daños por animales y contaminación con excrementos. Para ajustar la concentración de gas trazador analizado en un rango óptimo (> 0.05 μg m −3, < 1.5 μg m −3 SF 6), el flujo de gas trazador se estableció de acuerdo con las condiciones meteorológicas y de ventilación (p. ej., cortinas abiertas/cerradas) mediante controladores de flujo másico. Muestras integradoras de aire a una altura de 2.5 m con un sistema de tuberías consistente en tubos de teflón y orificios críticos de vidrio (cada segundo metro) permiten una muestra representativa. Los filtros de teflón protegieron los orificios críticos del polvo y los insectos. Los caudales para los orificios individuales de los sistemas de dosificación y muestreo se monitorearon antes y después de cada período de medición utilizando medidores de flujo másico. La instrumentación analítica para el análisis CH 4 (espectrómetro de anillo descendente de cavidad, CRDS, Picarro Inc., Santa Clara, CA, USA) y SF 6 (GC-ECD, Agilent, Santa Clara, CA, USA) se ubicó en un remolque con aire acondicionado en la sección central. Los dos compartimentos se muestrearon alternativamente por 10 min. cada uno. Además, una vez por hora, se muestreó el fondo (aproximadamente 25 m de la vivienda, no afectado por el alojamiento), por lo que se obtuvieron al menos dos muestras de 10 min por compartimento cada hora.
Para describir la situación de medición, se registraron parámetros acompañantes relevantes como el clima de vivienda y exterior, parámetros animales (por ejemplo, peso vivo, rendimiento de leche, composición de la leche, contenido de urea de la leche, contenido de urea en orina) y alimento (calidad y cantidad, cantidad de residuo de canal).
Calcular las emisiones de CH 4 durante una medición de 10 min tomada el 23 de septiembre a las 12:40 p.m. en un compartimento con pisos perforados que albergan 20 vacas. Las concentraciones de gas medidas se presentan en el Cuadro 4.5.3.
Solución
Calcular la corrección de fondo (C x) de acuerdo con la Ecuación 4.5.3 usando concentraciones medidas de SF 6\((C_{SF6})\) y CH 4\((C_{CH4})\):
| Parámetro | Valor |
|---|---|
|
Flujo másico SF 6 |
2.879 g d −1 |
|
Fondo SF 6 |
0.052 μg m −3 |
|
Vivienda SF 6, puntos de muestreo |
1.820 μg m −3 |
|
Fondo CH 4 |
1384.2 μg m −3 |
|
Carcasa CH 4, puntos de muestreo |
9118.6 μg m −3 |
\( C_{x}=C_{x,sp}-C_{x,bgd} \) (Equation \(\PageIndex{3}\))
\( C_{CH4}=9118.6-1384.2=7734.4\ \mu g \ m^{-3} \)
\( C_{SF6}=1.820-0.052=1.768\ \mu g \ m^{-3} \)
Calcular el cálculo de emisión o flujo másico de CH 4 usando la Ecuación 4.5.5:
\( \dot{m}_{G} = \frac{\dot{m}_{T} \times C_{G}}{C_{T}} \)(Ecuación\(\PageIndex{5}\))
\( \dot{m}_{CH4} = \frac{2.879\ g \ d^{-1} \times 7734.4\ \mu g\ m^{-3}}{1.768\ \mu g\ m^{-3}} = 12,597.9\ g\ d^{-1} \)
ER por vaca (20 vacas por compartimento): 629.7 g d −1
Créditos de imagen
Figura 1. Departamento de Medio Ambiente Alimentación y Asuntos Rurales. (CC By 4.0). (2018). Impactos ambientales de las emisiones de amoníaco. Recuperado a partir de https://www.gov.uk/government/publications/code-of-good-agricultural-practice-for-reducing-ammonia-emissions/code-of-good-agricultural-practice-cogap-for-reducing-ammonia-emissions
Figura 2. Calvet, S. (CC Por 4.0). (2014). Proceso que conduce a la emisión de amoníaco y factores contribuyentes. Adaptado de Snoek et al.
Figura 3. Calvet, S. (CC Por 4.0). (2001). Reacciones que conducen a emisiones de N2O: nitrificación (en verde) y desnitrificación (en azul). Adaptado de Wrage et al.
Figura 4. Calvet, S. (CC Por 4.0). (2020). Proceso y microorganismos involucrados en la formación de metano.
Figura 5. Calvet, S. (CC Por 4.0). (2020). Medición directa de emisiones en una casa de animales. Se debe medir la diferencia de concentración entre interiores y exteriores y la tasa de ventilación (adaptado de Calvet et al., 2013).
Figura 6. Hassouna, M. (CC Por 4.0). (2020). Configuración de trampa de ácido.
Figura 7. Hassouna, M. (CC Por 4.0). (2020). Conducto para dispersar un gas trazador dentro de una casa de animales.
Figura 8. Agroscopio, Schrade, S. (CC Por 4.0). (2020). a) Dosificación de gas trazador mediante tubos de acero con orificios críticos protegidos por elementos de acero junto a los pisos en una carcasa láctea; (b) botellas de gas con controlador de flujo másico. Fotos adaptadas de Agrocope. [Uso justo].
Figura 9. Agroscopio, Schrade, S. (CC Por 4.0). (2020). Principio del método del gas trazador.
Figura 10. Gates, R. (CC Por 4.0). (2020). Fan Assessment Numeration System (FANS) desarrollado por Gates et al. (2005) para describir la curva de rendimiento de un ventilador de ventilación en una casa de animales. Tenga en cuenta que la unidad se puede usar tanto en el lado de entrada como en el lado de escape del ventilador de ventilación.
Figura 11. Hassouna, M. (CC Por 4.0). (2016). El enfoque del balance de masas en casas de animales.
Figura 12. Derecha. Agroscopio, Schrade, S. (CC Por 4.0). (2020). Los sensores deben instalarse fuera del alcance de los animales.
Figura 12 Izquierda. Hassouna, M. (CC Por 4.0). (2020). Los sensores deben instalarse fuera del alcance de los animales.
Figura 13. Hassouna, M. (CC Por 4.0). (2020). Obstrucción de un tubo de muestreo y su filtro de polvo después de tres meses de medición en una casa de ganado lechero.
Referencias
Blanes, V., & Pedersen, S. (2005). Flujo de ventilación en casas porcinas medido y calculado mediante ecuaciones de dióxido de carbono, humedad y equilibrio térmico. Biosyst. Ing. , 92 (4), 483-493. https://doi.org/10.1016/j.biosystemseng.2005.09.002.
Calvet, S., Gates, R. S., Zhang, G., Estelles, F., Ogink, N. W. M., Pedersen, S., & Berckmans, D. (2013). Medición de emisiones de gases de edificios ganaderos: Una revisión sobre análisis de incertidumbre y fuentes de error. Biosyst. Ing. , 116 (3), 221-231. https://doi.org/10.1016/j.biosystemseng.2012.11.004.
Estelles, F., Fernández, N., Torres, A. G., & Calvet, S. (2011). Uso de balanzas de CO 2 para determinar las tasas de ventilación en una casa de conejos de engorde. Español J. Agric. Res., 9 (3), 8. doi.org/10.5424/SJAR/20110903-368-10.
Gates, R. S., Casey, K. D., Xin, H., Wheeler, E. F., & Simmons, J. D. (2004). Especificaciones de diseño y calibración del sistema de numeración de evaluación de ventiladores (FANS) Trans. ASAE, 47 (5), 1709-1715. https://doi.org/10.13031/2013.17613.
Gates, R. S., Xin, H., Casey, K. D., Liang, Y., & Wheeler, E. F. (2005). Método para medir las emisiones de amoníaco de los aviaderos. J. Appl. Avicultura Res., 14 (3), 622-634. https://doi.org/10.1093/japr/14.3.622.
Hassouna, M., Eglin, T., Cellier, P., Colomb, V., Cohan, J.-P., Decuq, C.,. Ponchant, P. (2016). Medición de emisiones de la ganadería: Gases de efecto invernadero, amoníaco y óxidos de nitrógeno. Francia: INRA-ADEME.
ISO 3966. (2008). Medición del flujo de fluido en conductos cerrados. Método de área de velocidad para flujos regulares utilizando tubos estáticos Pitot.
Kelleghan, D. B., Hayes, E. T., & Curran, T. P. (2016). Perfil de amoníaco y vapor de agua en una casa irlandesa de producción de pollos de engorde. Papel ASABE N° 162461252. San José, MI: ASABE. https://doi.org/10.13031/aim.20162461252.
Mohn, J., Zeyer, K., Keck, M., Keller, M., Zahner, M., Poteko, J.,. Schrade, S. (2018). Un método de relación de trazador doble para mediciones comparativas de emisiones en una vivienda experimental de lechería. Ambiente Atmosférico. , 179, 12-22. https://doi.org/10.1016/j.atmosenv.2018.01.057.
Morello, G. M., Overhults, D. G., Day, G. B., Gates, R. S., Lopes, I. M., & Earnest Jr., J. (2014). Uso del sistema de numeración de evaluación de ventiladores (FANS) in situ: Un procedimiento para minimizar errores durante las pruebas de ventilador. Trans. ASABE, 57 (1), 199-209. https://doi.org/10.13031/trans.57.10190.
Ogink, N. W. M., Mosquera, J., Calvet, S., & Zhang, G. (2013). Métodos para medir las emisiones de gases de edificios ganaderos ventilados de forma natural: Desarrollos de la última década y perspectivas de mejora. Biosyst. Ing. , 116 (3), 297-308. https://doi.org/10.1016/j.biosystemseng.2012.10.005.
Pedersen, S., & Sallvik, K. (2002). 4º Informe del grupo de trabajo sobre climatización de casas de animales. Producción de calor y humedad a nivel animal y doméstico. Centro de Investigación Bygholm, Instituto Danés de Ciencias Agrícolas.
Pedersen, S., Blanes-Vidal, V., Jorgensen, H., Chwalibog, A., Haeussermann, A., Heetkamp, M. J., & Aarnink, A. J. (2008). Producción de dióxido de carbono en casas de animales: una revisión de la literatura. Agric. Ing. Int.: CIGR J.
Phillips, V. R., Lee, D. S., Scholtens, R., Garland, J. A., & Sneath, R. W. (2001). Una revisión de los métodos para medir las tasas de emisión de amoníaco de edificios ganaderos y almacenes de purines o estiércol, Parte 2: Monitoreo de caudales, concentraciones y tasas de flujo de aire. J. Agric. Ing. Res., 78 (1), 1-14. https://doi.org/10.1006/jaer.2000.0618.
Powers, W., & Capelari, M. (2016). Métodos analíticos para cuantificar el flujo de gases de efecto invernadero en sistemas de producción animal. J. Ciencia Animal. , 94 (8), 3139-3146. https://doi.org/10.2527/jas.2015-0017.
RAMIRAN. (2011). Glosario de términos sobre manejo ganadero y estiércol. Recuperado de http://ramiran.uvlf.sk/doc11/RAMIRAN%20Glossary_2011.pdf.
Samer, M., Ammón, C., Loebsin, C., Fiedler, M., Berg, W., Sanftleben, P., & Brunsch, R. (2012). Balance de humedad y técnica de gases trazadores para la medición de tasas de ventilación y cuantificación de emisiones de gases de efecto invernadero y amoníaco en edificios con ventilación natural. Edificio Environ. , 50, 10-20. https://doi.org/10.1016/j.buildenv.2011.10.008.
Sherman, M. H. (1990). Técnicas de trazador-gas para medir la ventilación en una sola zona. Edificio Environ. , 25 (4), 365-374. https://doi.org/10.1016/0360-1323(90)90010-O.
Snoek, D. J. W., Stigter, J. D., Ogink, N. W. M., & Groot Koerkamp, P. W. G. (2014). Análisis de sensibilidad de modelos mecanicistas para estimar la emisión de amoníaco de charcos de orina de vacas lecheras. Biosyst. Ing. , 121, 12-24. https://doi.org/10.1016/j.biosystemseng.2014.02.003.
Wang, X., Ndegwa, P. M., Joo, H., Neerackal, G. M., Stockle, C. O., Liu, H., & Harrison, J. H. (2016). Método indirecto versus método directo para medir tasas de ventilación en casas lecheras ventiladas naturalmente. Biosyst. Ing. , 144, 13-25. https://doi.org/10.1016/j.biosystemseng.2016.01.010.
Wrage, N., Velthof, G. L., van Beusichem, M. L., & Oenema, O. (2001). Papel de la desnitrificación del nitrificador en la producción de óxido nitroso. Suelo Biol. Bioquímica. , 33 (12), 1723-1732. https://doi.org/10.1016/S0038-0717(01)00096-7.


