6.3: Quimiostato Bacteriano
- Page ID
- 85599
Introducción
Los biorreactores se utilizan para cultivar, cosechar y mantener las células deseadas de manera controlada. Estas células crecen y se replican en presencia de un ambiente adecuado con medios que suministran los nutrientes esenciales para el crecimiento. Las células cultivadas en estos biorreactores se recolectan para catalizar enzimáticamente la síntesis de productos valiosos o alterar la estructura existente de un sustrato volviéndolo útil. Otros biorreactores se utilizan para cultivar y mantener diversos tipos de cultivos de tejidos. Los sistemas de control de procesos deben utilizarse para optimizar la producción del producto mientras se mantienen las delicadas condiciones requeridas para la vida. Estos incluyen, pero no se limitan a, temperatura, niveles de oxígeno (para procesos aeróbicos), pH, caudal del sustrato y presión. Un quimiostato bacteriano es un tipo específico de biorreactor. Uno de los principales beneficios de un quimiostato es que es un proceso continuo (un CSTR), por lo que la tasa de crecimiento bacteriano se puede mantener en estado estacionario controlando la velocidad de alimentación volumétrica. Los quimiostatos bacterianos tienen muchas aplicaciones, algunas de las cuales se enumeran a continuación.
- Farmacéuticos: Se utiliza para estudiar una serie de bacterias diferentes, siendo un ejemplo específico el análisis de cómo las bacterias responden a diferentes antibióticos. Las bacterias también se utilizan en la producción de proteínas terapéuticas como la insulina para diabéticos.
- Fabricación: Utilizado para producir etanol, la fermentación de azúcar por bacterias se lleva a cabo en una serie de quimiostatos. Además, se producen muchos antibióticos diferentes en los quimiostatos.
- Industria Alimentaria: Se utiliza en la producción de alimentos fermentados como el queso.
- Investigación: Se utiliza para recopilar datos para ser utilizados en la creación de un modelo matemático de crecimiento para células u organismos específicos.
Las siguientes secciones cubren la información necesaria para evaluar los quimiostatos bacterianos.
Diseño de quimiostato bacteriano
El quimiostato bacteriano es un reactor continuo de tanque agitado (CSTR) utilizado para la producción continua de biomasa microbiana.
Configuración de quimiostato
La configuración del quimiostato consiste en un depósito estéril de nutrientes frescos conectado a una cámara de crecimiento o reactor. El medio fresco que contiene nutrientes esenciales para el crecimiento celular se bombea continuamente a la cámara desde el reservorio del medio. El medio contiene una concentración específica de nutriente limitante del crecimiento (C s), lo que permite una concentración máxima de células dentro de la cámara de crecimiento. La variación de la concentración de este nutriente limitante del crecimiento cambiará, a su vez, la concentración en estado estacionario de las células (C c). Otro medio para controlar la concentración celular en estado estacionario es manipular la velocidad a la que el medio fluye hacia la cámara de crecimiento. El medio gotea en cultivo a través de la rotura de aire para evitar que las bacterias viajen aguas arriba y contaminen el reservorio de medio estéril.
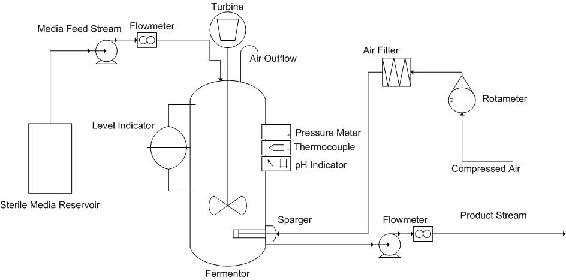
Los contenidos bien mezclados del vaso, que consisten en nutrientes no utilizados, desechos metabólicos y bacterias, son retirados del vaso y monitoreados por un indicador de nivel, con el fin de mantener un volumen constante de líquido en el quimiostato. Este flujo de efluente puede ser controlado por una bomba o un puerto en el lado del reactor que permite la eliminación del exceso de líquido de reacción. En cualquier caso, la corriente efluente necesita ser capaz de eliminar el exceso de líquido más rápido que la corriente de alimentación puede suministrar nuevo medio para evitar que el reactor se desborde.
La temperatura y la presión también deben controlarse dentro del quimiostato para mantener las condiciones óptimas para el crecimiento celular. El uso de un CSTR encamisado para la cámara de crecimiento permite un fácil control de la temperatura. Algunos procesos como la fermentación biológica son bastante exotérmicos, por lo que se utiliza agua de enfriamiento para mantener la temperatura en su nivel óptimo. En cuanto a la presión del reactor, se controla mediante una corriente de aire de salida que permite la eliminación del exceso de gas.
Para cultivos aeróbicos, el aire purificado es burbujeado a través del contenido del recipiente por un burbujeador. Esto asegura que suficiente oxígeno pueda disolverse en el medio de reacción. Para los procesos anaeróbicos, generalmente no hay necesidad de una entrada de aire, pero debe haber una salida de gas para evitar una acumulación de presión dentro del reactor.
Para evitar que la mezcla de reacción se vuelva demasiado ácida (la respiración celular hace que el medio se vuelva ácido) o demasiado básica, lo que podría dificultar el crecimiento celular, se necesita un controlador de pH para llevar el equilibrio del pH al sistema.
El agitador asegura que el contenido del recipiente esté bien mezclado. Si la velocidad de agitación es demasiado alta, podría dañar las células en cultivo, pero si es demasiado baja, los gradientes podrían acumularse en el sistema. Gradientes significativos de cualquier tipo (temperatura, pH, concentración, etc.) pueden ser perjudiciales para la producción celular y pueden impedir que el reactor alcance el funcionamiento en estado estacionario.
Otra preocupación en el diseño del reactor es el ensuciamiento. El ensuciamiento se define generalmente como la deposición y acumulación de materiales no deseados en las superficies sumergidas o superficies en contacto con el flujo de fluido. Cuando el material depositado es de naturaleza biológica, se llama bioincrustación. El ensuciamiento o bioincrustación en un sistema como este puede provocar una disminución en la eficiencia de los intercambiadores de calor o una disminución del área de la sección transversal en las tuberías. El ensuciamiento en las superficies del intercambiador de calor hace que el sistema no funcione de manera óptima, esté fuera del rango de temperatura objetivo o gaste exceso de energía para mantener la temperatura óptima. El ensuciamiento en las tuberías conduce a un aumento en la caída de presión, lo que puede causar complicaciones en el futuro. Para minimizar estos efectos, los reactores de quimiostato industriales son comúnmente cilíndricos, contienen volúmenes de hasta 1300 metros cúbicos, y a menudo se construyen a partir de acero inoxidable. La forma cilíndrica y la superficie lisa de acero inoxidable permiten una fácil limpieza.
Ecuaciones de diseño
Las ecuaciones de diseño para reactores de tanque agitado continuo (CSTR) son aplicables a los quimiostatos. Se tienen que hacer equilibrios tanto en las células en cultivo como en el medio (sustrato).
Balance de Masa
El balance de masa sobre los microorganismos en un CSTR de volumen constante es:
[Tasa de acumulación de células, g/s] = [Tasa de entrada de células, g/s] — [Tasa de salida de células, g/s] + [Tasa neta de generación de células vivas, g/s]
El balance de masa sobre el sustrato en un CSTR de volumen constante es:
[Tasa de acumulación de sustrato, g/s] = [Tasa de entrada de sustrato, g/s] — [Tasa de salida del sustrato, g/s] + [Tasa neta de consumo de sustrato, g/s]
Suponiendo que no entren células en el reactor desde la corriente de alimentación, el balance de masa celular se puede reelaborar de la siguiente manera:
\[(Rate Accumulation Cells) =V \frac{d C_{C}}{d t} \label{1} \]
\[\text { (Flow Entering) }-(\text {Flow Leaving})=0-\nu_{0} C_{C} \label{2} \]
\[\text{Rate Cell Generation} =V\left(r_{g}-r_{d}\right) \label{3} \]
De manera similar, el balance de masa del sustrato puede ser reelaborado de la siguiente manera:
\[\text{Rate Accumulation Substrate} =V \frac{d C_{S}}{d t} \label{4} \]
\[\text { (Flow Entering) }-(\text {Flow Leaving})=\nu_{0} C_{S 0}-\nu_{0} C_{S} \label{5} \]
\[\text{Rate Substrate Consumption} =V r_{S} \label{6} \]
Poner ecuaciones\ ref {1} -\ ref {3} juntas da la ecuación de diseño para células en un quimiostato:
\[V \frac{d C_{C}}{d t}=0-\nu_{0} C_{C}+V\left(r_{g}-r_{d}\right) \label{7} \]
Del mismo modo, las ecuaciones\ ref {4} -\ ref {6} juntas dan la ecuación de diseño para sustrato en un quimiostato:
\[V \frac{d C_{S}}{d t}=\nu_{0} C_{S 0}-\nu_{0} C_{S}+V\left(r_{g}-r_{d}\right) \label{8} \]
Los supuestos hechos sobre el CSTR incluyen mezcla perfecta, densidad constante de los contenidos del reactor, condiciones isotérmicas y una única reacción irreversible.
Leyes de tarifas
Existen muchas leyes para la tasa de crecimiento de nuevas células.
Ecuación de Monod
La ecuación de Monod es el modelo más utilizado para la curva de respuesta de tasa de crecimiento de bacterias.
\[r_{g}=\mu C_{c} \label{9} \]
donde
- r g = tasa de crecimiento celular
- C c = cencentración celular
- μ = tasa de crecimiento específica
La tasa específica de crecimiento celular, μ, se puede expresar como
\[\mu=\mu_{\max } \frac{C_{s}}{K_{s}+C_{s}} \label{10} \]
donde
- μ max = una velocidad de reacción de crecimiento específica máxima
- K s = la constante de Monod
- C s = concentración de sustrato
Ecuación Tessier y Ecuación de Moser
Dos ecuaciones adicionales se utilizan comúnmente para describir la tasa de crecimiento celular. Son las Ecuaciones Tessier y Moser. Estas leyes de crecimiento serían utilizadas cuando se encuentre que se ajusten mejor a los datos experimentales, específicamente al inicio o al final de la fermentación.
Ecuación Tessier:
\[r_{g}=\mu_{\max }\left[1-\exp \left(-\frac{C_{s}}{k}\right)\right] C_{c} \label{11} \]
Ecuación de Moser:
\[r_{g}=\frac{\mu_{\max } C_{s}}{1+k C_{s}^{-\lambda}} \label{12} \]
donde\(λ\) y\(k\) son constantes empíricas determinadas por los datos medidos.
Tasa de mortalidad
La tasa de mortalidad de las células\(r_d\),, toma en cuenta la muerte natural\(k_d\),, y la muerte por subproducto tóxico\(k_t\), donde\(C_t\) está la concentración de subproducto tóxico.
\[r_{d}=\left(k_{d}+k_{t} C_{t}\right) C_{c} \label{13} \]
Fase de muerte La fase de muerte del crecimiento de las células bacterianas es donde se produce una disminución en la concentración de células vivas. Esta disminución podría ser el resultado de un subproducto tóxico, ambientes hostiles o agotamiento de nutrientes.
Estequiometría
Para modelar la cantidad de sustrato y producto que se consume/produce en las siguientes ecuaciones, se utilizan coeficientes de rendimiento. Y sc e Y pc son los coeficientes de rendimiento para sustrato a células y producto a células, respectivamente. Los coeficientes de rendimiento tienen las unidades de g variable/g celdas. La ecuación\ ref {14} representa la tasa de agotamiento del sustrato:
\[-r_{s}=Y_{s c} r_{g}+m C_{c} \label{14} \]
La ecuación\ ref {15} representa la tasa de formación del producto:
\[r_{p}=Y_{p c} r_{g} \label{15} \]
Factores de Control
El crecimiento y supervivencia de las bacterias dependen del monitoreo y control de muchas condiciones dentro del quimiostato como el nivel de pH, la temperatura, el nivel de oxígeno disuelto, la tasa de dilución y la velocidad de agitación. Como se esperaba con los CSTR, las bombas que entregan el medio fresco y eliminan el efluente se controlan de tal manera que el volumen de fluido en el recipiente permanece constante.
Nivel de pH
Diferentes células favorecen diferentes ambientes de pH. Los operadores necesitan determinar un pH óptimo y mantener el CSTR en él para una operación eficiente. Controlar el pH a un valor deseado durante el proceso es extremadamente importante porque existe una tendencia hacia un pH más bajo asociado al crecimiento celular debido a la respiración celular (el dióxido de carbono se produce cuando las células respiran y forma ácido carbónico que a su vez provoca un pH más bajo). Bajo condiciones de pH extremo, las células no pueden crecer adecuadamente, por lo tanto, se deben tomar las medidas adecuadas para restaurar el pH original (es decir, agregar ácido o base).
Temperatura
Controlar la temperatura también es crucial porque el crecimiento celular puede verse afectado significativamente por las condiciones ambientales. Elegir la temperatura adecuada puede maximizar la tasa de crecimiento celular ya que muchos de los activadores enzimáticos funcionan mejor a su temperatura óptima debido a la naturaleza proteica de las enzimas.
Tasa de dilución
Una de las características importantes del quimiostato es que permite al operador controlar la tasa de crecimiento celular. La forma más común es controlar la tasa de dilución, aunque se pueden utilizar otros métodos como controlar la temperatura, el pH o la velocidad de transferencia de oxígeno. La velocidad de dilución se define simplemente como el caudal volumétrico de nutriente suministrado al reactor dividido por el volumen del cultivo (unidad: tiempo-1). Al usar un quimiostato, es útil tener en cuenta que la tasa de crecimiento específico de las bacterias es igual a la tasa de dilución en estado estacionario. En este estado estacionario, la temperatura, el pH, el caudal y la concentración del sustrato de alimentación permanecerán estables. De igual manera, el número de celdas en el reactor, así como la concentración de reactivo y producto en la corriente efluente permanecerán constantes.
Las consecuencias negativas pueden ocurrir si la tasa de dilución excede la tasa de crecimiento específica. Como puede verse en la Ecuación\ ref {16} a continuación, cuando la tasa de dilución es mayor que la tasa de crecimiento específica (D > μ), el término dC C/dt se vuelve negativo.
\[\frac{d C_{C}}{d t}=(\mu-D) C_{C} \label{16} \]
Esto demuestra que la concentración de células en el reactor disminuirá y eventualmente llegará a ser cero. Esto se llama lavado, donde las células ya no pueden mantenerse en el reactor. La ecuación\ ref {17} representa la velocidad de dilución a la que ocurrirá el lavado.
\[D_{m a x}=\frac{\mu_{m a x} C_{s 0}}{K_{s}+C_{s 0}} \label{17} \]
En general, al aumentar la tasa de dilución se incrementará el crecimiento de las células. Sin embargo, la tasa de dilución aún necesita ser controlada en relación con la tasa de crecimiento específica para evitar el lavado. La tasa de dilución debe regularse para maximizar la tasa de producción celular. La Figura 1 a continuación muestra cómo la tasa de dilución afecta la tasa de producción celular (DC C), la concentración celular (C C) y la concentración de sustrato (C S).
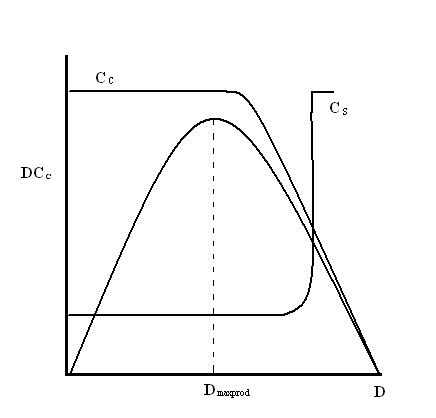
Inicialmente, la tasa de producción celular aumenta a medida que aumenta la tasa de dilución. Cuando se alcanza D maxprod, la tasa de producción celular es máxima. Este es el punto donde las células no crecerán más rápido. D = μ (tasa de dilución = tasa de crecimiento específico) también se establece en este punto, donde se alcanza el equilibrio en estado estacionario. La concentración de células (C C) comienza a disminuir una vez que la tasa de dilución excede la D maxprod. La concentración celular continuará disminuyendo hasta que llegue a un punto en el que todas las células sean lavadas. En esta etapa, habrá un fuerte incremento en la concentración de sustrato debido a que cada vez hay menos células presentes para consumir el sustrato.
Tasa de transferencia de oxígeno
Dado que el oxígeno es un nutriente esencial para todo el crecimiento aeróbico, es crucial mantener un suministro adecuado de oxígeno durante los procesos aeróbicos. Por lo tanto, para maximizar el crecimiento celular, la optimización de la transferencia de oxígeno entre las burbujas de aire y las células se vuelve extremadamente importante. La tasa de transferencia de oxígeno (OTR) nos dice cuánto oxígeno se consume por unidad de tiempo cuando determinadas concentraciones de células se cultivan en el biorreactor. Esta relación se expresa en la Ecuación\ ref {18} a continuación.
\[\text{Oxygen Transfer Rate (OTR)} = Q_{\ce{O2}}C_C \label{18} \]
Donde C C es simplemente la concentración de células en el reactor y Q O2 es la tasa de respiración microbiana o tasa específica de absorción de oxígeno. El quimiostato es una herramienta muy conveniente para estudiar el crecimiento de células específicas ya que permite a los operadores controlar la cantidad de oxígeno suministrado al reactor. Por lo tanto, es esencial que el nivel de oxígeno se mantenga en un nivel apropiado debido a que el crecimiento celular puede verse seriamente limitado si se suministra oxígeno inadecuado.
Velocidad de agitación
Un agitador, generalmente automatizado y alimentado con un motor, mezcla el contenido del quimiostato para proporcionar una suspensión homogénea. Esto permite que las células individuales en el cultivo entren en contacto con el nutriente limitante del crecimiento y lograr una distribución óptima de oxígeno cuando los cultivos aeróbicos están presentes. Una agitación más rápida y rigurosa acelera el crecimiento celular. También se puede requerir agitación para romper las aglutinaciones de células bacterianas que se puedan formar.
Q&A
P1: ¿Por qué un quimiostato se llama quimiostato?
A1: Porque el ambiente químico es estático, o en estado estacionario. Se supone que el volumen de fluido, la concentración de nutrientes, el pH, la densidad celular y otros parámetros permanecen constantes durante toda la operación del recipiente.
P2: ¿Cuáles son algunas preocupaciones con respecto a los quimiostatos?
A2: a) La formación de espuma da como resultado un desbordamiento, por lo que el volumen de líquido no será constante. b) El cambio de la velocidad de bombeo al encender y apagar la bomba en períodos cortos puede no funcionar. Las células responden a estos cambios alterando las tasas. Se necesita un intervalo muy corto para que responda correctamente. c) Las células frágiles y vulnerables pueden dañares/roturas cuando son atrapadas entre la barra de agitación magnética y el vaso del vaso. d) La contaminación bacteriana ocurre porque las bacterias viajan aguas arriba fácilmente y contaminan el medio estéril. Esto se puede resolver interrumpiendo la trayectoria del líquido con un corte de aire.
P3: La ecuación de Monod utiliza una relación Michaelis-Menten que se basa en una suposición cuasi-estatal. (T/F)
A3: T
P4: Una característica importante del quimiostato es la tasa de dilución. Definir la tasa de dilución.
A4: Tasa de dilución = volumen de medio nutritivo suministrado por hora dividido por el volumen del cultivo.
P5: ¿Cuáles son las ventajas/desventajas sobre elegir un quimiostato en lugar de un reactor discontinuo para las biorreacciones?
A5: Ventajas: 1. Un quimiostato tiene mejor productividad que un reactor discontinuo. Hay una mayor tasa de producto por tiempo por volumen. Un proceso por lotes desperdicia tiempo. 2. Un quimiostato se opera en estado estacionario, por lo que tiene un mejor control manteniendo las mismas condiciones para todo el producto producido.
Desventajas: 1. Un quimiostato es menos flexible que un reactor discontinuo. Se puede utilizar un reactor discontinuo para elaborar más de un producto. 2. Es más difícil mantener un sistema estéril en un quimiostato. Un reactor discontinuo es más fácil de limpiar.
P6: ¿Cuál es el significado físico de la constante de Monod?
A6: La constante de Monod es una concentración de sustrato a la que la tasa de crecimiento de la biomasa de las células microbianas que participan en la reacción es la mitad de la tasa de crecimiento máxima.
Investigadores de la Universidad de Michigan están utilizando un quimiostato bacteriano para modelar el tracto intestinal de un cerdo con el fin de estudiar el metabolismo de la bacteria E. Coli en ese ambiente en particular. La cámara de crecimiento del quimiostato tiene un volumen de 500 dm 3.
La concentración inicial de bacterias E. Coli inoculadas en la cámara de crecimiento del quimiostato es de 1 g/dm 3. Se alimenta una alimentación de sustrato de 100 g/dm 3 al quimiostato a un caudal volumétrico de 20 dm 3 /h. ¿Cuánto tiempo se requiere para que este proceso bioquímico alcance un ritmo constante desde el punto de inicio? Supongamos que la tasa de crecimiento es la ecuación de Monod para el crecimiento de células bacterianas bacterianas, mostrada anteriormente.
Se dan datos adicionales relacionados con el problema: μ max = 0.8; K s = 1.7 g/dm 3; Y s/c = 8; Y p/c = 5; m = 0; r d = 0;
Dibujo esquemático
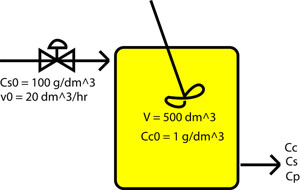
Respuesta = 3.7 horas
Solución
El Quimiostato se modeló en Excel utilizando las ecuaciones de diseño anteriores y el Método de Euler. Luego se graficó una gráfica de Concentración Celular (g/dm 3) vs Tiempo (hr). Cuando la Concentración Celular se vuelve estable, se ha alcanzado el estado estacionario y el tiempo se puede leer de la gráfica. A continuación se muestra una captura de pantalla del modelo y la gráfica creada.
captura de pantalla de modelo de Excel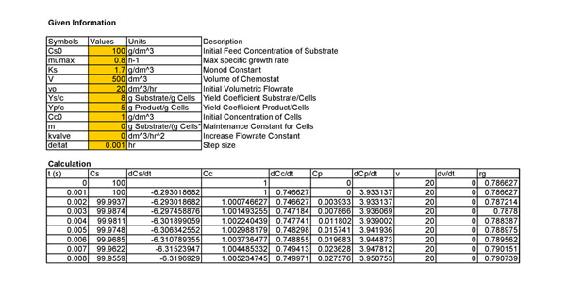
Gráfica de Excel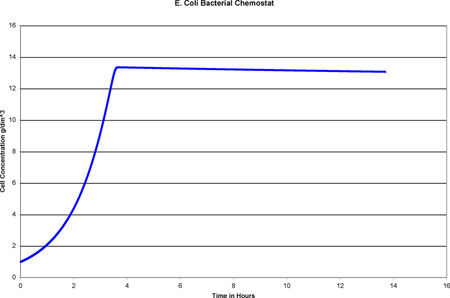
Esta gráfica muestra claramente que el estado estacionario se alcanza 3.7 horas después de la puesta en marcha.
Después de calcular el tiempo requerido para alcanzar el estado estacionario, los investigadores deciden poner en marcha el quimiostato. Mientras lo hace, la válvula de control para la alimentación del sustrato de entrada funciona mal. El caudal de sustrato hacia el quimiostato se acelera a 40 dm 3 /hr 2. Determinar cuánto tiempo tienen para corregir el problema antes de que ocurra el lavado y se pierdan todas las bacterias en el quimiostato.
Dibujo esquemático
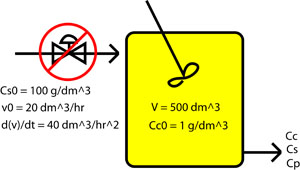
Modelado del mal funcionamiento
\[\\frac{d\nu_0}{dt}= kvalve = 40 \nonumber \]
Respuesta = 20 horas
Solución
El Quimiostato se modeló en Excel utilizando las ecuaciones de diseño anteriores y el Método de Euler. Luego se graficó una gráfica de Concentración Celular (g/dm 3) vs Tiempo (hr). Cuando la Concentración Celular se convierte en cero se llevó a cabo el lavado de la bacteria. A continuación se muestra una captura de pantalla del modelo y la gráfica creada.
captura de pantalla de modelo de Excel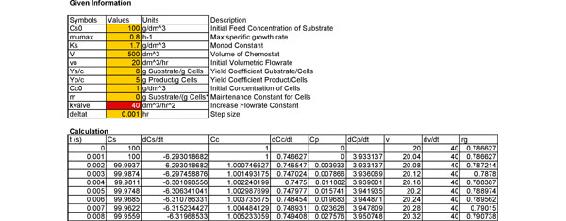
Gráfica de Excel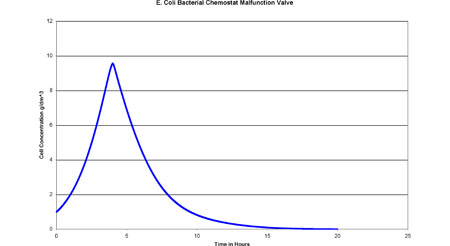
Esta gráfica muestra claramente que el lavado ocurre 20 horas después de la puesta en marcha. Podemos ver en el ejemplo que los controles de proceso son extremadamente importantes para los Quimiostatos Bacterianos.
El modelo de plantilla utilizado tanto para el Ejemplo Fundido 1 como para el 2 se puede descargar aquí Medios: Quimiostato Bacteriano Template.xls
Referencias
- “Quimiostato”. Diccionario McGraw-Hill de términos científicos y técnicos. McGraw-Hill Companies, Inc., 2003. Consultado el 16 de septiembre de 2007. Disponible http://www.answers.com/topic/chemostat
- Fogler, H. Scott (2006). Elementos de Ingeniería de Reacciones Químicas. Nueva Jersey: Prentice Hall PTR. ISBN 0-13-047394-4
- Kelly, C. “Ch 9 - Reactores” 17 febrero, 2004. Recuperado 2007-09-24. Disponible www.ecs.syr.edu/facultación/kelly/handouts/bioquímica%20ingeniería/capíto% 209% 20reactors.ppt
- Smith, H.L. (2006). “Crecimiento Bacteriano”. Recuperado el 2007-09-15.
- Strandberg, Per Erik (2004). “Modelos matemáticos de crecimiento poblacional bacteriano en biorreactores: formulación, imágenes de espacio de fase, optimización y control”. Recuperado el 2007-09-16.
- Strandberg, Per Erik (2003). “El Quimiostato”. Recuperado el 2007-09-15.
- “¿Qué es un biorreactor?” Transgalactic Ltd., 25 de mayo de 2005. Recuperado 2007-09-24. Disponible http://www.bionewsonline.com/o/what_is_bioreactor.htm
Colaboradores y Atribuciones
Autores: Shoko Asei, Brian Byers, Alexander Eng, Nicholas James, Jeffrey Leto
Stewards: Jeffrey falta, Taylor Lebeis, Shawn Mayfield, Marc Stewart, Thomas Welch
Stewards: Sarah Hebert, Valerie Lee, Matthew Morabito, Jamie Polan


