6.7: Modelo ODE y Excel de un PFR adiabático
- Page ID
- 85614
Introducción
Un reactor de flujo pistón (PFR) es un reactor tubular utilizado en reacciones químicas. Los reactivos entran en un extremo del PFR, mientras que los productos salen por el otro extremo del tubo. Un PFR es útil debido a la alta conversión volumétrica y buena transferencia de calor. Los PFR llevan a cabo reacciones de ley de poder más rápido que los CSTRs y generalmente requieren menos volumen. El modelado Excel para un reactor adiabático de flujo pistón es útil para estimar la conversión en función del volumen. Al ingresar los valores de las constantes y cambiar iterativamente el volumen, se puede determinar la conversión a un volumen específico. Esto elimina la necesidad de complicados cálculos manuales y ayuda al usuario a visualizar la reacción y notar tendencias a través del PFR. Alternativamente, el modelado excel también puede determinar la temperatura dentro del reactor en función del volumen. La integración de Euler se utiliza para estimar la conversión o temperatura a través del PFR. Al asegurar que los intervalos de volumen sean pequeños, los valores de conversión o temperatura generados deben ser bastante precisos. Consulte la sección del método de Euler para obtener más información sobre su implementación.
Algoritmo básico para modelar PFR adiabático
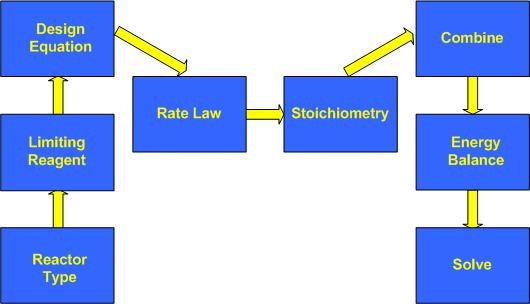
El modelo presentado incluirá los siguientes supuestos:
- Caída de presión insignificante
- Reacción elemental simple
- Cinética de la ley de poder
- Propiedades constantes del fluido (es decir, capacidad calorífica)
Para describir el algoritmo básico para una PFR adiabática, se considerará un caso simple donde A puro ingresa al reactor:
\[ \ce{aA <=> aB} \nonumber \]
1. Tipo de Reactor
PFR
2. Reactivo limitante
Las ecuaciones de diseño y velocidad deben expresarse en términos del reactivo limitante. Aquí, A es el reactivo limitante.
3. Ecuación de diseño
La ecuación de diseño para una PFR se puede expresar en términos de varias variables, incluyendo conversión, moles y concentración. Es importante señalar que la ecuación de diseño en términos de conversión solo puede usarse si se está produciendo una reacción. De lo contrario, deberá expresarse en términos de moles o concentración. La ecuación para describir la conversión en función del volumen, derivada de un simple balance molar, se muestra a continuación en la Ecuación\ ref {1}.
\[\frac{d X}{d V}=\frac{-r_{A}}{F_{A} O} \label{1} \]
- Conversión X=
- V= volumen
- r A = velocidad de reacción de A
- F Ao = moles iniciales de A
4. Ley de tarifas
La ley de velocidad es independiente del tipo de reactor. Se expresa en términos de constante de velocidad y concentración. Si la reacción es irreversible, la ley de velocidad se modela de acuerdo con la Ecuación\ ref {2}. Si la reacción es reversible, la ley de velocidad modela Ecuación\ ref {3} en la que debe contabilizarse la concentración de B y la constante de equilibrio.
\[\begin{align} -r_{A} &=k c_{A}^{a} \label{2} \\[4pt] -r_{A} &=k\left(c_{A}^{a}-\frac{c_{B}^{b}}{K_{c}}\right) \label{3} \end{align} \]
donde
- k= constante de velocidad
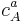 = concentración de\(A\) con coeficiente estequiométrico\(a\)
= concentración de\(A\) con coeficiente estequiométrico\(a\)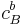 = concentración de\(B\) con coeficiente estequiométrico\(b\)
= concentración de\(B\) con coeficiente estequiométrico\(b\)- K C = constante de equilibrio
Si la reacción no es isotérmica, la constante de velocidad y la constante de equilibrio deben escribirse en términos de temperatura como se muestra en la Ecuación\ ref {4} y\ ref {5}.
\[k=k_{0} \exp \left(\frac{E}{R}\left(\frac{1}{T_{0}}-\frac{1}{T}\right)\right) \label{4} \]
\[K_{C}=K_{C 1} \exp \left(\frac{\Delta H_{R X}}{R}\left(\frac{1}{T_{1}}-\frac{1}{T}\right)\right) \label{5} \]
donde
- \(k_0\)= constante de velocidad a\(T_0\)
- \(E\)= energía de activación
- \(R\)= constante de gas ideal
- \(T\)= temperatura
- \(K_{C1}\)=constante de equilbrio a\(T_1\)
- \(ΔH_{RX}\)= calor estándar de reacción
5. Estequiometría
La estequiometría se utiliza para expresar la concentración de una especie en términos de concentración del reactivo limitante. La ecuación estequiométrica depende de si la reacción ocurre en fase líquida o gaseosa. Si ocurre en fase gaseosa, se utilizan las Ecuaciones\ ref {6} y\ ref {7}. Para la fase líquida, ε se convierte en cero y la correlación se reduce a la Ecuación\ ref {8}. No hay término de presión incluido porque se supone que la caída de presión es insignificante, y la presión inicial es igual a la presión final.
\[C_{A}=C_{A o} \frac{(1-X)}{(1+\epsilon X)} \frac{T_{0}}{T} \label{6} \]
\[C_{B}=C_{A o} \frac{\left(\theta_{B}+\frac{b}{a} X\right)}{(1+\epsilon X)} \frac{T_{0}}{T} \label{7} \]
\[C_{A}=C_{A O} (1-X) \label{8} \]
\[C_{B}=C_{A o} \left(\theta_{B}+\frac{b}{a} X\right) \label{9} \]
donde
- \(ε= y_{Ao}^{*}\)(Coeficientes estequiométricos de productos - coeficientes de reactivos)
- \(y_{Ao}\)= fracción molar inicial de\(A\)
- \(θ_i\)= relación de moles iniciales (o concentración) de especies i a moles iniciales (o concentración) de\(A\)
6. Combinar
Se combinan la ecuación de diseño, la ley de tasas y las ecuaciones estequiométricas. Por ejemplo, supongamos que la reacción es irreversible, en fase líquida e isotérmica, con A puro entrando al reactor y tiene la ecuación combinada como se muestra a continuación.
\[\frac{d X}{d V}=\frac{k * C_{A 0}^{a}(1-X)^{a}}{F_{A 0}} \label{10} \]
7. Balance Energético
El balance energético se puede utilizar para relacionar la temperatura y la conversión. Se supone que el flujo de calor y el trabajo del eje no están presentes.
\[T=\frac{X\left(-\Delta H_{R X}\right)+\Sigma \Theta_{i} C_{p i} T_{o}+X \Delta C_{p} T_{r}}{\Sigma \Theta_{i} C_{p i}+X \Delta C_{p}} \label{11} \]
con
- C pi = capacidad calorífica de las especies i
- Δ Cp = Cp productos- Cp reactivos
Si\(ΔC_p= 0\), los balances energéticos se reducen a lo siguiente:
\[T=\frac{X\left(-\Delta H_{R X}\right)+\Sigma \Theta_{i} C_{p i} T_{o}}{\Sigma \Theta_{i} C_{p i}} \label{12} \]
8. Resolver
Resolver el sistema de ecuaciones en Excel. La ODE se aproxima por el método de Euler. Consulte la hoja de cálculo adjunta para el modelado OD/Excel del PFR adiabático.
Una planta en la ETF (Equipment Testing Facility) ha sido adquirida en una toma hostil por parte de Brown Industries, empresa de la que usted es ingeniero de procesos. El Gerente de Ingeniería, Phil Savage, le ha asignado trabajar en un PFR ubicado dentro de esta nueva planta. El PFR particular en cuestión se utiliza para llevar a cabo la siguiente reacción:
\[\ce{A -> B} \nonumber \]
Quiere que le proporciones dos datos. En primer lugar, desea saber hasta qué punto debe llegar la reacción en el reactor para lograr una conversión del 80%. En segundo lugar, quiere saber la temperatura en este punto.
Usted decide que primero lo mejor sería determinar todas las propiedades termodinámicas y cinéticas que son inherentes a esta reacción. Sin embargo, en lugar de buscarlos en los libros de Perry o en tus viejos libros de ChMe, decides preguntarle al Ingeniero Principal de Plantas, Pablo LaSalle. Pablo te dice lo siguiente:
“Escucha sabiamente lo que digo, joven saltamontes. Esta reacción es irreversible, en fase líquida y elemental. Alimentaremos los reactivos al reactor tubular de 50 cm de diámetro a 273 K. Comenzaremos con una concentración inicial de A a 1.6 mol/L y un caudal molar inicial de A a 2 mol/min. El calor de reacción a 300 K es -20 kJ/mol A. La constante de velocidad a 300K es 0.2 mol/L * min. La energía de activación a 300K es de 15.2 kJ/mol. Los valores de Cp para los productos y reactivos son los siguientes.
- Cp A = 200 J/mol K
- Cp B = 100 J/mol K
“Ve y usa la hoja de Excel que el Grupo B ha creado y tu trabajo va a ser muy fácil”.
Solución
El modelo para este ejemplo se puede encontrar aquí.
Pablo dio todos los datos necesarios para completar el modelo. Después de introducir los datos, se utilizó la página final de la hoja de cálculo para determinar las condiciones del reactor que Savage deseaba.
X = 0.8 a una longitud de reactor de 33.4 metros. La temperatura en este punto del reactor es 388.4K
Acabas de completar tu iniciación en la sociedad de élite ultra súper secreta conocida como la Liga de Ingenieros Químicos que tiene su sede en lo alto de los Himalayos. Tienen en su poder un PFR adiabático (diámetro = 10cm) que utilizan para producir dos gases, conocidos como B y C, a partir de un reactivo en fase gaseosa conocido como A. La reacción gaseosa reversible se muestra a continuación:
\[ \ce{ A <=-> B + C} \nonumber \]
Su sensei desea saber cuál es la conversión máxima posible y también qué longitud de reactor se necesitaría para alcanzar una conversión del 15%. Primero, sin embargo, te ordena escalar K2 donde los datos de reacción son almacenados por la sociedad. Después de un viaje de 5 días peligrosos, descubre la siguiente información:
- Cp A = 40 kJ/mol K
- Cp B = 25 kJ/mol K
- Cp C = 15 kJ/mol K
- C AO = 0.271 mol/L
- F AO = 5 mol/min
- Temp Inicial = 450K
- Calor de reacción a 300K = -20 kJ/mol A
- Energía de activación = 31.4 kJ/mol
- K eq a 300K = 0.01 mol/L
- k_forward a 300K = 0.133 mol/(L*min)
Solución
Después de rebajar por K2, y encontrar una computadora, los datos obtenidos pueden ser ingresados en el modelo adiabático. La solución se puede encontrar aquí.
Asegúrese de establecer los valores tanto para la reacción en fase gaseosa como para la reacción reversible en 1.
Utilizando la tabla de datos que se encuentra en la última página de la hoja de cálculo, se puede extraer la información deseada.
La conversión máxima que se puede lograr es X = 0.187
El reactor requiere 64.8 metros para lograr una conversión del 15%.
Referencias
Fogler, H. Scott. Elementos de Ingeniería de Reacciones Químicas. Pearson Education, Inc., 2006.
Colaboradores y Atribuciones
- Brian McQuillan, Crystal Miranda, Brandon Quigley y John Zhang


