2.2: Sistemas de componentes puros
- Page ID
- 81677
Comencemos con un conocido sistema de un solo componente: el agua, la sustancia más abundante en la tierra. ¿Cuál es el comportamiento del agua bajo diferentes condiciones de presión y temperatura? O aún más específico, ¿hay una sola respuesta a la pregunta: ¿cuál es el punto de ebullición del agua? La mayoría de la gente diría, “claro, 100 °C”, pero una respuesta más precisa plantearía una pregunta aclaradora: “¿A qué presión?” Es de conocimiento común que el agua hierve a 100 °C (212 °F) a presión atmosférica. Al requerir una especificación de presión para definir de manera única el punto de ebullición del agua, estamos reconociendo que la temperatura de ebullición de una sustancia pura depende de la presión. En realidad, también estamos aplicando implícitamente un principio termodinámico muy útil, la Regla Gibbs, pero este será el tema para su posterior discusión.
En termodinámica, nos referimos al Punto de Ebullición Normal como la temperatura de ebullición de un fluido a 1 atm de presión (es decir, presión atmosférica). Por lo tanto, 100 °C (212 °F) es el punto de ebullición normal del agua.
¿Y si queremos comunicar esta idea? Nos gustaría comunicar el concepto de que la temperatura a la que hierve el agua varía con la presión. ¿Qué pasa con una imagen para representar esta información? Aquí está nuestro primer diagrama de fases, Figura 2.2.1. Mientras que pueden requerirse varias oraciones para describir la variabilidad del punto de ebullición del agua, la línea única que se muestra en la Figura 2.2.1 es adecuada. ¿Qué nos dice la Figura 2.2.1? Nos dice que la temperatura de ebullición de un líquido aumenta a medida que aumenta la presión. Es decir, dice que la presión de vapor de un líquido aumenta a medida que aumenta la temperatura. Eso es de esperar porque a medida que aumenta la temperatura, más moléculas líquidas son capaces de escapar a la fase de vapor, aumentando así la presión que el agregado de todas las moléculas de vapor ejerce sobre el sistema (es decir, la presión de vapor).
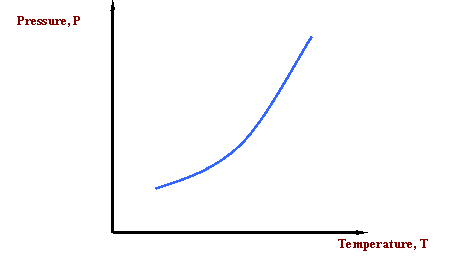
La curva en la Figura 2.2.1 se denomina curva de presión de vapor o curva de punto de ebullición. La línea también representa la curva del punto de rocío y la curva de punto de burbuja; una encima de la otra. Esta curva representa la transición entre los estados vapor y líquido.
Definición de Términos Básicos
Presión de Vapor: La presión que ejerce la fase de vapor de un fluido sobre su propio líquido en equilibrio a una temperatura dada.
Punto de Rocío: La condición de presión y temperatura en la que existe una cantidad infinitesimal de líquido (una gotita) en equilibrio con el vapor. Representa la condición de formación de líquido incipiente en un sistema inicialmente gaseoso. Observe que también se puede visualizar como un “sistema líquido” donde se ha vaporizado todo menos una cantidad infinitesimal de líquido.
Punto de Burbuja: La condición de presión y temperatura en la que el sistema es todo líquido, y en equilibrio con una cantidad infinitesimal (una burbuja) de gas. Esta situación es, en esencia, la opuesta a la del punto de rocío.
Nota:
Para sistemas de un solo componente, una sola curva representa las tres condiciones (presión de vapor, punto de rocío y condiciones de punto de burbuja) simplemente porque Presión de Vapor = Punto de Rocío = Punto de Burbuja para sistemas unarios.
En la Figura 2.2.1, una vez que se ha seleccionado una presión de saturación, hay una (y sólo una) temperatura de saturación asociada a ella. Esto solo es cierto para un sistema de un solo componente. En otras palabras, esta es la única temperatura (a la presión dada), a la que coexistirán en equilibrio la fase líquida y gaseosa. La regla que rige la singularidad de este punto, para un sistema de un solo componente, se llama la Regla de Fase Gibbs. Esta es la segunda vez que mencionamos esta regla, señalando su gran importancia en el comportamiento de fase. Pospongamos cualquier discusión detallada de la Regla de Fase Gibbs hasta más tarde.
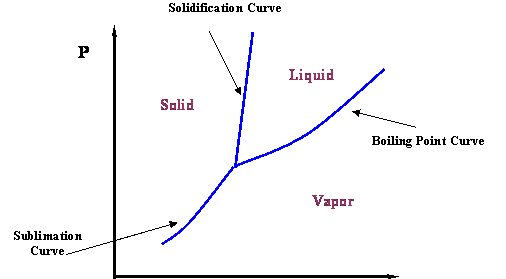
La curva de vapor, mostrada en la Figura 2.2.1, representa la transición entre los estados vapor y líquido para un componente puro. Obviamente, esta no es toda la historia. Si enfriamos el sistema líquido, tiene sentido esperar que se forme hielo (una fase sólida). Podemos comunicar esta nueva idea agregando más información a la Figura 2.2.1. De hecho, existe una línea que define la transición líquido-sólido; se denomina curva de solidificación (o fusión) (ver Figura 2.2.2). Además, aunque sea contrario a la intuición, es posible pasar de sólido a vapor sin pasar por un estado líquido, si la presión es lo suficientemente baja. Esta información se puede agregar al diagrama incluyendo la curva de sublimación. Así, la Figura 2.2.2 representa un diagrama de fases más completo para un sistema de componentes puros.
Vea cómo se puede representar más y más información dentro de los límites del diagrama de fases. Como ingenieros de petróleo y gas natural, enfocamos nuestra atención en la Curva de Punto de Elición, ya que representa la transición entre líquido y gas, las fases con las que tratamos con mayor frecuencia. Centremos nuestra atención en ello.
La Figura 2.2.3 presenta un diagrama P-T que representa la curva de presión de vapor y sus extremidades. Dos puntos termodinámicos muy importantes unen la curva de presión de vapor: el Punto Crítico en su extremo superior y el Punto Triple en su extremo inferior.
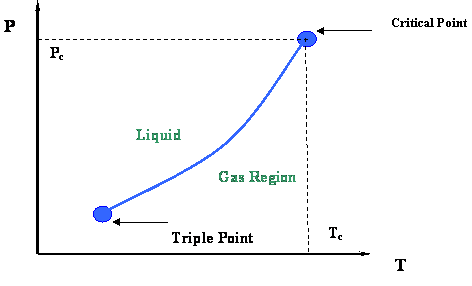
El Punto Triple es el punto de encuentro de las curvas de presión de vapor, solidificación y sublimación (ver Figura 2.2.2); de ahí que representa la única condición en la que las tres fases de una sustancia pura (sólida, líquida y gaseosa) pueden coexistir en equilibrio.
En el Punto Crítico, el gas y el líquido están en equilibrio sin ninguna interfaz para diferenciarlos; ya no son distinguibles en términos de sus propiedades. Como recordamos, la única ubicación en el diagrama P-T donde el líquido y el gas pueden encontrarse juntos en equilibrio es a lo largo de la curva de presión de vapor. Por lo tanto, el punto crítico es claramente el valor máximo de temperatura y presión a los que el líquido y el vapor pueden estar en equilibrio. Esta temperatura máxima se denomina temperatura crítica (T c); la presión máxima correspondiente se denomina presión crítica (P c).
Concluyamos este primer módulo destacando las propiedades más importantes del punto crítico de las sustancias puras, como se muestra a continuación. El siguiente módulo estará brindando más detalles de interés que están incrustados en la Figura 2.2.3.
Propiedades Del Punto Crítico (T c, P c) (Para Sustancias Puras):
- Temperatura y presión para las cuales el líquido y el vapor ya no son distinguibles.
- Para T > T c, el líquido y el vapor no coexistirán, sin importar cuál sea la presión.
- Para P > P c, el líquido y el vapor no coexistirán, sin importar cuál sea la temperatura.


