4.1: Sistemas binarios
- Page ID
- 81480
Hasta ahora, hemos centrado nuestra atención en sistemas de un solo componente (también llamados sistemas unarios, de un componente o de componentes puros). Sin embargo, los sistemas de la vida real nunca son de un solo componente; son sistemas multicomponentes. El más simple de esta categoría es el sistema binario. La buena noticia, sin embargo, es que el comportamiento de los sistemas multicomponentes es bastante similar al de los sistemas binarios. Por lo tanto, nos centraremos en los sistemas binarios, ya que son más fáciles de ilustrar.
Coloquemos dos gases (A y B) en una celda isotérmica. Como hicimos antes, mantendremos la temperatura constante durante este experimento (mostrado en la Fig. 4.1.1)
Si movemos el pistón hacia abajo, comprimiríamos los gases, provocando una disminución en el volumen. En tal escenario, se produciría un aumento en la presión. El proceso inicia en el punto A, como se muestra en la Figura 4.1.2, una condición de todo vapor.
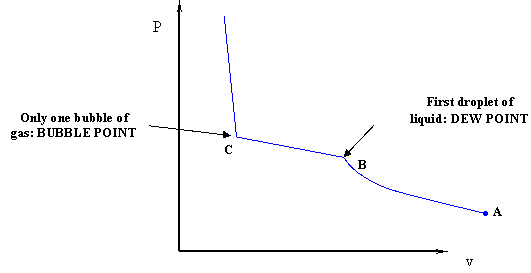
Aquí nada es nuevo en cuanto a la compresión del vapor mismo. A medida que aumenta la presión, el volumen disminuye en consecuencia. Después de cierta compresión, aparecerá la primera gotita de líquido. Es decir, hemos encontrado el punto de rocío de la mezcla (punto B). Luego procedemos con la compresión. A medida que comprimimos aún más el sistema, aparecerá más líquido y el volumen seguirá disminuyendo.
Parecería que estamos viendo aquí las mismas características que las del sistema de un solo componente que estudiamos en los módulos anteriores. Pero espera un minuto, ¿es así?
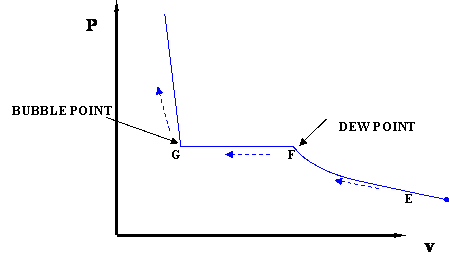
En realidad, hay una diferencia. Durante la transición de fase, la presión no permanece constante en este experimento. De hecho, a medida que avanza la compresión y se forma más líquido, la presión sigue aumentando, aunque no tan bruscamente como en la región de vapor monofásico. Cuando todo el sistema se ha vuelto líquido, con solo una burbuja infinitesimal de vapor que queda, estamos en el punto C, el punto de burbuja de la mezcla. Tenga en cuenta que, para las mezclas binarias (como es el caso de las mezclas multicomponentes) el punto de rocío y el punto de burbuja no ocurren a la misma presión para la compresión isotérmica. Si recuerda, para el sistema de un solo componente, el punto de rocío y el punto de burbuja coinciden. Esto no es cierto para los sistemas binarios y multicomponentes. Compare la Figura 4.1.2 con la Figura 3.2.4 (repetida a continuación desde el Módulo 3) para ver este punto.

¿POR QUÉ? ¿Por qué aumenta la presión durante la transición de fase? En este punto, comenzamos a darnos cuenta de las formas en que la composición juega un papel fundamental en el comportamiento de las mezclas.
En un sistema de un solo componente, tanto el líquido como el vapor en la región bifásica tienen la misma composición (solo hay una sustancia química dentro del sistema). Ahora, cuando existe una mezcla en una condición de dos fases, diferentes moléculas de diferentes especies están presentes y pueden estar en estado líquido o vapor (condición de dos fases). Algunos de ellos “preferirían” estar en fase gaseosa mientras que los otros “preferirían” estar en fase líquida. Esta “preferencia” está controlada por la volatilidad del componente dado. Cuando alcanzamos el punto B (Figura 4.1.2) y aparece la primera gotita de líquido, las moléculas más pesadas son las que preferentemente van a esa primera pequeña gotita de fase líquida. Para las moléculas 'pesadas', dada la elección, es más deseable estar en el estado condensado.
A medida que seguimos formando más líquido (por compresión), principalmente las moléculas ligeras permanecen en la fase de vapor. Sin embargo, en el punto final de la transición (punto C en la Figura 4.1.2) los hemos forzado a todos a pasar al estado líquido —ya no tienen opción. Esta aplicación requiere mayor presión. Si compara una muestra de líquido en condiciones de punto de rocío (punto B en la Figura 4.1.2) con una tomada en medio de la transición, es claro que la primera sería más rica en componentes pesados que la segunda. Las propiedades del componente más pesado serían más influyentes en el punto de rocío (cuando aparece el líquido por primera vez); mientras que las propiedades del componente más ligero serían más influyentes en el punto de burbuja (cuando la última burbuja está a punto de desaparecer).
En la región bifásica, la presión aumenta a medida que el sistema pasa del punto de rocío al punto de burbuja. La composición del líquido y el vapor está cambiando; pero — ¡cuidado! — ¡la composición general es siempre la misma! En el punto de rocío, la composición del vapor es igual a la composición general del sistema; sin embargo, la cantidad infinitesimal de líquido que se condensa es más rica en el componente menos volátil. En el punto de burbuja, la composición del líquido es igual a la del sistema, pero la cantidad infinitesimal de vapor que queda en el punto de burbuja es más rica en el componente más volátil que el sistema en su conjunto.
En general, cuando se mezclan dos especies diferentes, algunos de los comportamientos de las especies individuales y sus propiedades cambiarán. Su comportamiento habitual (como componentes puros) se verá alterado como consecuencia del nuevo campo de interacciones moleculares que se ha creado. Si bien se mantienen en estado puro, las moléculas solo interactúan con moléculas similares. Por otro lado, en una mezcla se producen nuevas interacciones entre moléculas disímiles.
Nuestro siguiente paso, para continuar esta discusión de manera coherente, es dibujar el diagrama P-V completo para esta mezcla binaria delineando la región bifásica. De la misma manera que lo hicimos anteriormente, delineamos la región bifásica dibujando una familia completa de isotermas en el diagrama P-V. La Figura 4.1.3 ilustra esto.
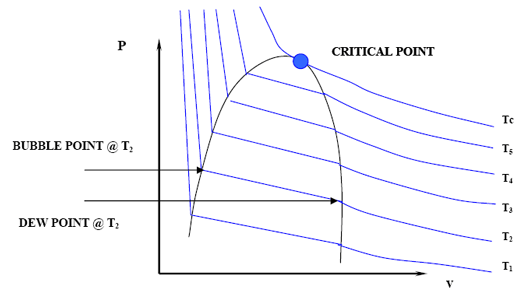
Nuevamente, la línea que conecta todos los puntos de burbuja y rocío generará la curva de burbuja y punto de rocío, los cuales se encuentran en el punto crítico. Observe que el punto crítico no representa un máximo en el diagrama P-V de una mezcla. También tenga en cuenta que las presiones del punto de burbuja y las presiones del punto de rocío ya no son las mismas
Nuevamente, las isotermas a través de la región bifásica no son horizontales sino que tienen una pendiente definida. Esto debe tener una implicación. De hecho, lo hace. ¿Y si ahora queremos trazar el diagrama P-T para esta mezcla? ¿Tendremos una sola línea, donde las curvas de burbuja y punto de rocío se encuentran una encima de la otra, como teníamos para un sistema de un solo componente? Por supuesto que no. En lugar de que ambas curvas estén juntas, la curva del punto de burbuja se desplazará hacia la parte superior izquierda (presiones más altas) y la curva del punto de rocío se desplazará hacia la parte inferior derecha (presiones más bajas), ambas reuniéndose en el punto crítico. La Figura 4.1.4 nos muestra una envoltura de fase típica para una mezcla.
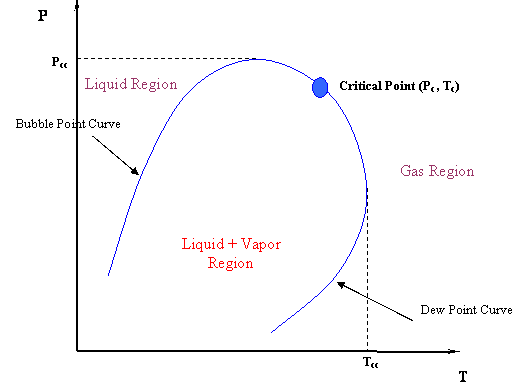
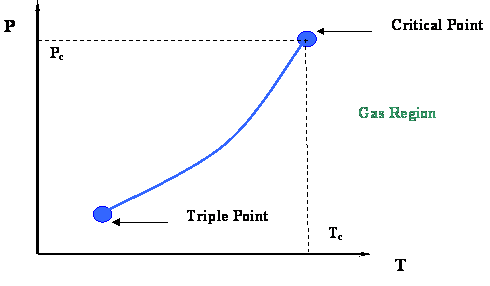
Observe la enorme diferencia entre la curva P-T de un sistema multicomponente (sistema binario en este caso, Fig. 4.1.4) y la curva P-T de un componente puro (simple) (Fig. 3.1.1 del Módulo 3, repetido a continuación). El único sistema para el que la curva de punto de burbuja coincidirá con la curva de punto de rocío es un sistema de un solo componente, donde tenemos una sola línea para el diagrama P-T (por ejemplo, la curva de punto de ebullición representada en la Fig. 3.1.1). En la Fig 3.1.1, el punto crítico representa el conjunto máximo de valores (P, T) que podrías encontrar en la gráfica P-T.
Esto no es todo. Hay algunas otras implicaciones. ¿Podemos decir ahora que el punto crítico es el valor máximo de presión y temperatura donde pueden coexistir líquido y gas? Mire nuevamente la Figura 4.1.4. Obviamente no. El punto crítico ya no está en el ápice o pico de la región bifásica; por lo tanto, vapor y líquido pueden coexistir en equilibrio a T > T c y P > P c. De hecho, podemos identificar dos nuevos máximos: la condición P cc es la presión máxima y la condición T cc es la temperatura máxima a la que L+V se encontrará en equilibrio. Asignamos nombres especiales a estos puntos. Están el cricondenbar y el cricondentherm, respectivamente.
Claramente, la única definición que ahora aún puede sostenerse para el punto crítico —tanto para mezclas como para componentes puros— es la que se muestra a continuación.
Punto crítico (P c, T c):
La temperatura y presión para las cuales el líquido y el vapor son indistinguibles.
Nuevamente, esta definición es aplicable tanto para mezclas como para sistemas de componentes puros; no hace referencia alguna a valores máximos en la curva. Estos valores máximos, como decíamos, tienen nombres especiales en el caso de las mezclas. Así, para las mezclas, tenemos que definir adicionalmente:
Cricondentherm (T cc):
- La temperatura más alta en la envolvente bifásica.
- Para T > T cc, el líquido y el vapor no pueden coexistir en equilibrio, no importa cuál sea la presión.
Cricondenbar (P cc):
- La presión más alta en la envolvente bifásica.
- Para P > P cc, el líquido y el vapor no pueden coexistir en equilibrio, no importa cuál sea la temperatura.
En el caso del sistema unario, además de las curvas de punto de rocío y burbuja que se encuentran una encima de la otra, es claro que cricondentherm, cricondenbar, y las condiciones críticas también están representadas por un solo punto (es decir, el punto crítico en sí). Esto queda claro a partir de las tres definiciones anteriores. Así, como vimos antes, la definición de punto crítico en sistemas unarios abarca las tres definiciones dadas anteriormente.
Solo para sustancias puras:
Cricondentherm = Cricondenbar = Punto Crítico.


