7.4: La ecuación de van der Waals
- Page ID
- 81605
A pesar de que van der Waals EOS (VdW EOS) existe desde hace más de cien años, todavía reconocemos los logros de van der Waals como cruciales para revolucionar nuestro pensamiento sobre EOS. Hablamos de VdW EOS por razones pedagógicas, no porque encuentre alguna aplicación práctica en el mundo actual. De hecho, VdW EOS no se utiliza para ningún propósito práctico de diseño. Sin embargo, la mayoría de las EOS que se utilizan ampliamente hoy en día con fines de diseño práctico se han derivado de VdW EOS.
Las contribuciones de VdW EOS se pueden resumir de la siguiente manera:
- Mejoró radicalmente la capacidad predictiva sobre la EOS de gas ideal,
- Fue el primero en predecir la continuidad de la materia entre gas y líquido,
- Formuló el Principio de Estados Correspondientes (PCS),
- Puso las bases para la EOS cúbica moderna.
En su tesis doctoral en 1873, van der Waals propuso eliminar semiempíricamente las principales “debilidades” clave que llevaba consigo la EOS ideal. Esencialmente, lo que hizo fue volver a mirar los supuestos básicos que subyacen a la EOS ideal, que hemos enumerado anteriormente.
VdW representó el volumen molecular distinto de cero y la fuerza de atracción distinta de cero de una sustancia real. Se dio cuenta de que hay un punto en el que no se puede descuidar el volumen que ocupan las moléculas. Una de las primeras cosas que VdW reconoció es que las moléculas deben tener un volumen finito, y ese volumen debe restarse del volumen del contenedor. Al mismo tiempo, modificó el término de presión para reconocer el hecho de que las moléculas sí interactúan entre sí a través de fuerzas cohesivas. Estos son los dos principales reconocimientos valiosos que introdujo.
La EOS ideal afirma:
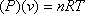 (7.5)
(7.5)
o,
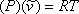 (7.6)
(7.6)
donde representan el volumen molar (
representan el volumen molar ( ) de la sustancia.
) de la sustancia.
VdW centró su atención en modificar los términos “P” y “v” en la ley original del gas ideal introduciendo una corrección apropiada. Mirando hacia atrás a la desigualdad de la ecuación (6.4) en el Módulo 6, VdW propuso que la diferencia de ambas presiones es el resultado de las fuerzas de atracción —fuerzas cohesivas— desatendidas en el modelo ideal (ecuación 7.6) y así,
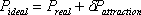 (7.7)
(7.7)
En este punto, VdW postuló el término ΔPatTraction, una función inversa de la distancia media entre moléculas, siendo esto una consecuencia directa de la ley de Newton de las fuerzas de atracción inercial, F α (distancia) -2. Reconociendo que el volumen del gas es una medida de la distancia media entre las moléculas (cuanto menor es el volumen, más cerca están las moléculas y viceversa),
(7.8)
y utilizando “a” como constante de proporcionalidad,
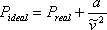 (7.9)
(7.9)
A continuación, VdW se ocupó de la desigualdad en la ecuación (6.5) (ver Módulo 6). Cualquier partícula ocupa un espacio físico; de ahí que el espacio disponible para el gas sea menor que el volumen total de su contenedor. Digamos que podemos determinar experimentalmente el espacio físico real que ocupan todas las moléculas del contenedor, y que lo llamamos “b”, o el covolumen. VdW propuso entonces:
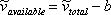 (7.10)
(7.10)
La inclusión de un parámetro “b” (co-volumen) reconoce el papel de las fuerzas repulsivas. Las fuerzas repulsivas evitan que las moléculas se “destruyan” unas a otras al no dejar que se acerquen demasiado. En estado condensado, existe una “cercanía” máxima permisible entre las moléculas. Por lo tanto, es por fuerzas repulsivas que no podemos comprimir el volumen de un fluido más allá de su valor de co-volumen “b”. Si las moléculas se acercan demasiado entre sí, las fuerzas de repulsión toman el relevo para evitar su autodestrucción.
En resumen, VdW propuso corregir los términos de presión y volumen del modelo ideal representado por la ecuación (7.6). La “nueva” ecuación de estado ideal modificada se convierte en:
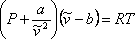 (7.11a)
(7.11a)
o,
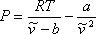 (7.11b)
(7.11b)
donde:
P = presión absoluta
v = volumen molar
T = temperatura absoluta
R = constante de gas universal
La ecuación (7.11b) demuestra que VdW EOS es explícito en presión. En esta etapa es importante recalcar que cualquier predicción para a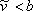 partir de ecuaciones (7.11) carece de sentido debido a la significación física que hemos adjuntado a este parámetro. Como todos los demás parámetros son constantes, las ecuaciones (7.11) son relaciones funcionales de las variables P, T y
partir de ecuaciones (7.11) carece de sentido debido a la significación física que hemos adjuntado a este parámetro. Como todos los demás parámetros son constantes, las ecuaciones (7.11) son relaciones funcionales de las variables P, T y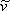 :
:
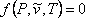 (7.12)
(7.12)
Por lo tanto, la ecuación (7.11a) expresa una relación PVT y por lo tanto, es una ecuación de estado. En esta ecuación, “a” y “b” son constantes que son específicas de cada componente. Sin embargo, el valor numérico de “R” depende del sistema de unidades elegidas, como ya comentamos anteriormente.
Es hora de hacernos una pregunta muy importante:
¿Cómo calculamos “a” y “b” para cada sustancia?
Como se puede deducir de sus definiciones, “a” y “b” son diferentes para diferentes sustancias; es decir,
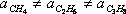 ;
;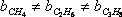
¿Cómo relacionamos “a” y “b” con las propiedades físicas conocidas y fácilmente obtenibles de las sustancias?
Resulta que hay un conjunto de condiciones llamadas condiciones de criticidad que deben cumplirse para todos los sistemas, siempre que esos sistemas cumplan con la 2ª ley de la termodinámica. En efecto, en el capítulo anterior reconocimos que la isoterma crítica de una sustancia pura tiene un punto de inflexión (cambio de curvatura) en el punto crítico. Además, reconocimos que el punto crítico es el punto máximo (vértice) de la envolvente P-V. Esta condición de inflexión horizontal de la isoterma crítica en el punto crítico es impuesta matemáticamente por la expresión:
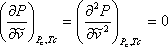 (7.13)
(7.13)
Estas condiciones se llaman las condiciones de criticidad. Resulta que cuando se imponen estas condiciones a la ecuación (7.11a), se pueden derivar expresiones para los parámetros “a” y “b” en función de las propiedades críticas de la siguiente manera:
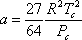 (7.14a)
(7.14a)
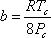 (7.14b)
(7.14b)
Tal vez quieras probar esto como un ejercicio. “a” y “b” pueden por lo tanto conocerse porque son funciones de propiedades conocidas (tabuladas) de todas las sustancias de interés (presión crítica y temperatura.)
Hasta el momento, hemos aplicado VdW EOS a componentes puros. ¿Podemos extrapolar esto para aplicarlo a sistemas multicomponentes?
Para extender este concepto a un sistema de más de un componente, utilizamos lo que se llama regla de mezcla. Una regla de mezcla relaciona los parámetros que caracterizan la mezcla (a m y b m) con las contribuciones individuales de los componentes puros que componen esa mezcla (a i y b i)
¿Cómo hacemos esto? VdW propuso ponderar las contribuciones de cada componente usando sus composiciones molares, de la siguiente manera:
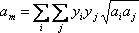 (7.15a)
(7.15a)
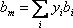 (7.15b)
(7.15b)
A la primera se le llama la regla de mezcla cuadrática, mientras que a la segunda se le conoce como la regla de mezcla lineal.
Colaboradores y Atribuciones
Michael Adewumi (The Pennsylvania State University) Vice Provost for Global Program, Professor of Petroleum and Natural Gas Engineering


