21.2: El problema de los hidratos
- Page ID
- 81547
Los hidratos de gas natural son compuestos cristalinos sólidos de apariencia de nieve con densidades menores que la del hielo. Los hidratos de gas natural se forman cuando los componentes de gas natural, por ejemplo metano, etano, propano, isobuteno, sulfuro de hidrógeno, dióxido de carbono y nitrógeno, ocupan posiciones de celosía vacías en la estructura del agua. En este caso, parece que el agua se solidifica a temperaturas considerablemente superiores al punto de congelación del agua.
Los hidratos de gas constituyen una solución sólida, siendo el gas el soluto y el agua el disolvente, donde los dos componentes principales no están químicamente enlazados. La Figura 21.2 presenta un diagrama de fases típico para una mezcla de agua con un hidrocarburo ligero y puro (HC), similar al presentado por McCain (1990).
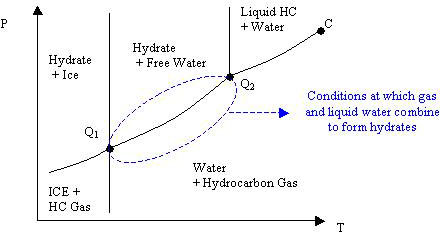
Hay una serie de puntos en el diagrama de la Figura 21.2 que son dignos de mención. En primer lugar, la formación de hidratos se ve claramente favorecida por la baja temperatura y la alta presión. El punto crítico trifásico es el punto C en el diagrama que representa la condición donde el hidrocarburo líquido y gas se funden en una sola fase hidrocarbonada en equilibrio con el agua líquida. El punto Q 2 es el punto cuádruple superior, donde se encuentran en equilibrio cuatro fases (agua líquida, hidrocarburo líquido, hidrocarburo gaseoso e hidrato sólido). El punto Q 1, el punto cuádruple inferior, generalmente ocurre a 32 °F (punto de congelación del hielo) donde cuatro fases (hielo, hidrato, agua líquida y gas hidrocarburo) se encuentran en equilibrio. En este contexto, las fases no son puras ya que contienen alguna cantidad de las otras sustancias según su solubilidad mutua.
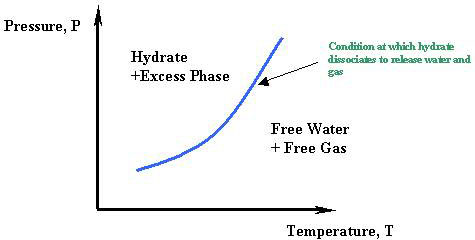
Para aplicaciones prácticas, la línea de equilibrio más importante es el segmento Q 1 Q 2. Representa las condiciones para la formación o disociación de hidratos, una pieza crítica de información para la mayoría de las aplicaciones industriales donde están involucrados los hidratos. Cuando nos enfocamos en esta zona, el comportamiento de fase del sistema agua/hidrocarburo se simplifica a los esquemas mostrados en la Figura 21.3.
La termodinámica de Comportamiento de Fase se suele invocar para la predicción de la línea de formación/disociación de hidrato Q1Q2. Los dos primeros métodos de predicción fueron propuestos por Katz y sus compañeros de trabajo, y se conocen como el Método de la Gravedad del Gas (Katz, 1945) y el Método del valor K i (Carson y Katz, 1942). Ambos métodos permiten calcular las curvas de equilibrio P-T para tres fases: agua líquida, hidrato y gas natural. Estos métodos producen estimaciones iniciales para el cálculo y proporcionan una comprensión cualitativa del equilibrio; siendo este último método el más preciso de los dos. El tercer método se basa en la Mecánica Estadística para la predicción del equilibrio. Es reconocido como el más preciso de todos los cálculos trifásicos ya que es más completo y detallado.
Las circunstancias clave que son esenciales para la formación de hidratos se pueden resumir como:
- Presencia de agua “libre”. No es posible la formación de hidratos si no hay agua “libre” presente. Aquí, entendemos la importancia de la eliminación del vapor de agua del gas natural, de manera que en caso de ocurrencia de agua libre existe probabilidad de formación de hidratos.
- Temperaturas bajas, a o por debajo de la temperatura de formación del hidrato para una presión y composición de gas dadas.
- Altas presiones de operación.
- Las altas velocidades, o agitación, o pulsaciones de presión, en otras palabras, la turbulencia puede servir como catalizador.
- La presencia de H 2 S y CO 2 promueve la formación de hidratos porque ambos gases ácidos son más solubles en agua que los hidrocarburos.
El mejor y permanente remedio para los problemas de formación de hidratos es la deshidratación del gas. En ocasiones, es muy posible que se formen hidratos en el sitio del pozo o en la tubería transportando gas natural a la unidad de deshidratación, de manera que surge la necesidad de técnicas de cabeza de pozo. En el sitio del pozo, son apropiadas dos técnicas:
- Calentar la corriente de gas y mantener las líneas de flujo y el equipo a una temperatura superior al punto de hidrato,
- En los casos en los que el agua líquida está presente y las líneas de flujo y el equipo no pueden mantenerse por encima de la temperatura del hidrato, inhibiendo la formación de hidratos inyectando aditivos que deprimen tanto las temperaturas hidratadas
Los aditivos más comunes son metanol, etilenglicol y dietilenglicol. La inyección de metanol es muy beneficiosa en los casos en los que un bajo volumen de gas no permite el procesamiento de deshidratación. También es extremadamente útil en casos donde los problemas de hidratos son relativamente leves, poco frecuentes o periódicos, en los casos en que la inyección de inhibidor es solo una fase temporal en el programa de desarrollo de campo, o donde la inhibición se realiza en conjunto con un sistema de deshidratación primaria.
Colaboradores y Atribuciones
Michael Adewumi (The Pennsylvania State University) Vice Provost for Global Program, Professor of Petroleum and Natural Gas Engineering


