4.1: Escribiendo y balanceando las ecuaciones químicas
- Page ID
- 1818
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Habilidades para desarrollar
- Derivar ecuaciones químicas usando descripciones narrativas de las reacciones químicas.
- Escribir y balancear las ecuaciones químicas en formatos moleculares, iónicos totales y iónicos netos.
El capítulo anterior introdujo el uso de símbolos de elementos para representar átomos individuales. Cuando los átomos ganan o pierden electrones para producir iones, o se combinan con otros átomos para formar moléculas, sus símbolos se modifican o combinan para generar fórmulas químicas que representan estas especies adecuadamente. Extender este simbolismo para representar ambas las identidades como las cantidades relativas de las sustancias que experimentan un cambio químico (o físico) involucra escribiendo y balanceando una ecuación química. Considere como un ejemplo la reacción entre una molécula de metano (CH4) y dos moléculas de oxígeno diatómico (O2) para producir una molécula de dióxido de carbono (CO2) y dos moléculas de agua (H2O). La ecuación química que representa este proceso se da en la mitad superior de la Figura \(\PageIndex{1}\), con modelos moleculares de relleno de espacio que se muestran en la mitad inferior de la figura.
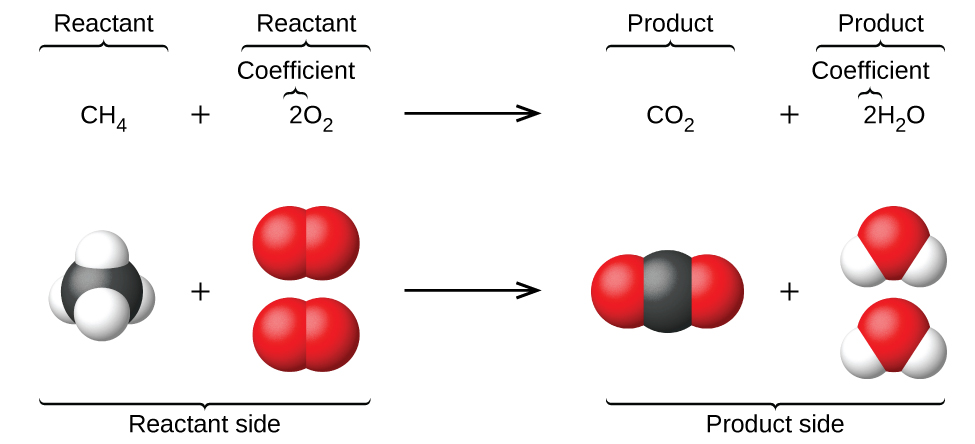
Este ejemplo ilustra los aspectos fundamentales de cualquier ecuación química:
- Las sustancias que experimentan la reacción se llaman los reactivos y sus fórmulas se colocan en el lado izquierdo de la ecuación.
- Las sustancias generadas por la reacción se llaman los productos, y sus fórmulas se colocan al lado derecho de la ecuación.
- Los signos de más (+) separan las fórmulas individuales de los reactivos y de los productos, y una flecha (⟶) separa los lados de los reactivos y de los productos (izquierdo y derecho) de la ecuación.
- Los números relativos de reactivos y especies de productos están representados por coeficientes (números colocados inmediatamente a la izquierda de cada fórmula). Típicamente, un coeficiente de 1 se omite.
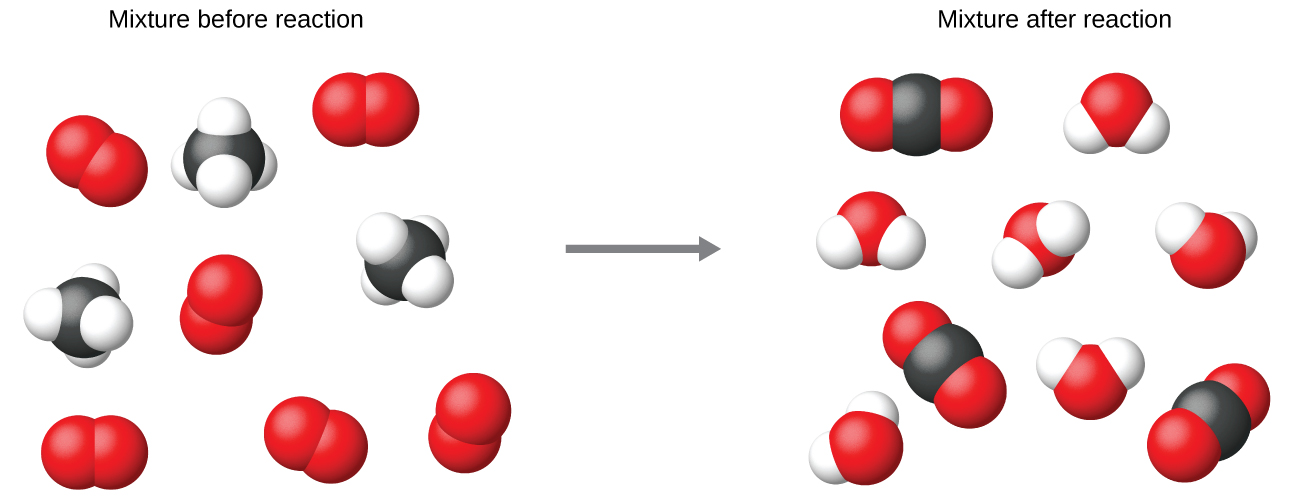
Usando los coeficientes de números enteros más pequeños posibles en una ecuación química es una práctica común, como se hace en este ejemplo. Tenga en cuenta, que estos coeficientes representan el número relativo de los reactivos y los productos, y, por lo tanto, se pueden interpretar correctamente como ratios. El metano y el oxígeno reaccionan para producir el dióxido de carbono y el agua en una proporción de 1: 2: 1: 2. Esta relación se satisface si los números de estas moléculas son, respectivamente, 1-2-1-2, o 2-4-2-4, o 3-6-3-6, y así sucesivamente (Figura \(\PageIndex{2}\)). Del mismo modo, estos coeficientes se pueden interpretar con respecto a cualquier unidad de cantidad (número), por eso esta ecuación se puede leer correctamente de muchas maneras, incluyendo:
- Una molécula del metano y dos moléculas del oxígeno reaccionan para producir una molécula del dióxido de carbono y dos moléculas del agua.
- Una docena de moléculas del metano y dos docenas de moléculas del oxígeno reaccionan para producir una docena de moléculas del dióxido de carbono y dos docenas de moléculas del agua.
- Un mol de moléculas del metano y 2 mol de moléculas del oxígeno reaccionan para producir 1 mol de moléculas de dióxido de carbono y 2 mol de moléculas del agua.
Balanceando las ecuaciones
Cuando una ecuación química está balanceada, significa que se representan números iguales de átomos para cada elemento involucrado en la reacción en los reactivos y los productos. Este es un requisito que la ecuación debe satisfacer para que sea consistente con la ley de conservación de la materia. Se puede confirmar por simplemente sumando los números de átomos en cada lado de la flecha y comparando estas sumas para asegurarse de que sean iguales. Tenga en cuenta que el número de átomos para un elemento dado se calcula por multiplicando el coeficiente de cualquier fórmula que contenga ese elemento por el subíndice del elemento en la fórmula. Si un elemento aparece en más de una fórmula en un lado de la ecuación, el número de átomos representados se debe calcular y luego se debe sumar. Por ejemplo, ambas especies de productos en la reacción de ejemplo, \(\ce{CO2}\) y \(\ce{H2O}\), contienen el elemento oxígeno y, por lo tanto, el número de átomos de oxígeno en el lado del producto de la ecuación es:
\[\left(1\: \cancel{\ce{CO_2} \: \text{molecule}} \times \dfrac{2\: \ce{O} \: \text{atoms}}{ \cancel{\ce{CO_2} \: \text{molecule}}}\right) + \left( \cancel{ \ce{2H_2O} \: \text{molecule} }\times \dfrac{1\: \ce{O}\: \text{atom}}{\cancel{ \ce{H_2O} \: \text{molecule}}}\right)=4\: \ce{O} \: \text{atoms}\]
La ecuación para la reacción entre el metano y el oxígeno para producir el dióxido de carbono y el agua se confirma a ser balanceada según este enfoque, como se muestra aquí:
\[\ce{CH4 +2O2\rightarrow CO2 +2H2O}\]
| Elemento | Reactivos | Productos | Balanceado? |
|---|---|---|---|
| C | 1 × 1 = 1 | 1 × 1 = 1 | 1 = 1, sí |
| H | 4 × 1 = 4 | 2 × 2 = 4 | 4 = 4, sí |
| O | 2 × 2 = 4 | (1 × 2) + (2 × 1) = 4 | 4 = 4, sí |
A veces, una ecuación química balanceada se puede derivar de una descripción cualitativa de alguna reacción química mediante un enfoque bastante simple conocido como el equilibrio por inspección. Por ejemplo, consideremos la descomposición del agua para producir el hidrógeno molecular y el oxígeno. Este proceso está representado cualitativamente por una ecuación química que no está balanceada:
\[\ce{H2O \rightarrow H2 + O2} \tag{unbalanced}\]
La comparación del número de átomos de H y O en cada lado de esta ecuación confirma que no está balanceada:
| Elemento | Reactivos | Productos | Balanceado? |
|---|---|---|---|
| H | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, sí |
| O | 1 × 1 = 1 | 1 × 2 = 2 | 1 ≠ 2, no |
Los números de átomos de H en los lados de los reactivos y los productos de la ecuación son iguales, pero los números de átomos de O no son. Para lograr el equilibrio, los coeficientes de la ecuación se pueden cambiar según sea necesario. Por supuesto, tenga en cuenta que los subíndices de la fórmula definen, en parte, la identidad de la sustancia, por eso no se pueden cambiar sin alterar el significado cualitativo de la ecuación. Por ejemplo, cambiar la fórmula del reactivo de H2O a H2O2 generaría un equilibrio en el número de átomos, pero al hacerlo también la identidad del reactivo se cambiaría (ahora es el peróxido de hidrógeno y no el agua). El equilibrio del átomo de O se puede lograr por cambiando el coeficiente de H2O a 2.
\[\ce{2H2O \rightarrow H2 + O2} \tag{unbalanced}\]
| Elemento | Reactivos | Productos | Balanceado? |
|---|---|---|---|
| H | 2 × 2 = 4 | 1 × 2 = 2 | 4 ≠ 2, no |
| O | 2 × 1 = 2 | 1 × 2 = 2 | 2 = 2, sí |
El cambio del átomo de H se vio afectado por este cambio, pero se restablece fácilmente cambiando el coeficiente para el producto H2 a 2.
\[\ce{2H_2O \rightarrow 2H2 + O2} \tag{balanced}\]
| Elemento | Reactivos | Productos | Balanceado? |
|---|---|---|---|
| H | 2 × 2 = 4 | 2 × 2 = 2 | 4 = 4, sí |
| O | 2 × 1 = 2 | 1 × 2 = 2 | 2 = 2, sí |
Estos coeficientes producen números iguales de átomos de H y de O en los lados de los reactivos y de los productos, y la ecuación balanceada es:
\[\ce{2H_2O \rightarrow 2H_2 + O_2}\]
Ejemplo \(\PageIndex{1}\): balanceando ECUACIONES QUÍMICAS
Escriba una ecuación balanceada para la reacción de nitrógeno molecular (N2) y oxígeno (O2) para formar pentóxido de dinitrógeno.
Solución
Primero, escriba la ecuación que no está balanceada.
\[\ce{N_2 + O_2 \rightarrow N_2O_5} \tag{unbalanced}\]
Luego, cuente el número de cada tipo de átomo presente en la ecuación que no está balanceada.
| Elemento | Reactivos | Productos | Balanceado? |
|---|---|---|---|
| N | 1 × 2 = 2 | 1 × 2 = 2 | 2 = 2, sí |
| O | 1 × 2 = 2 | 1 × 5 = 5 | 2 ≠ 5, no |
Aunque el nitrógeno está balanceado, se necesitan cambios en los coeficientes para balancear el número de átomos de oxígeno. Para balancear el número de átomos de oxígeno, un primer intento sería cambiar los coeficientes para el O2 y el N2O5 a números enteros que producirán 10 átomos de O (el mínimo común múltiplo para los subíndices de átomos de O en estas dos fórmulas).
\[\ce{N_2 + 5 O2 \rightarrow 2 N2O5} \tag{unbalanced}\]
| Elemento | Reactivos | Productos | Balanceado? |
|---|---|---|---|
| N | 1 × 2 = 2 | 2 × 2 = 4 | 2 ≠ 4, no |
| O | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, sí |
El balance del átomo de N se ha alterado por este cambio; se restaura por cambiando el coeficiente para el reactivo N2 a 2.
\[\ce{2N_2 + 5O_2\rightarrow 2N_2O_5}\]
| Elemento | Reactivos | Productos | Balanceado? |
|---|---|---|---|
| N | 2 × 2 = 4 | 2 × 2 = 4 | 4 = 4, sí |
| O | 5 × 2 = 10 | 2 × 5 = 10 | 10 = 10, sí |
Los números de átomos de N y O en cada lado de la ecuación son ahora iguales, y la ecuación está balanceada.
Ejercicio \(\PageIndex{1}\)
Escriba una ecuación balanceada para la descomposición del nitrato de amonio para formar nitrógeno molecular, oxígeno molecular y agua. (Sugerencia: balance el oxígeno a la última, ya que está presente en más de una molécula en el lado derecho de la ecuación).
- Respuesta
-
\[\ce{2NH4NO3 \rightarrow 2N2 + O2 + 4H2O} \nonumber\]
A veces es conveniente usar fracciones en lugar de números enteros como coeficientes intermedios en el proceso de balanceando una ecuación química. Cuando la reacción esta balanceada, todos los coeficientes de la ecuación se pueden multiplicar por un número entero para convertir los coeficientes fraccionarios en números enteros sin alterar el balance del átomo. Por ejemplo, considere la reacción del etano (C2H6) con el oxígeno para producir H2O y CO2, representados por la ecuación que no está balanceada:
\[\ce{C_2H_6 + O_2 \rightarrow H_2O + CO_2} \tag{unbalanced}\]
Siguiendo el enfoque de la inspección de antes, primero se pueden balancear los átomos de C y H por cambiando los coeficientes para las dos especies de productos, como se muestra:
\[\ce{C_2H_6 + O_2 \rightarrow 3H_2O + 2CO_2} \tag{unbalanced}\]
Esto da un resultado de siete átomos de O en el lado del producto de la ecuación, un número impar; no se puede usar ningún coeficiente entero con el reactivo O2 para obtener un número impar, por eso un coeficiente fraccional, \(\ce{7/2}\), se usa en cambio para producir una ecuación balanceada provisional:
\[\ce{C2H6 + 7/2 O2\rightarrow 3H2O + 2CO2} \nonumber \]
Una ecuación balanceada convencional con coeficientes de solo números enteros se obtiene por multiplicando cada coeficiente por 2:
\[\ce{2C2H6 +7O2\rightarrow 6H2O + 4CO2}\]
Finalmente, con respecto a las ecuaciones balanceadas, recuerde que la convención dicta el uso de los coeficientes de números enteros más pequeños. Aunque la ecuación de la reacción entre el nitrógeno molecular y el hidrógeno molecular para producir amoníaco está balanceada.
\[\ce{3N2 +9H2\rightarrow 6NH3}\]
los coeficientes no son los números enteros más pequeños posibles que representan los números relativos de las moléculas de los reactantes y de los productos. Por dividiendo cada coeficiente por el mayor factor común de 3, se obtiene la ecuación preferida:
\[\ce{N2 + 3H2\rightarrow 2NH3}\]
Phet Simulación
Use este tutorial interactivo para práctica adicional de balanceando ecuaciones.
Información Adicional en las Ecuaciones Químicas
A veces, los estados físicos de los reactantes y de los productos en las ecuaciones químicas está indicado con una abreviatura entre paréntesis siguiendo las fórmulas. Abreviaciones comunes incluyen s para sólidos, l para líquidos, g para gases, y aq para sustancias disueltas en agua (soluciones acuosas, como se introdujo en el capítulo anterior). Estas notaciones se ilustran en el ejemplo aquí:
\[\ce{2Na (s) + 2H2O (l) \rightarrow 2NaOH (aq) + H2(g)} \]
Esta ecuación representa la reacción que pasa cuando el sodio metálico se coloca en el agua. El sodio sólido reacciona con agua líquida para producir gas de hidrógeno molecular y el compuesto iónico de hidróxido de sodio (un sólido en forma pura, pero se disuelve fácilmente en agua).
A veces, las condiciones especiales necesarias para una reacción se designan escribiendo una palabra o un símbolo encima o debajo de la flecha de la ecuación. Por ejemplo, una reacción llevada a cabo por el calentamiento puede estar indicada por la letra griega delta (Δ) sobre la flecha.
\[\ce{CaCO3}(s)\xrightarrow{\:\Delta\:} \ce{CaO}(s)+\ce{CO2}(g)\]
Otros ejemplos de estas condiciones especiales se encontrarán mucho más en capítulos que siguen.Ecuaciones para Reacciones Iónicas
Con la abundancia de el agua en la tierra, es lógico que se producen muchas reacciones químicas en medios acuosos. Cuando hay iones involucrados en estas reacciones, las ecuaciones químicas se pueden escribir con varios niveles de detalle apropiados para su uso previsto. Para ilustrar esto, considere una reacción entre compuestos iónicos que pasan en una solución acuosa. Cuando se mezclan soluciones acuosas de \(\ce{CaCl2}\) y de \(\ce{AgNO3}\), se produce una reacción produciendo acuoso \(\ce{Ca(NO3)2}\) y sólido \(\ce{AgCl}\):
Esta ecuación balanceada se llama ecuación molecular porque no representa explícitamente las especies iónicas que están presentes en la solución. Cuando los compuestos iónicos se disuelven en el agua, se pueden disociar a sus iones constituyentes, que luego se dispersan homogéneamente en toda la solución que resulta (en el capítulo sobre soluciones se da una discusión detallada de este proceso importante). Los compuestos iónicos disueltos en agua son representados de una manera más realista como iones disociados, en este caso:
\[\ce{CaCl2}(aq)\rightarrow \ce{Ca^2+}(aq)+\ce{2Cl-}(aq)\]
\[\ce{2AgNO3}(aq)\rightarrow \ce{2Ag+}(aq)+\ce{2NO3-}(aq)\]
\[\ce{Ca(NO3)2}(aq)\rightarrow \ce{Ca^2+}(aq)+\ce{2NO3-}(aq)\]
Diferentemente a estos tres compuestos iónicos, el AgCl no se disuelve en agua muy significativamente, como lo indica su notación de estado físico, (s).
La representación explícita de todos los iones disueltos da una ecuación iónica completa. En este caso particular, las fórmulas para los compuestos iónicos disueltos se reemplazan por fórmulas para sus iones disociados:
\[\ce{Ca^2+}(aq)+\ce{2Cl-}(aq)+\ce{2Ag+}(aq)+\ce{2NO3-}(aq)\rightarrow \ce{Ca^2+}(aq)+\ce{2NO3-}(aq)+\ce{2AgCl}(s)\]
Examinando esta ecuación muestra que dos especies químicas están presentes en forma idéntica en ambos lados de la flecha, \(\ce{Ca^{2+}(aq)}\) y \(\ce{NO3-}(aq)\). Estos iones espectadores que tiene una presencia que se requiere para mantener la neutralidad de la carga, no cambian químicamente ni físicamente por el proceso, por eso se pueden eliminar de la ecuación para obtener una representación más concisa llamada la ecuación iónica neta:
\[\cancel{\ce{Ca^2+}(aq)}+\ce{2Cl-}(aq)+\ce{2Ag+}(aq)+\cancel{\ce{2NO3-}(aq)}\rightarrow \cancel{\ce{Ca^2+}(aq)}+\cancel{\ce{2NO3-}(aq)}+\ce{2AgCl}(s)\]
\[\ce{2Cl-}(aq)+\ce{2Ag+}(aq)\rightarrow \ce{2AgCl}(s)\]
Siguiendo la convención de usar los números enteros más pequeños posibles como coeficientes, esta ecuación se escribe así:
\[\ce{Cl-}(aq)+\ce{Ag+}(aq)\rightarrow \ce{AgCl}(s)\]
Esta ecuación iónica neta indica que se puede producir el cloruro de plata sólido a partir de iones de cloruro y plata (I) disueltos, independientemente de la fuente de estos iones. Estas ecuaciones iónicas moleculares y completas dan información adicional, como los compuestos iónicos usados como fuentes de: \(\ce{Cl^{−}}\) y \(\ce{Ag+}\).
Ejemplo \(\PageIndex{2}\): Ecuaciones Moleculares y Iónicas
Cuando el dióxido de carbono se disuelve en una solución acuosa de hidróxido de sodio, la mezcla reacciona para producir carbonato de sodio acuoso y agua líquida. Escriba ecuaciones moleculares equilibradas, iónicas completas, y ecuaciones iónicas netas para este proceso.
Solución
Comience por identificando fórmulas para los reactivos y productos y ordenándolos adecuadamente en forma de ecuaciones químicas:
El balance se logra fácilmente en este caso al cambiar el coeficiente de NaOH a 2, lo que resulta en la ecuación molecular para esta reacción:
\[\ce{CO2(aq)+2NaOH(aq)\rightarrow Na2CO3(aq) + H2O}(l) \nonumber\]
Los dos compuestos iónicos disueltos, NaOH y Na2CO3, se pueden representar como iones disociados para obtener la ecuación iónica completa:
Finalmente, identifique el (los) ion(es) espectador, en este caso Na+(aq), y elimínelo de cada lado de la ecuación para generar la ecuación iónica neta
\[\begin{align*}
\ce{CO2}(aq)+\cancel{\ce{2Na+}(aq)}+\ce{2OH-}(aq)&\rightarrow \cancel{\ce{2Na+}(aq)}+\ce{CO3^2-}(aq)+\ce{H2O}(l)\\
\ce{CO2}(aq)+\ce{2OH-}(aq)&\rightarrow \ce{CO3^2-}(aq)+\ce{H2O}(l)
\end{align*}\]
Ejercicio \(\PageIndex{2}\)
El cloro diatómico y el hidróxido de sodio (lejía) son productos químicos básicos producidos en grandes cantidades, junto con el hidrógeno diatómico, a través de la electrólisis de la salmuera, de acuerdo con la siguiente ecuación que no está balanceada:
\[\ce{NaCl(aq) + H2O(l) ->[ electricity] NaOH(aq) + H2(g) + Cl2(g)} \nonumber\]
Escriba ecuaciones moleculares balanceadas, iónicas completas y iónicas netas para este proceso.
- Respuesta
-
Ecuación molecular balanceada: \[\ce{2NaCl}(aq)+\ce{2H2O}(l)\rightarrow \ce{2NaOH}(aq)+\ce{H2}(g)+\ce{Cl2}(g)} \nonumber\]
Ecuación iónica balanceada: \[\ce{2Na+}(aq)+\ce{2Cl-}(aq)+\ce{2H2O}(l)\rightarrow \ce{2Na+}(aq)+\ce{2OH-}(aq)+\ce{H2}(g)+\ce{Cl2}(g)} \nonumber\]
Ecuación iónica neta balanceada: \[\ce{2Cl-}(aq)+\ce{2H2O}(l)\rightarrow \ce{2OH-}(aq)+\ce{H2}(g)+\ce{Cl2}(g) } \nonumber\]
Conceptos claves y el resumen
Las ecuaciones químicas son representaciones simbólicas de los cambios químicos y físicos. Las fórmulas para las sustancias que experimentan el cambio (reactantes) y las sustancias generadas por el cambio (productos) están separadas por una flecha y precedidas por coeficientes enteros que indican sus números relativos. Las ecuaciones balanceadas son aquellas con coeficientes que dan como resultado números iguales de átomos para cada elemento en los reactivos y productos. Las reacciones químicas en solución acuosa que involucran productos o reactivos iónicos se pueden representar en una manera más realista usando ecuaciones iónicas completas y ecuaciones iónicas netas.
Glosario
- ecuación balanceada
- Ecuación química con un número igual de átomos para cada elemento en el reactivo y el producto.
- ecuación química
- Representación simbólica de una reacción química.
- coeficiente
- Número colocado en frente de símbolos o fórmulas en una ecuación química para indicar su cantidad relativa.
- ecuación iónica completa
- Ecuación química en la que todos los reactivos y productos iónicos disueltos, incluidos los iones espectadores, se representan explícitamente por fórmulas para sus iones disociados.
- ecuación molecular
- Ecuación química en la que todos los reactivos y productos están representados como sustancias neutras.
- ecuación iónica neta
- Ecuación química que solo representada aquellos reactivos iónicos disueltos y productos que experimentan un cambio químico o físico (excluye los iones espectadores).
- producto
- sustancia formada por un cambio químico o físico; se muestra en el lado derecho de la flecha en una ecuación química.
- reactivo
- sustancia que pasa un cambio químico o físico; se muestra en el lado izquierdo de la flecha en una ecuación química.
- ion espectador
-
Ión que no pasa un cambio químico o físico durante una reacción, pero su presencia se requiere para mantener la neutralidad de la carga.
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


