4.5: El análisis químico cuantitativo
- Page ID
- 1823
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)habilidades para desarrollar
- Describir los aspectos fundamentales de las titulaciones y el análisis gravimétrico.
- Realizar cálculos estequiométricos utilizando datos típicos de titulación y gravimétricos.
En el siglo XVIII, la fuerza (en realidad la concentración) de las muestras de vinagre se determinó observando la cantidad de carbonato de potasio, K2CO3, que se debía agregar, poco a poco, antes de que cesara el burbujeo. Cuanto mayor sea el peso de carbonato de potasio agregado para alcanzar el punto donde terminó el burbujeo, más concentrado estará el vinagre.
Ahora sabemos que la efervescencia que se produjo durante este proceso se debió a la reacción con el ácido acético, CH3CO2H, el compuesto principal responsable del olor y del sabor del vinagre. El ácido acético reacciona con el carbonato de potasio de acuerdo con la siguiente ecuación:
El burbujeo se debió a la producción de CO2.
La prueba del vinagre con carbonato de potasio es un tipo de análisis cuantitativo: la determinación de la cantidad o concentración de una sustancia en una muestra. En el análisis del vinagre, la concentración del soluto (el ácido acético) se determinó a partir de la cantidad de reactivo que se combinó con el soluto presente en un volumen conocido de la solución. En otros tipos de análisis químicos, la cantidad de una sustancia presente en una muestra se determina midiendo la cantidad de producto que resulta.
La titulación
El enfoque descrito para medir la concentración del vinagre fue una versión temprana de la técnica analítica conocida como el análisis de valoración. Un análisis de la titulación típica involucra el uso de una bureta (Figura \(\PageIndex{1}\)) para realizar adiciones incrementales de una solución que contiene una concentración conocida de alguna sustancia (el valorante) a una solución de muestra que contiene la sustancia cuya concentración es para ser medida (el analito). El valorante y el analito pasan por una reacción química de estequiometría conocida y, por lo tanto, la medición del volumen de la solución de valoración requerido para completar la reacción con el analito (el punto de equivalencia de la valoración) permite el cálculo de la concentración del analito. El punto de equivalencia de una titulación se puede detectar visualmente si un cambio distinto en el aspecto de la solución de la muestra acompaña a la finalización de la reacción. La detención de la formación de burbujas en el análisis del vinagre clásico es un ejemplo, aunque, más comúnmente, se agregan tintes especiales llamados indicadores a las soluciones de muestra para impartir un cambio de color en o muy cerca del punto de equivalencia de la titulación. Los puntos de equivalencia también se pueden detectar por midiendo alguna propiedad de la solución que cambia de manera predecible durante el curso de la titulación. Independientemente del enfoque adoptado para detectar el punto de equivalencia de una titulación, el volumen de titulación realmente medido se llama el punto final. Los métodos de la titulación diseñados adecuadamente aseguran que la diferencia entre la equivalencia y los puntos finales sea insignificante. Aunque cualquier tipo de reacción química puede servir como base para un análisis de la titulación, los tres descritos en este capítulo (la precipitación, el ácido-base y el redox) son los más comunes. En el capítulo sobre equilibrios ácido-base se dan detalles adicionales sobre el análisis de la titulación.

Ejemplo \(\PageIndex{1}\): el análisis de la titulación
El punto final en una titulación de una muestra de 50.00 mL de HCl acuoso se alcanzó mediante la adición de 35.23 ml de un valorante de NaOH 0.250 M. La reacción de la titulación es:
¿Cuál es la molaridad del HCl?
Solución
En cuanto a toda la estequiometría de la reacción, la cuestión clave es la relación entre las cantidades molares de las especies químicas de interés como se muestra en la ecuación química balanceada. Se sigue el enfoque descrito en los módulos anteriores de este capítulo, con consideraciones adicionales requeridas, ya que las cantidades de reactivos proporcionados y solicitados se expresan como concentraciones de la solución.
Para este ejercicio, el cálculo seguirá los siguientes pasos descritos:
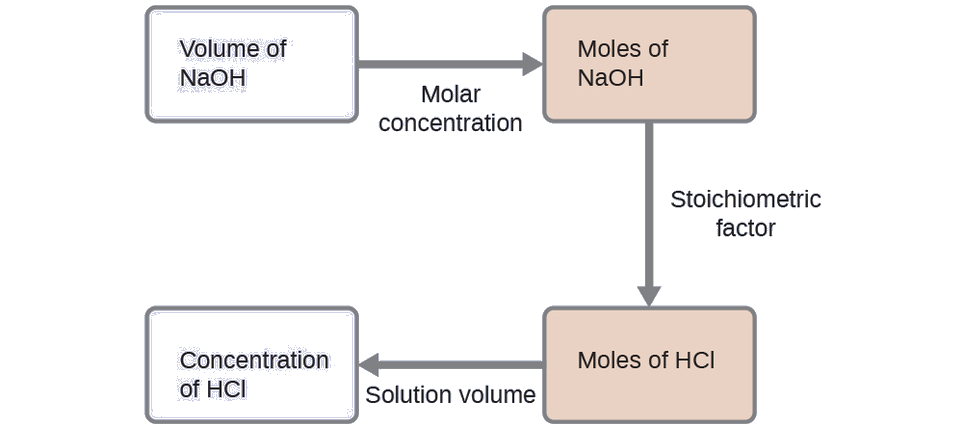
La cantidad molar de HCl se calcula a ser:
Usando el volumen proporcionado de solución de HCl y la definición de molaridad, la concentración de HCl es:
M&=\mathrm{\dfrac{mol\: HCl}{L\: solution}}\\
M&=\mathrm{\dfrac{8.81\times 10^{-3}\:mol\: HCl}{50.00\: mL\times \dfrac{1\: L}{1000\: mL}}}\\
M&=0.176\:M
\end{align*}\]
Note: Para estos tipos de cálculos de titulación, es conveniente reconocer que la molaridad de la solución también es igual al número de milimoles de soluto por mililitro de solución:
El uso de esta versión de la unidad de molaridad reducirá el cálculo al eliminar dos factores de conversión:
\[\mathrm{\dfrac{35.23\:mL\: NaOH\times \dfrac{0.250\:mmol\: NaOH}{mL\: NaOH}\times \dfrac{1\:mmol\: HCl}{1\:mmol\: NaOH}}{50.00\:mL\: solution}=0.176\: \mathit M\: HCl}\]
Ejercicio \(\PageIndex{1}\)
Una muestra de 20.00 mL de ácido oxálico acuoso, H2C2O4, se tituló con una solución de permanganato de potasio 0.09113-M KMnO4.
Se requirió un volumen de 23.24 mL para alcanzar el punto final. ¿Cuál es la molaridad del ácido oxálico?
- Respuesta
-
0.2648 M
El análisis gravimétrico
Un análisis gravimétrico es aquel en el que una muestra se somete a algún tratamiento que provoca un cambio en el estado físico del analito que permite su separación de los otros componentes de la muestra. Las mediciones de masa de la muestra, el analito aislado, o algún otro componente del sistema de análisis, usado junto con la estequiometría conocida de los compuestos involucrados, permiten el cálculo de la concentración del analito. Los métodos gravimétricos fueron las primeras técnicas usadas para el análisis químico cuantitativo, y siguen siendo herramientas importantes en el laboratorio de la química moderna.
El cambio de estado requerido en un análisis gravimétrico se puede lograr mediante diversos procesos físicos y químicos. Por ejemplo, el contenido de humedad (el agua) de una muestra se determina de forma rutinaria midiendo la masa de una muestra antes y después de someterla a un proceso de calentamiento controlado que evapora el agua. También son comunes las técnicas gravimétricas en las que el analito se somete a una reacción de precipitación del tipo descrito anteriormente en este capítulo. El precipitado se aísla típicamente de la mezcla de reacción por filtración, se seca cuidadosamente y luego se pesa (Figura \(\PageIndex{2}\)). La masa del precipitado se puede usar, junto con las relaciones estequiométricas relevantes, para calcular la concentración del analito.

Ejemplo \(\PageIndex{2}\): El Análisis Gravimétrico
Una mezcla sólida de 0.4550 g que contiene MgSO4 se disuelve en el agua y se agrega un exceso de Ba(NO3)2, lo que da como resultado la precipitación de 0.6168 g de BaSO4.
¿Cuál es la concentración (porcentaje) de MgSO4 en la mezcla?
Solución
El plan para este cálculo es similar a otros usados en los cálculos estequiométricos, siendo el paso central la conexión entre los moles de BaSO4 y MgSO4 a través de su factor estequiométrico. Una vez que se calcula la masa de MgSO4, se puede usar junto con la masa de la mezcla de muestra para calcular el porcentaje de concentración solicitada.
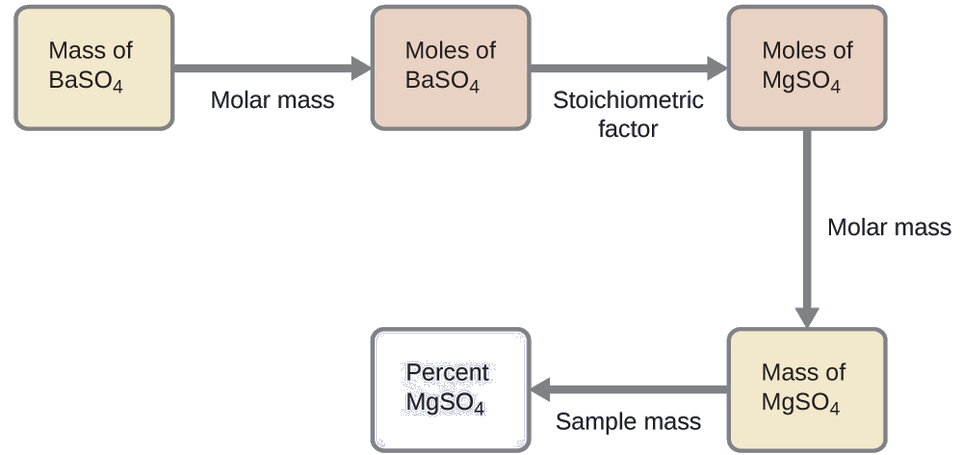
La masa de MgSO4 que daría la masa precipitada proporcionada es
La concentración de MgSO4 en la mezcla de la muestra se a caluclado a ser:
\[\begin{align*}
\ce{percent\: MgSO4}&=\ce{\dfrac{mass\: MgSO4}{mass\: sample}}\times100\%\\
\mathrm{\dfrac{0.3181\: g}{0.4550\: g}}\times100\%&=69.91\%
\end{align*}\]
Ejercicio \(\PageIndex{2}\)
¿Cuál es el porcentaje de ion cloruro en una muestra si 1.1324 g de la muestra produce 1.0881 g de AgCl cuando se trata con Ag+ en exceso?
\[\ce{Ag+}(aq)+\ce{Cl-}(aq)\rightarrow \ce{AgCl}(s) \nonumber\]
- Respuesta
-
23.76%
El análisis de la combustión
La composición elemental de los hidrocarburos y de los compuestos relacionados se puede determinar mediante un método gravimétrico conocido como el análisis de la combustión. En un análisis de la combustión, una muestra pesada del compuesto se calienta a una temperatura alta bajo una corriente de gas de oxígeno, lo que resulta en su combustión completa para producir productos gaseosos de identidades conocidas. La combustión completa de los hidrocarburos, por ejemplo, producirá el dióxido de carbono y el agua como los únicos productos. Los productos de combustión gaseosos se barren a través de dispositivos de recolección separados y previamente pesados que contienen compuestos que absorben selectivamente cada producto (Figura \(\PageIndex{3}\)). El aumento de masa de cada dispositivo corresponde a la masa del producto absorbido y se puede usar en un cálculo estequiométrico apropiado para derivar la masa del elemento relevante.
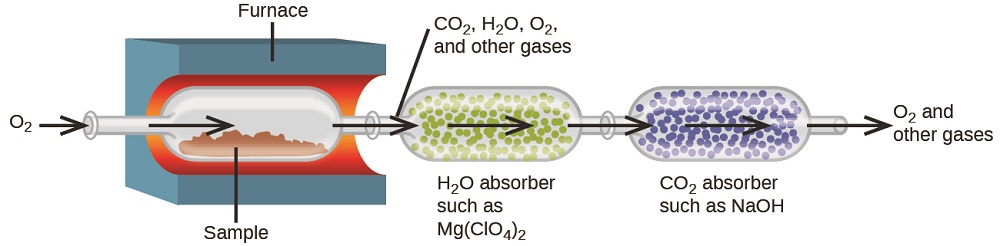
Ejemplo \(\PageIndex{3}\): EL ANÁLISIS DE LA COMBUSTIÓN
El polietileno es un polímero de hidrocarburo usado para producir bolsas de almacenamiento de alimentos y muchos otros artículos de plástico flexible. Un análisis de la combustión de una muestra de 0.00126 g de polietileno produce 0.00394 g de CO2 y 0.00161 g de H2O. ¿Cuál es la fórmula empírica del polietileno?
Solución
El supuesto principal en este ejercicio es que todo el carbono en la muestra quemada se convierte en el dióxido de carbono, y todo el hidrógeno en la muestra se convierte en el agua:
\[\mathrm{C_xH_y}(s)+\ce{excess\: O2}(g)\rightarrow x\ce{CO2}(g)+ \dfrac{y}{2} \ce{H2O}(g) \nonumber\]
Tenga en cuenta que una ecuación balanceada no es necesaria para la tarea en cuestión. Para derivar la fórmula empírica del compuesto, solo se necesitan los subíndices x e y.
Primero, calcule las cantidades molares de carbono e hidrógeno en la muestra, usando las masas proporcionadas de dióxido de carbono y agua, respectivamente. Con estas cantidades molares, la fórmula empírica para el compuesto se puede escribir como se describe en el capítulo anterior de este texto. Un resumen de este enfoque se da en el siguiente diagrama de flujo:
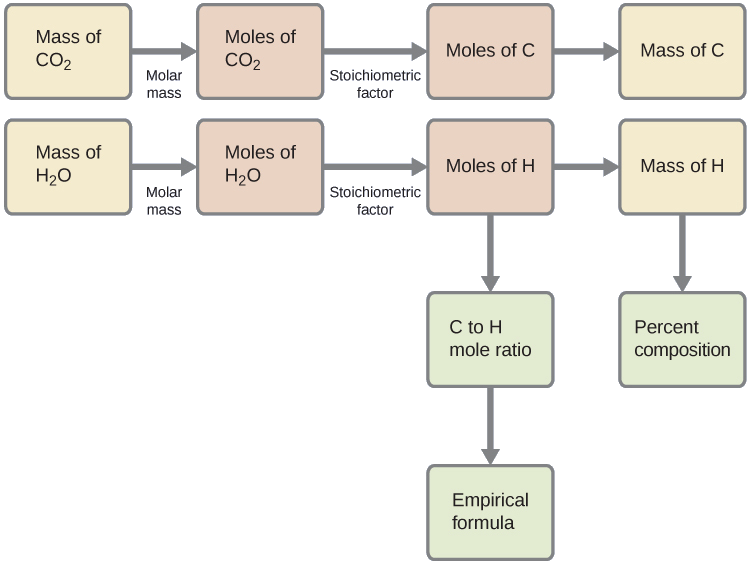
\[\mathrm{mol\: H=0.00161\:g\: H_2O\times\dfrac{1\:mol\: H_2O}{18.02\:g/mol}\times\dfrac{2\:mol\: H}{1\:mol\: H_2O}=1.79\times10^{-4}\:mol\: H}\]
La fórmula empírica para el compuesto se deriva luego por identificando los múltiplos de números enteros más pequeños para estas cantidades molares. La relación molar de H a C es
y la fórmula empírica para el polietileno es CH2.
Ejercicio \(\PageIndex{3}\)
Una muestra de 0.00215 g de poliestireno, un polímero compuesto de carbono e hidrógeno, produjo 0.00726 g de CO2 y 0.00148 g de H2O en un análisis de combustión. ¿Cuál es la fórmula empírica para el poliestireno?
- Respuesta
-
CH
Resumen
La estequiometría de las reacciones químicas puede servir como base para los métodos de análisis químico cuantitativo. Las titulaciones involucran medir el volumen de una solución de titulador requerida para reaccionar completamente con una solución de muestra. Este volumen se usa luego para calcular la concentración de analito en la muestra usando la estequiometría de la reacción de titulación. El análisis gravimétrico involucra separar el analito de la muestra mediante un proceso físico o químico, determinar su masa y luego calcular su concentración en la muestra según la estequiometría del proceso relevante. El análisis de combustión es un método gravimétrico usado para determinar la composición elemental de un compuesto mediante la recolección y el pesaje de los productos gaseosos de su combustión.
Glosario
- el analito
- Especies químicas de interés.
- la bureta
- Dispositivo usado para la entrega precisa de volúmenes variables de líquidos, como en un análisis de titulación.
- el análisis de combustión
- Técnica gravimétrica usada para determinar la composición elemental de un compuesto mediante la recolección y el pesaje de sus productos gaseosos de combustión.
- el punto final
- Volumen medido de la solución de titulación que produce el cambio en el aspecto de la solución de la muestra u otra propiedad esperada para la equivalencia estequiométrica (vea punto de equivalencia).
- el punto de equivalencia
- Volumen de solución de titulador requerido para reaccionar completamente con el analito en un análisis de titulación; proporciona una cantidad estequiométrica de valorante para el analito de la muestra según la reacción de valoración.
- el análisis gravimétrico
- Método de análisis químico cuantitativo que involucra la separación de un analito de una muestra mediante un proceso físico o químico y mediciones de masa posteriores del analito, producto de reacción y/o muestra.
- el indicador
- Sustancia agregada a la muestra en un análisis de titulación para permitir la detección visual del punto final.
- el análisis cuantitativo
- La determinación de la cantidad o concentración de una sustancia en una muestra.
- el titulador
- Solución que contiene una concentración conocida de sustancia que reaccionará con el analito en un análisis de titulación.
- el análisis de titulación
- Método de análisis químico cuantitativo que consiste en medir el volumen de una solución reactiva requerida para reaccionar completamente con el analito en una muestra
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


