10.5: El estado sólido de la materia
- Page ID
- 1881
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)habilidades para desarrollar
- Definir y describir la unión y las propiedades de los sólidos cristalinos de las redes iónicas, moleculares, metálicas y covalentes.
- Describir los principales tipos de los sólidos cristalinos: sólidos iónicos, sólidos metálicos, sólidos de red covalente y sólidos moleculares.
- Explicar las formas en que pueden ocurrir defectos cristalinos en un sólido
Cuando la mayoría de los líquidos se enfrían, eventualmente se congelan y forman sólidos cristalinos, sólidos en los que los átomos, iones o moléculas están dispuestos en un patrón repetitivo definido. También es posible que un líquido se congele antes de que sus moléculas se organicen en un patrón ordenado. Los materiales que resultan se llaman los sólidos amorfos o los sólidos no cristalinos (o, a veces, vidrios). Las partículas de tales sólidos no tienen una estructura interna ordenada y están dispuestas aleatoriamente (Figura \(\PageIndex{1}\)).
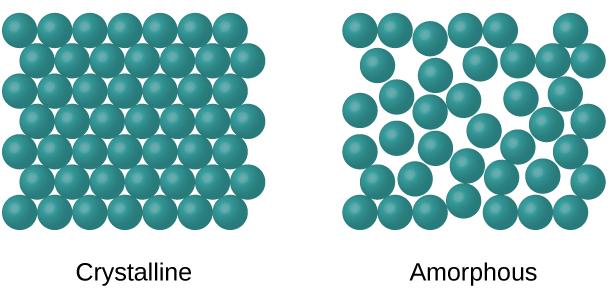
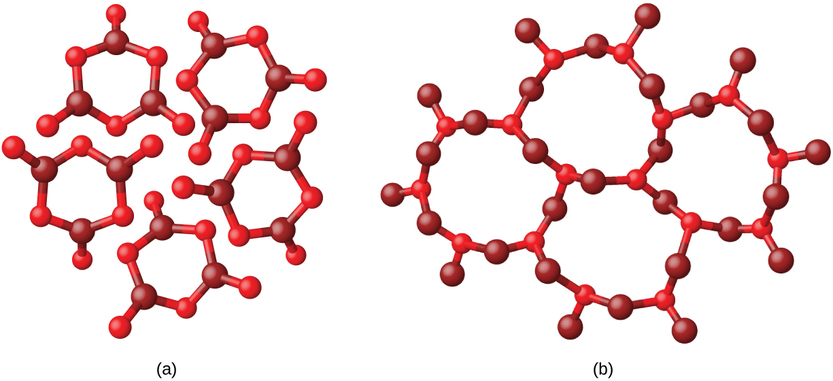
Los metales y los compuestos iónicos típicamente forman sólidos cristalinos ordenados. Las sustancias que consisten en moléculas grandes, o una mezcla de moléculas cuyos movimientos son más restringidos, a veces forman sólidos amorfos. Por ejemplo, las ceras de las velas son sólidos amorfos compuestos de grandes moléculas de hidrocarburos. Algunas sustancias, como el óxido de boro (Figura \(\PageIndex{2}\)), pueden formar sólidos cristalinos o amorfos, dependiendo de las condiciones bajo las cuales se produce. Además, los sólidos amorfos pueden experimentar una transición al estado cristalino en condiciones apropiadas.
Los sólidos cristalinos generalmente se clasifican de acuerdo con la naturaleza de las fuerzas que mantienen juntas sus partículas. Estas fuerzas son las principales responsables de las propiedades físicas exhibidas por los sólidos a granel. Las siguientes secciones proporcionan descripciones de los principales tipos de sólidos cristalinos: iónico, metálico, red covalente y molecular.
Solidos Ionicos
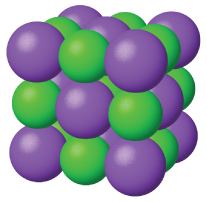
Los sólidos iónicos, como el cloruro de sodio y el óxido de níquel, están compuestos de iones positivos y negativos que se mantienen unidos mediante atracciones electrostáticas, que pueden ser bastante fuertes (Figura \(\PageIndex{3}\)). Muchos cristales iónicos también tienen altos puntos de fusión. Esto se debe a las fuertes atracciones entre los iones: en los compuestos iónicos, las atracciones entre las cargas completas son (mucho) más grandes que las entre las cargas parciales en los compuestos moleculares polares. Esto se analizará con más detalle en una discusión posterior de las energías reticulares. Aunque son difíciles, también tienden a ser frágiles y se rompen en lugar de doblarse. Los sólidos iónicos no conducen electricidad; sin embargo, conducen cuando están fundidos o disueltos porque sus iones son libres de moverse. Muchos compuestos simples formados por la reacción de un elemento metálico con un elemento no metálico son iónicos.
Sólidos Metálicos
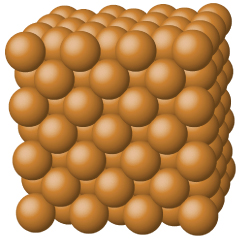
Los sólidos metálicos como los cristales de cobre, aluminio y hierro están formados por átomos metálicos Figura \(\PageIndex{4}\). La estructura de los cristales metálicos a menudo se describen como una distribución uniforme de núcleos atómicos dentro de un "mar" de electrones deslocalizados. Los átomos dentro de tal sólido metálico se mantienen unidos por una fuerza única conocida como un enlace metálico que da lugar a muchas propiedades de volumen útiles y variadas. Todos exhiben alta conductividad térmica y eléctrica, brillo metálico y maleabilidad. Muchos son muy duros y bastante fuertes. Debido a su maleabilidad (la capacidad de deformarse bajo presión o martilleo), no se destruyen y, por lo tanto, son materiales de construcción útiles. Los puntos de fusión de los metales varían ampliamente. El mercurio es un líquido a temperatura ambiente, y los metales alcalinos se derriten por debajo de 200 °C. Varios metales posteriores a la transición también tienen puntos de fusión bajos, mientras que los metales de transición se funden a temperaturas más altas como 1000 °C. Estas diferencias reflejan diferencias en las resistencias de la unión metálica entre los metales.
Sólidos de red covalente
Los sólidos de la red covalente incluyen cristales de diamante, silicio, algunos otros no metales y algunos compuestos covalentes como el dióxido de silicio (arena) y el carburo de silicio (carborundo, el abrasivo sobre papel de lija). Muchos minerales tienen redes de enlaces covalentes. Los átomos en estos sólidos se mantienen unidos por una red de enlaces covalentes, como se muestra en la Figura \(\PageIndex{5}\). Para romper o derretir una red covalente sólida, los enlaces covalentes deben romperse. Debido a que los enlaces covalentes son relativamente fuertes, los sólidos de la red covalente se caracterizan típicamente por su dureza, resistencia y altos puntos de fusión. Por ejemplo, el diamante es una de las sustancias más duras conocidas y se funde por encima de los 3500 °C.
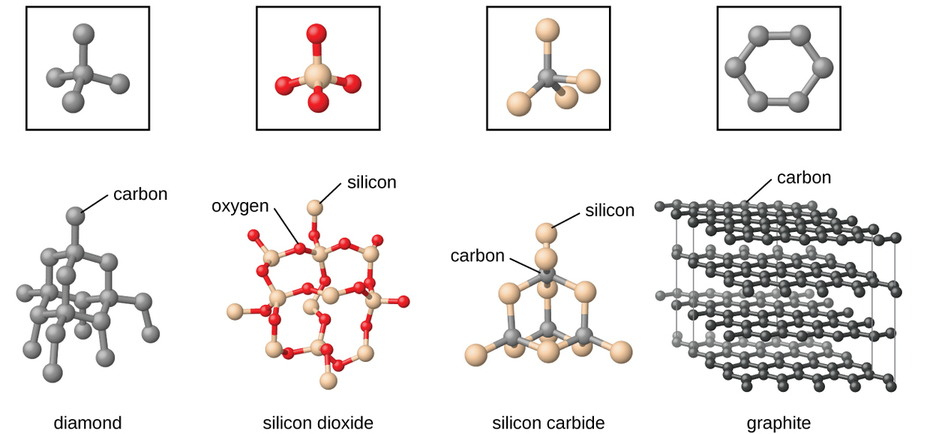
Sólidos moleculares
Los sólidos moleculares, como el hielo, la sacarosa (azúcar de mesa) y el yodo, como se muestra en la Figura \(\PageIndex{6}\), están compuestos de las moléculas neutras. Las resistencias de las fuerzas de atracción entre las unidades presentes en diferentes cristales varían ampliamente, como lo indican los puntos de fusión de los cristales. Las moléculas simétricas pequeñas (moléculas no polares), como H2, N2, O2 y F2, tienen fuerzas de atracción débiles y forman sólidos moleculares con puntos de fusión muy bajos (por debajo de -200 °C). Las sustancias que consisten en moléculas no polares más grandes tienen fuerzas atractivas más grandes y se funden a temperaturas más altas. Los sólidos moleculares compuestos de moléculas con momentos dipolares permanentes (moléculas polares) se derriten a temperaturas aún más altas. Los ejemplos incluyen hielo (punto de fusión, 0 °C) y azúcar de mesa (punto de fusión, 185 °C).
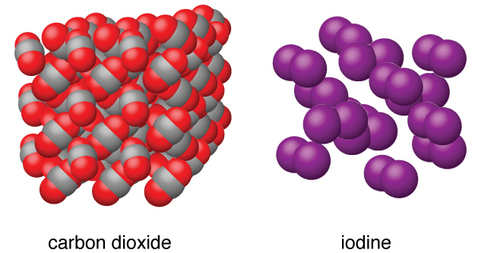
Propiedades de los sólidos
Un sólido cristalino, como los sólidos listados en la Tabla \(\PageIndex{1}\) tiene una temperatura de fusión precisa porque cada átomo o molécula del mismo tipo se mantiene en su lugar con las mismas fuerzas o energía. Por lo tanto, las atracciones entre las unidades que componen el cristal tienen la misma fuerza y todas requieren la misma cantidad de energía para romperse. El ablandamiento gradual de un material amorfo difiere dramáticamente de la fusión distintiva de un sólido cristalino. Esto resulta porque no hay equivalencia estructural de las moléculas en el sólido amorfo. Algunas fuerzas son más débiles que otras, y cuando se calienta un material amorfo, las atracciones intermoleculares más débiles se rompen primero. A medida que la temperatura aumenta aún más, se rompen las atracciones más fuertes. Así, los materiales amorfos se ablandan en un rango de temperaturas.
| Tipo de Sólido | Tipo de partícula | Tipo de atracciones | Propiedades | Ejemplos |
|---|---|---|---|---|
| iónico | iones | enlaces iónicos | duro, quebradizo, conduce la electricidad como un líquido pero no como un sólido, puntos de fusión de alto a muy alto | NaCl, Al2O3 |
| metállico | átomos de elementos electropositivos | enlaces metálicos | brillante, maleable, dúctil, conduce bien el calor y la electricidad, dureza variable y temperatura de fusión | Cu, Fe, Ti, Pb, U |
| red covalente | átomos de elementos electronegativos | enlaces covalentes | muy duros, no conductores, puntos de fusión muy altos | C (diamante), SiO2, SiC |
| molecular | moléculas (o átomos) | IMFs | dureza variable, fragilidad variable, no conductora, puntos de fusión bajos | H2O, CO2, I2, C12H22O11 |
GRAFENO: MATERIAL DEL FUTURO
El carbono es un elemento esencial en nuestro mundo. Las propiedades únicas de los átomos de carbono permiten la existencia de formas de vida basadas en el carbono como nosotros. El carbono forma una gran variedad de sustancias que usamos diariamente, incluyendo las que se muestran en la Figura \(\PageIndex{7}\). Es posible que usted este familiar con el diamante y el grafito, los dos alótropos de carbono más comunes. (Los alótropos son formas estructurales diferentes del mismo elemento). El diamante es una de las sustancias más duras conocidas, mientras que el grafito es lo suficientemente blando como para ser usado como plomo de lápiz. Estas propiedades muy diferentes provienen de las diferentes disposiciones de los átomos de carbono en los diferentes alótropos.
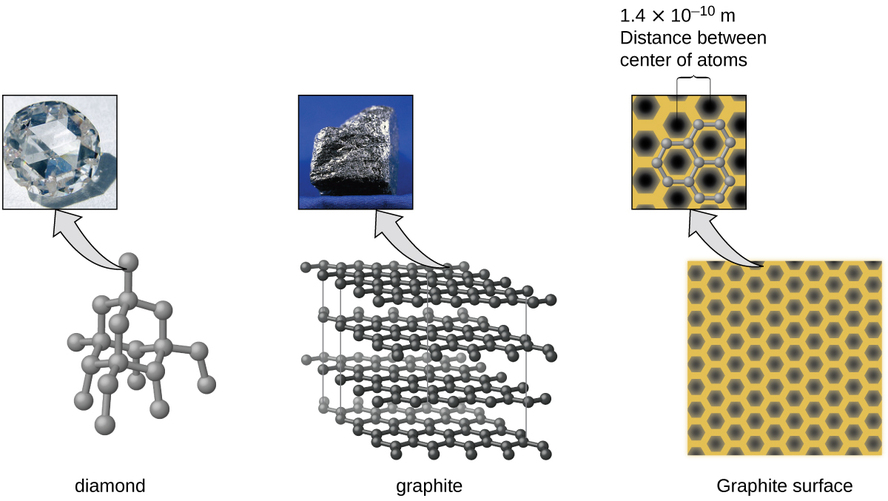
Es posible que esté menos familiarizado con una forma de carbono descubierta recientemente: el grafeno. El grafeno se aisló por primera vez en 2004 mediante el uso de cinta para despegar capas más y más delgadas de grafito. Es esencialmente una sola hoja (un átomo de espesor) de grafito. El grafeno, ilustrado en la Figura \(\PageIndex{8}\), no solo es fuerte y liviano, sino que también es un excelente conductor de electricidad y calor. Estas propiedades pueden resultar muy útiles en una amplia gama de aplicaciones, tales como circuitos y chips de computadora ampliamente mejorados, mejores baterías y celdas solares, y materiales estructurales más fuertes y livianos. El Premio Nobel de Física 2010 fue otorgado a Andre Geim y Konstantin Novoselov por su trabajo pionero con el grafeno.
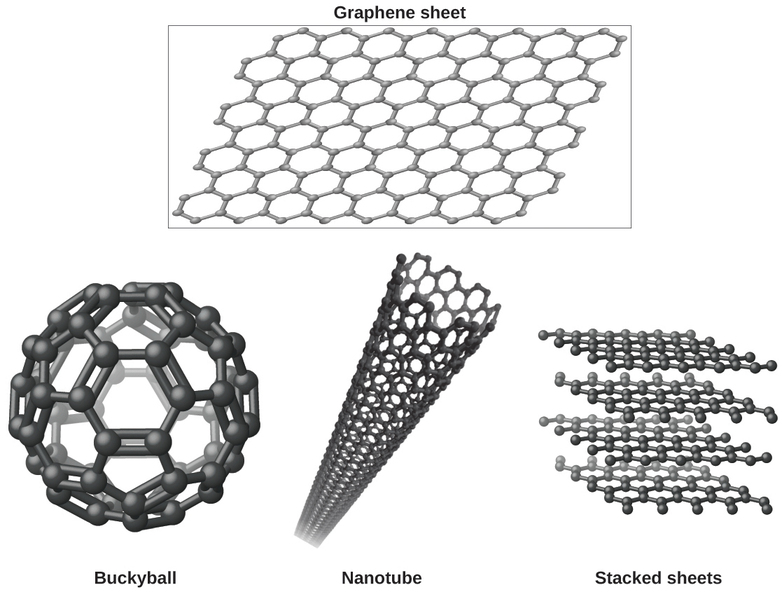
Defectos de los cristales
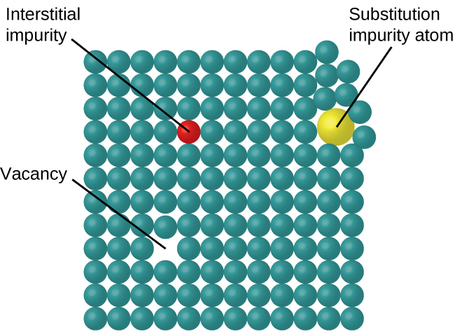
En un sólido cristalino, los átomos, iones o moléculas están dispuestos en un patrón repetitivo definido, pero ocasionalmente se pueden producir defectos en el patrón. Se conocen varios tipos de defectos, como se ilustra en la Figura \(\PageIndex{9}\). Las vacantes son defectos que ocurren cuando las posiciones que deberían contener átomos o iones están vacantes. Con menos frecuencia, algunos átomos o iones en un cristal pueden ocupar posiciones, llamadas sitios intersticiales, ubicadas entre las posiciones regulares de los átomos. Se encuentran otras distorsiones en los cristales impuros, como, por ejemplo, cuando los cationes, aniones o moléculas de la impureza son demasiado grandes para caber en las posiciones regulares sin distorsionar la estructura. Algunas veces se agregan pequeñas cantidades de impurezas a un cristal (un proceso conocido como el dopaje) para crear defectos en la estructura que producen cambios deseables en sus propiedades. Por ejemplo, los cristales de silicio se dopan con cantidades variables de diferentes elementos para producir propiedades eléctricas adecuadas para su uso en la fabricación de semiconductores y chips de computadora.
Resumen
Algunas sustancias forman sólidos cristalinos que consisten en partículas en una estructura muy organizada; otros forman sólidos amorfos (no cristalinos) con una estructura interna que no está ordenada. Los principales tipos de sólidos cristalinos son los sólidos iónicos, los sólidos metálicos, los sólidos de red covalente y los sólidos moleculares. Las propiedades de los diferentes tipos de sólidos cristalinos se deben a los tipos de partículas en que consisten, la disposición de las partículas y la fuerza de las atracciones entre ellas. Debido a que sus partículas experimentan atracciones idénticas, los sólidos cristalinos tienen temperaturas de fusión distintas; las partículas en los sólidos amorfos experimentan una variedad de interacciones, por lo que se ablandan gradualmente y se funden en un rango de temperaturas. Algunos sólidos cristalinos tienen defectos en el patrón repetitivo definido de sus partículas. Estos defectos (que incluyen vacantes, átomos o iones que no están en las posiciones regulares e impurezas) cambian las propiedades físicas como la conductividad eléctrica, que se explota en los cristales de silicio utilizados para fabricar chips de computadora.
Glosario
- sólido amorfo
- (también, sólido no cristalino) sólido en el que las partículas faltan de una estructura interna ordenada
- red covalente sólida
- sólido cuyas partículas se mantienen unidas por enlaces covalentes
- solido cristalino
- sólido en el que las partículas están dispuestas en un patrón repetitivo definido
- sitios intersticiales
- espacios entre las posiciones de partículas regulares en cualquier conjunto de átomos o iones
- sólido iónico
- sólido compuesto de iones positivos y negativos unidos por fuertes atracciones electrostáticas
- sólido metálico
- sólido compuesto de átomos metálicos
- sólido molecular
- sólido compuesto de moléculas neutras unidas por fuerzas de atracción intermoleculares
- vacante
- defecto que ocurre cuando una posición que debe contener un átomo o ion está vacante
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


