2.12: Combinar átomos para hacer moléculas y compuestos
- Page ID
- 70306
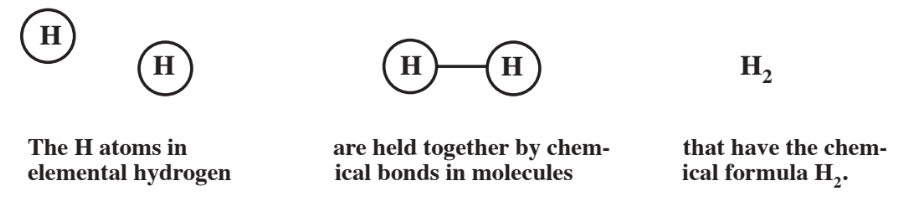
Acerca de los únicos átomos que existen solos son los de los gases nobles, un grupo de elementos que incluyen helio, neón, argón y radón ubicados en el extremo derecho de la tabla periódica. Incluso el átomo de hidrógeno simple en estado elemental se une con otro átomo de hidrógeno. Dos o más átomos no cargados unidos entre sí se llaman molécula. Como se ilustra en la Figura\(\PageIndex{1}\), la molécula de hidrógeno consiste en 2 átomos de hidrógeno como se indica por la fórmula química de hidrógeno elemental, H2. Esta fórmula establece que una molécula de hidrógeno elemental consiste en 2 átomos de hidrógeno, mostrado por el subíndice de 2. Los átomos están unidos entre sí por un enlace químico. Como se explica en el Capítulo 3, un átomo de hidrógeno consiste en un núcleo muy pequeño cargado positivamente rodeado por una nube mucho mayor de carga negativa de un solo electrón que se mueve rápidamente. Pero, los átomos de hidrógeno están más “contenidos” con 2 electrones. Entonces dos átomos de hidrógeno comparten sus dos electrones que constituyen el enlace químico en la molécula de hidrógeno. Un enlace compuesto por electrones compartidos es un enlace covalente.
Compuestos Químicos
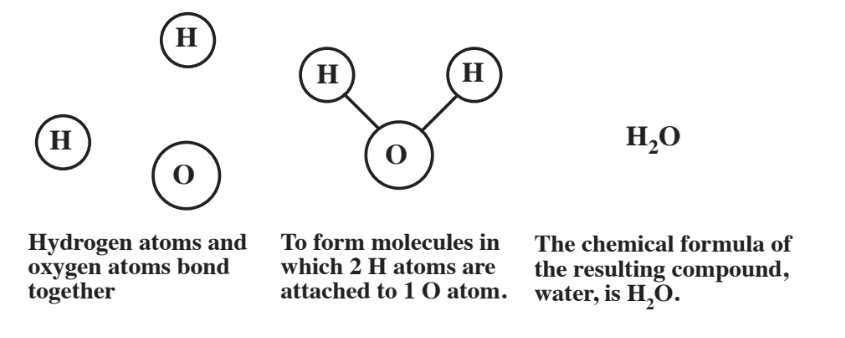
El ejemplo que acabamos de discutir fue uno en el que átomos del mismo elemento, el hidrógeno, se unen para formar una molécula. La mayoría de las moléculas consisten en átomos de diferentes elementos unidos entre sí. Un ejemplo de tal molécula es la del agua, fórmula química H 2 O. Esta fórmula representa el hecho de que la molécula de agua consiste en dos átomos de hidrógeno unidos a un átomo de oxígeno, O, donde la ausencia de un número de subíndice después de la O indica que hay 1 átomo de oxígeno. La molécula de agua se muestra en la Figura\(\PageIndex{2}\). Cada uno de los átomos de hidrógeno se mantiene al átomo de oxígeno en la molécula de agua por dos electrones compartidos en un enlace covalente. Un material como el agua en el que dos o más elementos están unidos entre sí se denomina compuesto químico. Es por la enorme cantidad de combinaciones de dos o más átomos de diferentes elementos que es posible hacer 20 millones o más de compuestos químicos a partir de menos de 100 elementos.
Enlaces Iónicos
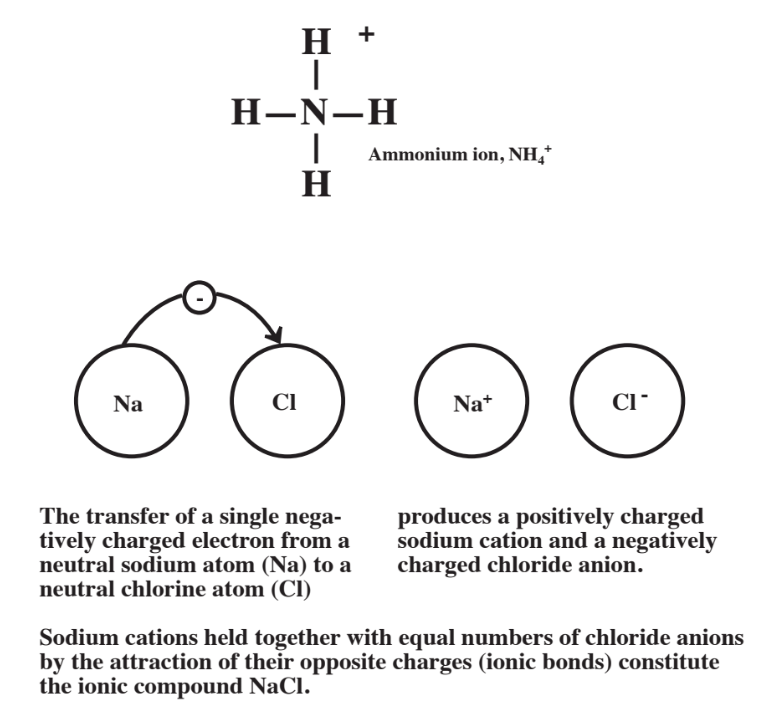
Se acaban de discutir dos moléculas diferentes en las que los átomos se unen entre sí por enlaces covalentes que consisten en electrones compartidos. Otra forma en la que los átomos se pueden unir es mediante la transferencia de electrones de un átomo a otro. Un solo átomo neutro tiene un número de electrones que rodean su núcleo que es el mismo que el número de protones en el núcleo del átomo. Pero, si el átomo pierde uno o más electrones cargados negativamente, termina con una carga eléctrica neta positiva y el átomo se convierte en un catión cargado positivamente. Un átomo que ha ganado uno o más electrones cargados negativamente alcanza una carga neta negativa y se llama anión. Los cationes y aniones son atraídos juntos en un compuesto iónico debido a sus cargas eléctricas opuestas. Los iones con carga opuesta están unidos por enlaces iónicos en una red cristalina.
La figura\(\PageIndex{3}\) muestra el compuesto iónico más conocido, cloruro de sodio, NaCl (sal de mesa común). La fórmula química del NaCl implica que hay 1 Na por cada Cl. En este caso estos consisten en cationes Na + y aniones Cl -. Para compuestos iónicos como el NaCl, la primera parte del nombre es simplemente la del metal que forma el catión, en este caso el sodio. La segunda parte del nombre se basa en el anión, pero tiene el ide final. Por lo que el compuesto iónico formado a partir del sodio y el cloro es cloruro de sodio. Como se muestra en el ejemplo anterior, los compuestos iónicos pueden consistir en iones compuestos por átomos que han perdido electrones (produciendo cationes cargados positivamente) y otros átomos que han ganado electrones (produciendo aniones cargados negativamente).
Además de ser átomos cargados, los iones también pueden consistir en grupos de varios átomos con una carga neta. El ion amonio, NH 4 +, es tal ion. Como se muestra a continuación, el catión NH 4 + consiste en 4H átomos unidos covalentemente (por 2 electrones compartidos) a un átomo central de N, teniendo el grupo de 5 átomos totales una carga eléctrica neta de +1.