2.14: La naturaleza de la materia y los estados de la materia
- Page ID
- 70304
Estamos familiarizados con la materia en diferentes formas. Vivimos en una atmósfera de gas que es mayormente N 2 con cerca de 1/4 de oxígeno, O 2, por volumen. Solo nos damos cuenta del gas en la atmósfera cuando algo anda mal con él, como la contaminación por contaminantes irritantes del aire. Una persona que se adentra en una atmósfera de N 2 puro no notaría nada malo de inmediato, sino que moriría en unos minutos, no porque el N 2 sea tóxico, sino porque la atmósfera carece de oxígeno vivificante. La misma atmósfera que respiramos contiene agua en forma de gas como vapor de agua. Y también estamos familiarizados, por supuesto, con el agua líquida y con el hielo sólido.
el aire que respiramos, como la mayoría de las sustancias, es una mezcla que consiste en dos o más sustancias. El aire es una mezcla homogénea, lo que significa que las moléculas de aire se mezclan entre sí a nivel molecular. No hay forma de que podamos desarmar el aire por medios mecánicos simples, como mirarlo bajo una lupa y seleccionar sus componentes individuales. Otra sustancia común que es una mezcla homogénea es el agua potable, que es en su mayoría moléculas de H 2 O, pero que también contiene O 2 y N 2 disueltos del aire, iones de calcio disueltos (Ca 2 +), cloro agregado para la desinfección, y otros materiales.
Una mezcla heterogénea es aquella que contiene partículas discernibles y distintas que, en principio al menos, pueden descomponerse mecánicamente. El concreto es una mezcla heterogénea. El examen cuidadoso de una pieza de concreto roto muestra que contiene partículas de arena y roca incrustadas en cemento Portland solidificado.
Un material que consiste en un solo tipo de sustancia se conoce como sustancia pura. Sustancias absolutamente puras son casi imposibles de lograr. El agua hiperpura involucrada en las operaciones de fabricación de semiconductores se aproxima a Otro ejemplo es el gas helio puro 99.9995% utilizado en un instrumento combinado de cromatógrafo de gases/espectrómetro de masas empleado para el análisis químico de contaminantes del aire y del agua.
Las mezclas son muy importantes en la práctica de la química verde. Entre otras razones por las que esto es así es que la separación de impurezas de las mezclas en el procesamiento de materias primas y en el reciclaje de materiales suele ser uno de los aspectos más problemáticos y costosos de la utilización de materiales y puede generar grandes cantidades de desechos. Las impurezas pueden hacer que las mezclas sean tóxicas. Por ejemplo, el arsénico tóxico, que se encuentra directamente por debajo del fósforo en la tabla periódica y tiene propiedades químicas similares al fósforo, se presenta como impureza en los minerales de fosfato de los que se extrae el fósforo elemental. Esto no es un problema para el fósforo utilizado como fertilizante porque la pequeña cantidad de arsénico agregado al suelo es insignificante en comparación con el arsénico presente naturalmente en el suelo. Pero, si el fósforo se va a convertir en ácido fosfórico y sales de fosfato para agregarse a los refrescos o a los alimentos, no se puede tolerar la impureza de arsénico debido a su toxicidad que requiere la eliminación de este elemento a un costo considerable.
Muchos subproductos de las operaciones de fabricación son mezclas. Por ejemplo, los solventes organoclorados utilizados para limpiar y desengrasar piezas mecanizadas son mezclas que contienen grasa y otras impurezas. Como parte del proceso para reciclar estos disolventes, las impurezas deben eliminarse mediante procesos costosos como la destilación. La separación de los constituyentes de la mezcla suele ser uno de los aspectos más caros del reciclaje de materiales.
Estados de la Materia
Como se muestra en la Figura\(\PageIndex{1}\), los tres estados comunes de la materia son gases, líquidos y sólidos. Estos se ilustran fácilmente por el agua, cuya forma más familiar es el agua líquida. El hielo es un sólido y el vapor de agua en la atmósfera o en una línea de vapor es un gas.
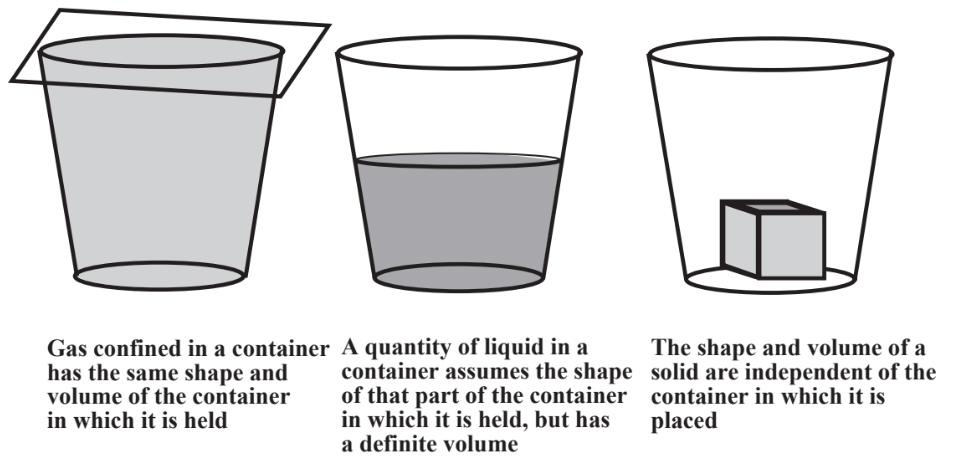
Los gases, como los que componen el aire que nos rodea, están compuestos principalmente por espacios vacíos a través del cual las moléculas de la materia que componen el gas se mueven constantemente, rebotando entre sí o en las paredes del contenedor millones de veces por segundo. Una cantidad de gas se expande para llenar el contenedor en el que se coloca. Debido a que en su mayoría son espacios vacíos, los gases pueden comprimirse significativamente; exprimir un gas y responde con un volumen disminuido. La temperatura del gas es básicamente una expresión de la tendencia de las moléculas de gas a moverse más rápidamente; las temperaturas más altas significan un movimiento molecular más rápido y más moléculas que rebotan entre sí o en las paredes del recipiente por segundo. El impacto constante de las moléculas de gas en las paredes de los contenedores es la causa de la presión del gas. Debido al libre movimiento de las moléculas entre sí y la presencia de espacios mayormente vacíos, una cantidad de gas adquiere el volumen y la forma del contenedor en el que se coloca. El comportamiento físico de los gases es descrito por varias leyes de gas que relacionan los volúmenes de gas con las cantidades del gas, la presión y la temperatura. Los cálculos que involucran estas leyes están cubiertos al inicio del Capítulo 10.
Las moléculas de líquidos pueden moverse una respecto a la otra, pero no se pueden comprimir juntas en una medida significativa, por lo que los líquidos no son compresibles. Los líquidos sí toman la forma de la parte de un recipiente que ocupan. Las moléculas de sólidos ocupan posiciones fijas entre sí. Por lo tanto, los sólidos no pueden comprimirse significativamente y un objeto sólido conserva su forma independientemente del contenedor en el que se coloque.


