4.1: enlaces químicos y formación de compuestos
- Page ID
- 69879
Los compuestos químicos consisten en moléculas o agregados de iones compuestos por dos o más elementos unidos por enlaces químicos. En capítulos anteriores se dieron varios ejemplos de compuestos químicos incluyendo agua (H 2 O), amoníaco (NH 3) y cloruro de sodio (NaCl). Este capítulo aborda los compuestos químicos con más detalle, incluyendo aspectos de su química verde.
Un aspecto crucial de los compuestos químicos consiste en los tipos de enlaces que los mantienen unidos. Como se señaló anteriormente, estos pueden ser enlaces covalentes compuestos por electrones compartidos o enlaces iónicos que consisten en cationes cargados positivamente y aniones cargados negativamente. Las fortalezas de estos enlaces varían y son importantes para determinar el comportamiento de los compuestos. Por ejemplo, los clorofluorocarbonos, como el diclorodifluorometano, Cl 2 CF 2, son tan estables que persisten en la atmósfera y no se descomponen hasta alcanzar altitudes muy altas en la estratosfera, donde la liberación de átomos de cloro destruye el ozono estratosférico. Las estabilidades extremas de los clorofluorocarbonos se deben a las muy altas resistencias de los enlaces C-Cl y C-F por los que el cloro y el flúor se unen a un átomo de carbono central. La práctica adecuada de la química verde requiere que las sustancias que se liberan al ambiente se descompongan fácilmente. Dado que Cl 2 CF 2 es tan estable cuando se libera a la atmósfera, no puede considerarse como un muy buen químico verde.
Otro aspecto importante de la forma en que se juntan los compuestos químicos es la estructura molecular, que se refiere a la forma de las moléculas. Considere el compuesto Cl 2 CF 2 recién mencionado en el que los átomos de Cl y F están unidos a un solo átomo de carbono. Para representar esta molécula como la estructura plana (abajo)
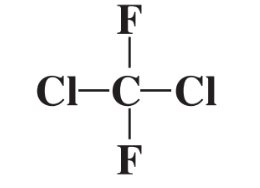
no es del todo correcto porque no todos los 5 átomos en el compuesto se encuentran en el mismo plano. En cambio, los átomos F y Cl pueden visualizarse como distribuidos lo más lejos posible en tres dimensiones alrededor de una esfera, en cuyo centro se encuentra el átomo de C. Esto se puede representar como
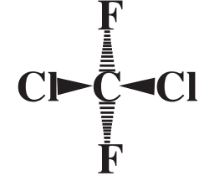
donde los dos átomos de Cl se visualizan como que están por encima del plano de la página del libro hacia el lector y los dos átomos F se representan como que están por debajo del plano de la página lejos del lector. La forma de las moléculas es muy importante para determinar las formas en que interactúan con otras moléculas. Por ejemplo, las moléculas de enzimas que permiten que el metabolismo ocurra en los organismos vivos reconocen las moléculas sustrato sobre las que actúan por sus formas complementarias.
¿Qué son los compuestos químicos verdes?
Los compuestos químicos varían notablemente en el grado en que son “verdes”. El diclorodifluorometano, Cl 2 CF 2, el clorofluorocarbono discutido anteriormente, definitivamente no es verde. Eso no es porque sea tóxico —es uno de los compuestos sintéticos menos tóxicos conocidos— sino porque es extremadamente estable y persistente en la atmósfera y puede provocar la destrucción del ozono estratosférico. Los compuestos que lo han reemplazado, los hidrofluorocarbonos e hidroclorofluorocarbonos, son mucho más verdes porque no duran mucho cuando se liberan en la atmósfera o no contienen cloro dañino para el ozono.
Existen varias características de los compuestos que cumplen con los criterios de ser verdes. Estos son los siguientes:
• Preparación a partir de recursos renovables o fácilmente disponibles mediante procesos respetuosos con el medio ambiente
• Baja tendencia a sufrir reacciones repentinas, violentas e impredecibles, como explosiones que pueden causar daños, lesionar al personal o provocar la liberación de químicos y subproductos al medio ambiente.
• No inflamable o poco inflamable
• Baja toxicidad
• Ausencia de componentes tóxicos o peligrosos para el medio ambiente, particularmente metales pesados
• Degradabilidad fácil, especialmente biodegradabilidad, en el ambiente.
• Baja tendencia a sufrir bioacumulación en las cadenas alimentarias del ambiente
Un ejemplo de un compuesto verde es el estearato de sodio, jabón de manos común. Esta sustancia común se prepara haciendo reaccionar la grasa animal del subproducto con hidróxido de sodio, que se prepara haciendo pasar una corriente eléctrica a través del agua salada. Enjuagado por el desagüe, el estearato de sodio reacciona con el calcio en agua para formar un sólido, el estearato de calcio, el sólido blanco que compone el “anillo de bañera”. Esto elimina el jabón del agua y el estearato de calcio no tóxico sufre fácilmente biodegradación para que no persista en el ambiente.


