4.2: Electrones involucrados en enlaces químicos y octetos de electrones
- Page ID
- 69916
Los electrones en la capa más externa de los átomos son los que se involucran en enlaces químicos. A estos se les llama electrones de valencia. Refiérase a los símbolos de Lewis de los elementos mostrados en la Figura 3.9. Obsérvese que los tres elementos a la derecha de la tabla son gases nobles que están químicamente contenidos con sus capas de electrones exteriores rellenas que contienen 2 electrones en el caso del helio y 8 cada uno para neón y argón. Como base para la comprensión de los enlaces químicos, considere que los otros elementos tienden a alcanzar las capas de electrones llenos de sus gases nobles vecinos más cercanos al compartir, perder o ganar electrones. De estos elementos, el único que consideraremos en detalle que alcanza una configuración electrónica similar al helio es el hidrógeno, H, cada átomo del cual casi siempre tiene acceso a 2 electrones compartidos en enlaces covalentes. Los otros elementos que consideraremos, el carbono y superiores, alcanzan 8 electrones en sus capas externas por unión química. Esta es la base de la regla del octeto, la tendencia de los átomos a alcanzar capas externas estables de 8 electrones mediante la formación de enlaces químicos. La regla del octeto es inmensamente útil para explicar y predecir los enlaces químicos y las fórmulas y estructuras de los compuestos químicos y se enfatizará en este capítulo.
Algunos ejemplos de los tipos de disposiciones de unión discutidos anteriormente ya se han ilustrado en el Capítulo 3. La Figura 3.1 ilustra que, incluso en la forma elemental, H2, los átomos de hidrógeno tienen 2 electrones de valencia en la molécula diatómica. También se mostraron ejemplos de elementos que tienen 8 electrones de valencia como resultado de la unión química. La Figura 3.6 ilustra los dos átomos de N en la molécula de N2 que comparten 6 electrones en un enlace covalente de manera que cada uno de los átomos puede tener un octeto. La Figura 3.8 muestra que 2 átomos de Cl, cada uno con 7 electrones de valencia, comparten 2 electrones en el enlace covalente de la molécula de Cl 2 para alcanzar octetos. La misma figura muestra que Na pierde su electrón de valencia única en la formación de NaCl iónico para producir el ion Na +, que tiene un octeto de electrones en su capa externa. Al formar el mismo compuesto iónico, Cl gana un electrón para convertirse en el anión Cl -, que también tiene un octeto estable de electrones de capa externa.
En lo que resta de este capítulo, se utilizará la regla del octeto para explicar la formación de compuestos químicos consistentes en dos o más elementos diferentes unidos entre sí. Ya se utilizó para mostrar el enlace en cloruro de sodio iónico en la Figura 3.8. Uno de los mejores compuestos para mostrar la regla del octeto en compuestos covalentes es el metano, CH 4, mostrado en la Figura 4.1. La molécula de CH 4 se produce cuando un átomo de carbono con 4 electrones externos (ver Figura 3.9) alcanza un octeto de 8 electrones al compartir con átomos de H.
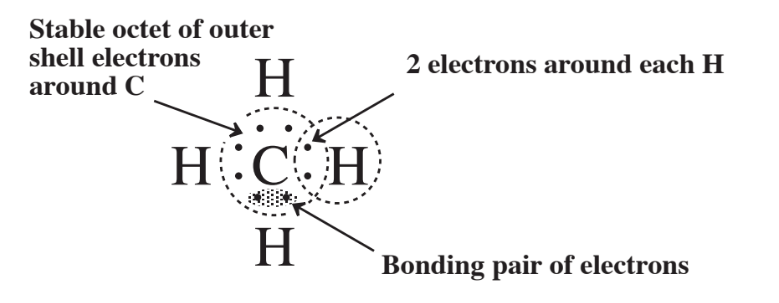
Cada átomo de H tiene 1 electrón para donar al arreglo de compartición, por lo que por cada uno de los 4 átomos de H que aportan un electrón el átomo de carbono puede ganar un octeto. Cada uno de los átomos de H tiene acceso a 2 electrones en el enlace covalente sencillo que lo conecta con el átomo de C. El examen de la Figura 4.1 implica que los 4 átomos de H y el átomo de C se encuentran todos en el mismo plano en una estructura plana. Pero ese no es el caso debido a la tendencia de que los 4 pares de electrones que componen los 4 enlaces covalentes se orienten lo más lejos posible unos de otros alrededor de la esfera del átomo de carbono. La estructura resultante es un poco difícil de ilustrar en papel, pero una forma de aproximarla es con un modelo de bola y palo que representa los átomos como bolas y los enlaces químicos como barras que conectan los átomos. La Figura 4.2 es una ilustración del modelo de bola y palo de CH 4.


