4.5: Enlaces covalentes en compuestos
- Page ID
- 69903
Consideremos a continuación algún ejemplo de enlaces covalentes entre átomos de algunos de los elementos más ligeros. Éstas se entienden mejor en referencia a la Figura 3.9, la versión abreviada de la tabla periódica que muestra los símbolos de Lewis (electrones de valencia de capa externa) de los primeros 20 elementos. Como es el caso de los iones, los átomos que están unidos covalentemente en moléculas suelen tener una disposición de electrones de capa externa como la del gas noble con un número atómico más cercano al elemento en cuestión. Se acaba de ver que los átomos de H unidos covalentemente en moléculas de H 2 tienen 2 electrones de capa externa como el helio de gas noble cercano. Para los átomos de muchos otros elementos, la tendencia es adquirir 8 electrones de la capa externa, un octeto, al compartir electrones a través de enlaces covalentes. Esta tendencia forma la base de la regla del octeto que se discute en la Sección 4.2. Al ilustrar la aplicación de la regla del octeto al enlace covalente, la Sección 4.7 considera primero el enlace de átomos de hidrógeno a átomos de elementos con números atómicos del 6 al 9 en el segundo periodo de la tabla periódica.
Estos elementos están cerca del neón de gas noble y tienden a alcanzar un octeto “similar al neón” de electrones de la capa exterior cuando forman moléculas unidas covalentemente.
Los enlaces covalentes se caracterizan de acuerdo con varios criterios. El primero de ellos es el número de electrones involucrados. El tipo más común de enlace covalente consiste en 2 electrones compartidos y es un enlace sencillo. Cuatro electrones compartidos como se muestra para el enlace que une un átomo de O a uno de los átomos de C en la estructura del anión acetato anterior constituyen un doble enlace covalente. Y 6 electrones compartidos como se muestra para el enlace covalente muy estable que une los dos átomos de N en la molécula N 2 ilustrada en el Capítulo 3, Figura 3.6 conforman un triple enlace covalente. Estos enlaces se muestran convencionalmente como líneas en las fórmulas estructurales de las moléculas (un gran número de puntos en una fórmula puede resultar un poco confuso). Entonces el enlace covalente sencillo en H 2 se muestra como
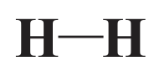
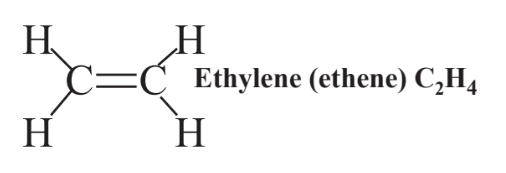
El doble enlace que consiste en 4 electrones compartidos que mantienen los dos átomos de carbono juntos en C 2H 4 (etileno, un hidrocarburo utilizado para hacer plástico de polietileno) se muestran de la siguiente manera:
Y el triple enlace muy fuerte que une los dos átomos de N en la molécula N 2 se muestran por tres líneas:

Los enlaces covalentes tienen una longitud de enlace característica. Las longitudes de los enlaces son de la magnitud general del tamaño de los átomos, por lo que se miden en unidades de picometros (pm). El enlace H-H en H 2 es de 75pm de largo.
Una tercera característica importante de los enlaces es la energía de enlace. La energía de enlace normalmente se expresa en kilojulios (kJ) requeridos para romper un mol (6.02×10 23) de enlaces. (Ver Sección 4.8 para una definición detallada de la mole.) La energía de enlace del enlace H-H en H 2 es igual a 435 kJ/mol. Esto significa que una cantidad de energía requerida para romper todos los enlaces H-H en un mol de H 2 (2.0 gramos de H 2, 6.02×10 23 moléculas) es de 435 kJ muy sustancial.


