4.4: Enlaces covalentes en H2 y otras moléculas
- Page ID
- 69938
Los símbolos de Lewis se pueden usar para mostrar cómo algunos átomos de elementos en el lado izquierdo de la tabla con solo uno o dos electrones de capa exterior pueden perder esos electrones para formar cationes como Na + o Ca 2 +. También se ve fácilmente que los átomos de grupos cercanos al lado derecho de la tabla periódica pueden aceptar uno o dos electrones para ganar octetos estables y convertirse en aniones como Cl -u O 2-. Pero, es difícil a imposible tomar más de dos electrones lejos de un átomo para formar cationes con cargas mayores a +2 o agregar 3 o más electrones para formar aniones con cargas de -3 o incluso más negativas, aunque sí existen iones como Al 3 + y N 3-. Entonces los átomos de elementos en el centro de la tabla periódica y los no metales de la derecha tienen una tendencia a compartir electrones en enlaces covalentes, en lugar de convertirse en iones.
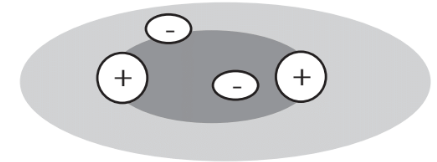
Se visualiza fácilmente cómo los iones mutuamente atrayentes de carga opuesta se mantienen juntos en una red cristalina. Los electrones compartidos en enlaces covalentes actúan para reducir las fuerzas de repulsión entre los núcleos cargados positivamente de los átomos que unen. Eso se ve más fácilmente para el caso de la molécula de hidrógeno, H 2. Los núcleos de los átomos de H consisten en protones individuales, y los dos núcleos de átomos de H en la molécula H 2 se repelen entre sí. Sin embargo, sus 2 electrones compartidos componen una nube de carga negativa entre los dos núcleos H, lo que protege a los núcleos de la carga positiva que repele el uno del otro y permite que la molécula exista como una molécula unida covalentemente (Figura 4.7).