5.7: Reacciones de Oxidación-Reducción y Química Verde
- Page ID
- 69869
Muchas reacciones, incluyendo algunas de las dadas en la sección anterior, son reacciones de oxidación-reducción, frecuentemente llamadas reacciones redox. Este nombre deriva del uso prolongado de la oxidación para describir la reacción de una sustancia con el oxígeno. Considere la siguiente reacción de calcio elemental con oxígeno elemental:
\[\ce{2Ca + O2 \rightarrow 2CaO}\]
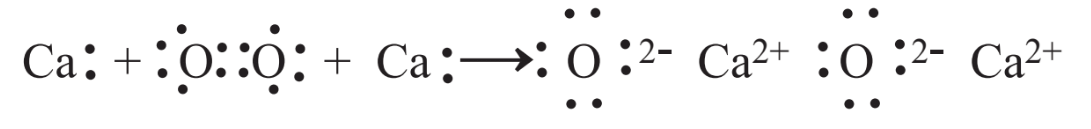
Combinando con oxígeno, el Ca se oxida. Siempre que algo se oxida, algo más tiene que ser reducido. En este caso, el oxígeno elemental se reduce para producir el ion óxido, O2-en CaO. Se ve a partir de esta reacción que los átomos de calcio pierden electrones cuando se oxidan y los átomos de oxígeno ganan electrones. Esto lleva a otra definición de reacciones de oxidación-reducción, que es que cuando una especie química pierde electrones en una reacción química se oxida y cuando una especie gana electrones se reduce.
El hidrógeno elemental está comúnmente involucrado en la oxidación-reducción. Siempre que una especie química reacciona con hidrógeno elemental, se reduce. Como ejemplo, el óxido de hierro (II), FeO, puede hacerse reaccionar con hidrógeno elemental,
\[\ce{FeO + H2 \rightarrow Fe + H2O}\]
En este caso el Fe en FeO se reduce a hierro metálico y el hidrógeno en H 2 elemental se oxida a H 2 O.
Cuando el oxígeno elemental reacciona para producir oxígeno químicamente combinado, está actuando como agente oxidante y se reduce. Y cuando el hidrógeno elemental reacciona para producir hidrógeno químicamente combinado, actúa como agente reductor y se oxida. Considera lo que sucede cuando ocurren las reacciones opuestas. Cuando se libera oxígeno químicamente combinado como oxígeno elemental a partir de una reacción química, el oxígeno se oxida. Y cuando se libera hidrógeno elemental como resultado de una reacción química, se reduce el hidrógeno. Una buena ilustración de estas definiciones puede verse cuando se hace pasar una corriente eléctrica continua entre dos electrodos metálicos a través del agua hecha eléctricamente conductora disolviendo en ella una sal, como Na 2 SO 4 como se muestra en la Figura 5.1. En el electrodo izquierdo, los electrones son bombeados al sistema reduciendo el H unido químicamente en H 2 O a H 2 elemental. Un electrodo en el que se produce la reducción se llama cátodo. En el otro electrodo, se eliminan electrones del sistema, se libera el elemental O 2 y se oxida el oxígeno en H 2 O. Un electrodo en el que ocurre la oxidación se llama ánodo.
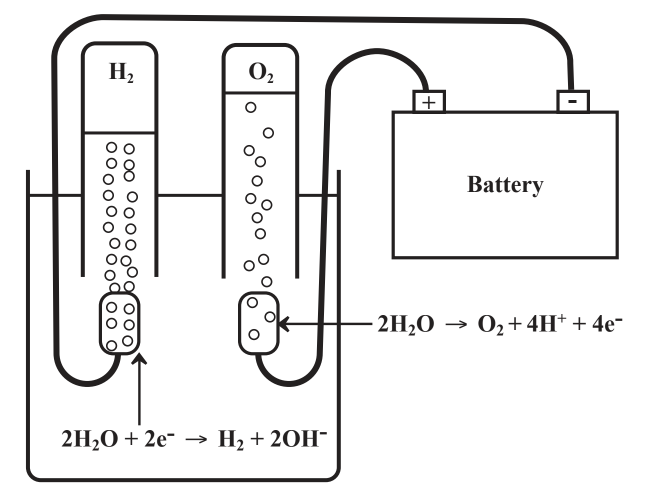
Figura 5.1. Electrólisis de agua que contiene algo de sal disuelta para hacerla conductora eléctrica. En el electrodo izquierdo (cátodo) H en H 2 O se reduce añadiendo electrones liberando H 2 gas. En el electrodo derecho (ánodo) los electrones se eliminan del O unido químicamente en H 2 O liberando el elemental O 2 y el oxígeno se oxida.
La reacción mostrada anteriormente es una reacción de electrólisis. Es muy significativo en la práctica de la química verde porque es un medio para obtener hidrógeno puro y oxígeno puro del agua sin el uso de ningún otro reactivos químicos. Por ejemplo, usando una fuente de energía no contaminante, como la energía eólica, se puede generar hidrógeno elemental para su uso en celdas de combustible no contaminantes (ver Figura 3.2 y Capítulo 16)
Las reacciones de oxidación-reducción son muy significativas en los procesos de conversión de energía. Un ejemplo importante es la fotosíntesis,
\[\ce{6CO2 + 6H2O + h \nu \rightarrow C6H12O6 + 6O2}\]
en el que la energía solar (\(h \nu\)) de la luz solar es utilizada por las plantas para producir azúcar de glucosa, C 6 H 12 O 6, un compuesto de alta energía que es utilizado por los organismos para proporcionar energía para sus necesidades metabólicas. Dado que se produce oxígeno elemental, el oxígeno se oxida. Aunque no es obvio con base en la discusión de oxidación-reducción hasta el momento, el carbono se reduce; el carbono en el producto C 6 H 12 O 6 se reduce en comparación con el carbono en el reactivo CO 2. El reverso de esta reacción que se muestra al inicio de este capítulo es
\[\ce{C6H12O6 + 6O2 \rightarrow 6CO2 + 6H2O + energy}\]
que ocurre cuando los organismos, incluidos los humanos, utilizan azúcar de glucosa para producir energía. En este caso, el oxígeno reacciona, un proceso de oxidación obvio. El oxígeno se reduce y el carbono se oxida por la acción del oxígeno elemental.
Una reacción de oxidación-reducción muy común ocurre cuando los combustibles fósiles se queman para producir energía. Una de esas reacciones ocurre cuando se quema gas natural (metano, CH 4),
\[\ce{CH4 + 2O2 \rightarrow CO2 + 2H2O + energy}\]
para producir dióxido de carbono y agua, liberando energía. La quema de gasolina, combustible diesel, carbón, madera e incluso gas hidrógeno son reacciones de oxidación-reducción en las que el carbono o el hidrógeno se oxidan por la acción del oxígeno produciendo energía utilizable.
Las reacciones de oxidación-reducción son los tipos de reacciones más importantes considerados en la química verde. Eso es cierto en parte debido al papel central que desempeña actualmente la oxidación de los combustibles fósiles y otros materiales en la producción de la energía necesaria para los procesos químicos. Además, la materia prima más común actualmente utilizada para la fabricación de plásticos, telas sintéticas y otros materiales manufacturados es el hidrocarburo de petróleo. Hay muchos compuestos hidrocarbonados que contienen carbono e hidrógeno unidos químicamente. Un compuesto típico de este tipo es etano, C 2 H 6. El hidrógeno y el carbono en un hidrocarburo están en la forma más reducida químicamente, pero las materias primas requeridas a menudo son hidrocarburos parcialmente oxidados en los que los átomos de O están unidos al hidrocarburo (la oxidación completa de un hidrocarburo produce CO 2 y H 2 O). El etanol, C 2 H 6 O, utilizado en síntesis química y como aditivo oxigenado para hacer que la gasolina se queme más suavemente con emisión de menos contaminantes del aire es un hidrocarburo parcialmente oxidado.
Grandes cantidades de materiales y energía se gastan en la conversión de hidrocarburos de petróleo en compuestos parcialmente oxidados utilizados como materias primas. Por ejemplo, el etanol se puede hacer a partir de etano tomado de petróleo y gas natural mediante una serie de reacciones químicas para las cuales el proceso neto es el siguiente:
\[\ce{2C2H6 + O2 \rightarrow 2C2H6O}\]
Esta transformación requiere condiciones relativamente severas y una pérdida neta de energía. Una alternativa más ecológica es usar azúcar de glucosa producida por fotosíntesis (Reacción 5.7.3) para cultivar levaduras que producen un producto de etanol
\[\ce{C6H12O6 \rightarrow 2C2H6O + 2CO2}\]
un proceso que ocurre bajo condiciones de temperatura ambiente. Además de elaborar etanol, este proceso de fermentación produce dióxido de carbono en forma concentrada que puede ser utilizado para bebidas carbonatadas, disolvente de dióxido de carbono supercrítico o bombeado bajo tierra para la recuperación terciaria de petróleo. La biomasa de levadura rica en proteínas producida en la fermentación hace un buen aditivo para la alimentación animal.


