5.12: Titulaciones - Medición de Moles por Volumen de Solución
- Page ID
- 69868
Las masas se miden comúnmente con una balanza de laboratorio que se registra en gramos. Las masas de productos químicos industriales se miden con escalas industriales mucho más grandes que comúnmente dan masas en kilogramos o toneladas. Al hacer mediciones estequiométricas de laboratorio con especies en solución, a menudo es conveniente medir volúmenes de solución en lugar de masas de reactivos. Se pueden preparar soluciones que contengan números conocidos de moles por unidad de volumen de solución. El volumen del reactivo que debe agregarse a otro reactivo para sufrir una reacción en particular se puede medir con un dispositivo llamado bureta. En la Figura 5.3 se muestra una bureta. Al medir el volumen de una solución de concentración conocida de soluto requerida para reaccionar con otro reactivo, se puede calcular el número de moles de soluto que reacciona y se pueden realizar cálculos estequiométricos basados en la reacción. Este procedimiento se utiliza comúnmente en análisis químicos y se llama titulación.
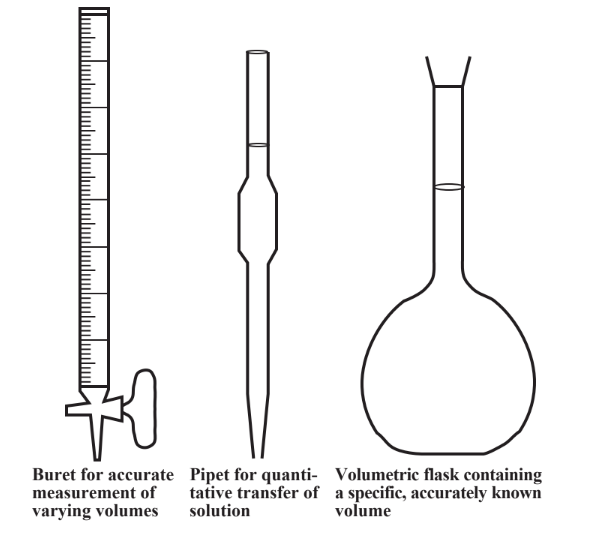
Es especialmente fácil relacionar volúmenes de soluciones estequiométricamente cuando las concentraciones de la solución se expresan como concentración molar, M. Esta unidad de concentración se define como
\[\textrm{M} = \frac{\textrm{moles of solute}}{\textrm{number of liters of solution}}\]
El número de moles de una sustancia, en este caso los moles de soluto, está relacionado con la masa de la sustancia por
\[\textrm{Moles of solute} = \frac{\textrm{moles of solute}}{\textrm{molar mass of solute, g/mol}}\]
Estas dos relaciones se pueden combinar para dar la siguiente ecuación útil:
\[\textrm{M} = \frac{\textrm{mass of solute}}{\textrm{(molar mass of solute)} \times \textrm{(number of liters of solution)}}\]
Una solución de concentración conocida que se añade a una mezcla de reacción durante el procedimiento de titulación es una solución estándar. Una de las más comunes es una solución base estándar de hidróxido de sodio, NaOH. Por lo general, la concentración de hidróxido de sodio en dicha solución estándar es de 0.100 mol/L Supongamos que se desea hacer exactamente 2 litros de una solución de 0.100mol/L de hidróxido de sodio. ¿Qué masa de NaOH, masa molar 40.0 g/mol, se disuelve en esta solución? Para hacer este cálculo, utilice la Ecuación 5.12.3 reorganizada para resolver para masa de soluto:
\[\textrm{Mass NaOH} = \textrm{M} \times \textrm{(molar mass NaOH)} \times \textrm{(liters NaOH)}\]
\[\textrm{Mass NaOH} = 0.100 \textrm{ mol/L} \times 40.0 \textrm{ g/mol} \times 2.00 \textrm{ L} = 8.00 \textrm{ g NaOH}\]
Un procedimiento de titulación común es usar una solución estándar de base para valorar una solución desconocida de ácido o usar ácido estándar para determinar la base. Como ejemplo considere un análisis de ácido de una muestra de agua utilizada para fregar los gases de escape de un incinerador hospitalario. El agua es ácida por la presencia de ácido clorhídrico producido por el lavado de gas HCl del gas de chimenea del incinerador donde se produjo el HCl en la quema de cloruro de polivinilo en el incinerador. Supongamos que se tomó una muestra de 100 mL del agua del depurador para valoración con un NaOH estándar de 0.125 mol/L y que el volumen de NaOH estándar consumido fue de 11.7 mL. ¿Cuál fue la concentración molar de HCl en el agua del depurador de gases de la pila? Para resolver este problema es necesario saber que la reacción entre NaOH y HCl es,
\[\ce{NaOH + HCl \rightarrow NaCl + H2O}\]
una reacción de neutralización en la que se producen agua y una sal, NaCl. El examen de la reacción muestra que 1 mol de HCl reacciona por cada mol de NaOH. La Ecuación 5.12.1 se aplica tanto a la solución estándar de NaOH como a la solución de HCl que se está valorando dando lugar a las siguientes ecuaciones:
\[M_{HCl} = \frac{moles_{HCl}}{liters_{HCl}} = \textrm{and M}_{NaOH} = \frac{moles_{NaOH}}{liters_{NaOH}}\]
Cuando se ha agregado exactamente suficiente NaOH para reaccionar con todo el HCl presente, la reacción se completa sin exceso de HCl ni NaOH. En una titulación este punto final se muestra normalmente por el cambio de color de un colorante llamado indicador disuelto en la solución que se está valorando. En el punto final moles HCl = moles NaOH y las dos ecuaciones anteriores pueden resolverse para dar,
\[\textrm{M}_{\textrm{HCl}} \times \textrm{liters}_{\textrm{HCl}} = \textrm{M}_{\textrm{NaOH}} \times \textrm{liters}_{\textrm{NaOH}}\]
que se puede utilizar para dar la concentración molar de HCl:
\[\textrm{M}_{\textrm{HCl}} = \frac{\textrm{M}_{\textrm{NaOH}} \times \textrm{liters}_{\textrm{NaOH}}}{\textrm{liters}_{\textrm{HCl}}}\]
La conversión de los volúmenes dados de mL a litros y la sustitución en esta ecuación da la concentración molar de HCl en el agua del depurador del incinerador:
\[\textrm{M}_{\textrm{HCl}} = \frac{0.125 \textrm{mol/L} \times 0.0117 \textrm{L}}{0.100 \textrm{ L}} = 0.0146 \textrm{mol/L}\]
Determinación de la composición porcentual por titulación
Una aplicación útil de valoración, o análisis titrimétrico como se le llama, es determinar el porcentaje de una sustancia en una muestra sólida que reaccionará con el valorante. Para ver cómo se hace esto, considere una muestra que consiste en cal básica, Ca (OH) 2, y suciedad con una masa de 1.26 g. Utilizando la titulación con una solución ácida estándar es posible determinar la masa de Ca (OH) 2 básico en la muestra y a partir de eso calcular el porcentaje de Ca (OH) 2 en la muestra. Supongamos que la muestra sólida se coloca en agua y se titula con 0.112 mol/L HCl estándar, requiriendo un volumen de 42.2 mL (0.0422 L) del ácido para llegar al punto final. El Ca (OH) 2 reacciona con el HCl
\[\ce{Ca(OH)2 + 2HCl \rightarrow CaCl2 + 2H2O}\]
mientras que la suciedad no reacciona. El examen de esta reacción muestra que en el punto final la relación molar
\[\frac{\textrm{1 mol Ca(OH)}_{2}}{\textrm{2 mol HCl}}\]
aplica. En el punto final, el número de moles de HCl se puede calcular a partir de
\[\textrm{Mol}_{\textrm{HCl}} = \textrm{liters}_{\textrm{HCl}} \times \textrm{M}_{\textrm{HCl}}\]
y, dado que la masa molar de Ca (OH) 2 es 74.1 (dadas las masas atómicas 40.1, 16.0 y 1.0 para Ca, O y H, respectivamente), la masa de Ca (OH) 2 viene dada por
\[\textrm{Mass}_{\textrm{Ca(OH)}_{2}} = \textrm{moles}_{\textrm{Ca(OH)}_{2}} \times \textrm{molar mass}_{\textrm{Ca(OH)}_{2}}\]
Con esta información ahora es posible calcular la masa de Ca (OH) 2:
\[\textrm{Mass}_{\textrm{Ca(OH)}_{2}} = \textrm{mol}_{\textrm{Ca(OH)}_{2}} \times \frac{\textrm{74.1 g Ca(OH)}_{2}}{\textrm{1 mol Ca(OH)}_{2}}\]
\[\textrm{Mass}_{\textrm{Ca(OH)}_{2}} = \underbrace{\textrm{Liters}_{\textrm{HCl}} \times \textrm{M}_{\textrm{HCl}}}_{\textrm{Moles HCl reacting}} \times \underbrace{\frac{\textrm{1 mol Ca(OH)}_{2}}{\textrm{2 mol HCl}}}_{\textrm{Converts from moles HCl to moles Ca(OH)}_{2}} \times \underbrace{\frac{\textrm{74.1 g Ca(OH)}_{2}}{\textrm{1 mol Ca(OH)}_{2}}}_{\textrm{Gives mass Ca(OH)}_{2} \textrm{from moles Ca(OH)}_{2}}\]
\[\textrm{Mass}_{\textrm{Ca(OH)}_{2}} = 0.0422 \textrm{L HCl} \times \frac{\textrm{0.112 mol HCl}}{\textrm{1 L HCl}} \times \frac{\textrm{1 mol Ca(OH)}_{2}}{\textrm{2 mol HCl}} \times \frac{\textrm{74.1 g Ca(OH)}_{2}}{\textrm{1 mol Ca(OH)}_{2}}\]
\[\textrm{Mass Ca(OH)}_{2} = 0.175 \: g\]
\[\textrm{Percent}_{\textrm{Ca(OH)}_{2}} = \frac{\textrm{mass Ca(OH)}_{2}}{\textrm{mass sample}} \times \frac{0.175g}{1.26g} \times 100 = 13.9 \%\]
Ejercicio
Ejercicio: Se disolvió una muestra de 0.638 g compuesta por ácido oxálico, H 2 C 2 O4 y oxalato de sodio, Na 2 C 2 O 4 y se tituló con 0.116 mol/L de hidróxido de sodio, de los cuales se requirieron 47.6mL (0.0476 L). Cada molécula de H 2 C 2 O 4 libera 2 iones H +. Calcular el porcentaje de ácido oxálico en la muestra.
- Responder
-
38.9%


