6.2: Compuestos de Carbono e Hidrógeno - Hidrocarburos
- Page ID
- 70071
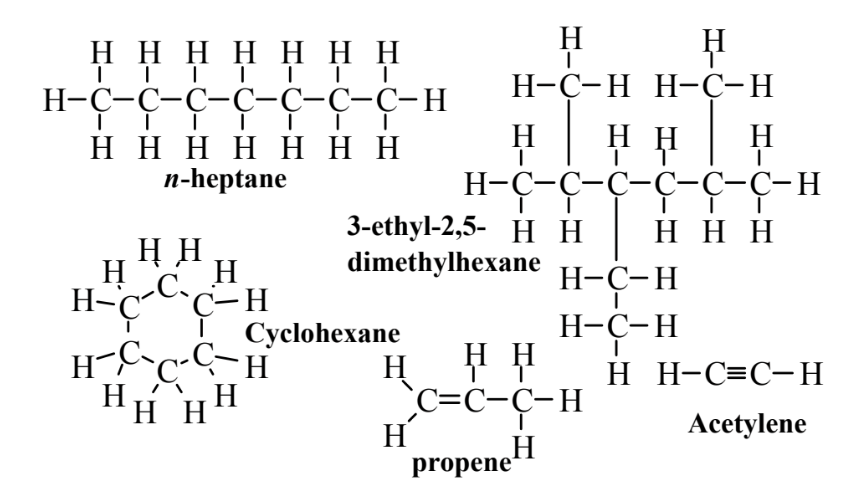
La tremenda variedad y diversidad de la química orgánica se debe a la capacidad de los átomos de carbono para unirse entre sí en una variedad de cadenas rectas, cadenas ramificadas y anillos y de átomos de carbono adyacentes para unirse por enlaces simples, dobles o triples. Esta capacidad de unión se puede ilustrar con la clase más simple de productos químicos orgánicos, los hidrocarburos que consisten solo en hidrógeno y carbono. La Figura 6.1 muestra algunos hidrocarburos en diversas configuraciones. Los hidrocarburos son los principales ingredientes del petróleo y se bombean desde el suelo como petróleo crudo o se extraen como gas natural. Tienen dos usos principales. El primero de ellos es la combustión como fuente de combustible. El hidrocarburo más abundante en gas natural, metano, CH 4, se quema en hornos domésticos, centrales eléctricas e incluso en motores de vehículos,
\[\ce{CH4 + 2O2 \rightarrow CO2 + 2H2O + heat energy}\]
para proporcionar energía. El segundo uso importante de hidrocarburos es como materia prima para la fabricación de caucho, plásticos, polímeros y muchos otros tipos de materiales. Dado el valor de los hidrocarburos como material, es lamentable que gran parte de la producción de hidrocarburos se queme simplemente para proporcionar energía, la cual podría ser generada por otros medios.
Hay varias clases principales de hidrocarburos, todos compuestos solo por hidrógeno y carbono. Los alcanos solo tienen enlaces simples entre los átomos de carbono. Ciclohexano, n-heptano y 3-etil-2,5-dimetilhexano en la Figura 6.1 son alcanos; el ciclohexano es un hidrocarburo cíclico. Los alquenos, como el propeno que se muestra en la Figura 6.1, tienen al menos un doble enlace que consiste en 4 electrones compartidos entre dos de los átomos de carbono en la molécula. Los alquinos tienen al menos un triple enlace entre los átomos de carbono en la molécula como se muestra para el acetileno en la Figura 6.1. El acetileno es un combustible importante para soldar y cortar antorchas; de lo contrario, los alquinos son de relativamente poca importancia y no se abordarán más. Una cuarta clase de hidrocarburo consiste en compuestos aromáticos que tienen anillos de átomos de carbono con propiedades de unión especiales como se discute más adelante en este capítulo
Alcanos
Las fórmulas moleculares de alcanos no cíclicos son CnH2n+2. Al contar los números de átomos de carbono e hidrógeno en las moléculas de alcanos que se muestran en la Figura 6.1, se observa que la fórmula molecular de n-heptano es C7 H 6 y la de 3-etil-2,5-dimetilhexano es C 10 H 22, ambas de las cuales se ajustan al general fórmula dada anteriormente. La fórmula general de los alcanos cíclicos es C n H 2n; la del ciclohexano, el alcano cíclico más común, es C 6 H 12. Estas fórmulas son fórmulas moleculares, que dan el número de átomos de carbono e hidrógeno en cada molécula, pero no dicen nada sobre la estructura de la molécula. Las fórmulas dadas en la Figura 6.1 son fórmulas estructurales que muestran cómo se ensambla la molécula. La estructura del n- heptano es la de una cadena lineal de átomos de carbono; cada átomo de carbono en el centro de la cadena está unido a 2 átomos de H y los 2 átomos de carbono en los extremos de la cadena están unidos cada uno a 3 átomos de H. El prefijo hep en el nombre denota 7 átomos de carbono y el n- indica que el compuesto consiste en una sola cadena lineal. Este compuesto puede ser representado por una fórmula estructural condensada como CH 3 (CH 2) 5 CH 3 que representa 7 átomos de carbono en una cadena lineal. Además del metano mencionado anteriormente, los alcanos inferiores incluyen los siguientes:
Etano: CH 3 CH 3 Propano: CH 3 CH 2 CH 3 Butano: CH 3 (CH 2) 2 CH 3 n- Pentano: CH 3 (CH 2) 3CH 3
Para alcanos con 5 o más átomos de carbono, el prefijo (pluma para 5, hex para 6, hept para 7, oct para 8, no para 9) muestra el número total de átomos de carbono en el compuesto y n- puede usarse para denotar un alcano de cadena lineal. También se pueden usar fórmulas estructurales condensadas para representar alcanos de cadena ramificada. La fórmula estructural condensada del 3-etil-2,5-dimetilhexano es
CH 3 CH (CH 3) CH (C 2 H 5) CH 2 CH (CH 3) CH 3
En esta fórmula, los átomos de C y sus átomos de H unidos que no están entre paréntesis muestran carbonos que forman parte de la cadena principal de hidrocarburos. El (CH 3) después del segundo C en la cadena muestra un grupo metilo unido a él, el (C 2 H 5) después del tercer átomo de carbono en la cadena muestra un grupo etilo unido a él, y el (CH 3) después del quinto átomo de carbono en la cadena muestra un grupo metilo unido a él .
Los compuestos que tienen las mismas fórmulas moleculares pero diferentes fórmulas estructurales son isómeros estructurales. Por ejemplo, el alcano de cadena lineal con la fórmula molecular C 10 H 22 es n- decano
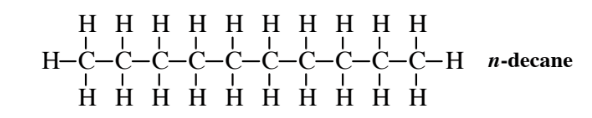
que es un isómero estructural de 3-etil-2,5-dimetilhexano.
Los nombres de los compuestos orgánicos se basan comúnmente en la estructura del hidrocarburo del que se derivan utilizando la cadena continua más larga de átomos de carbono en el compuesto como base para el nombre. Por ejemplo, la cadena continua más larga de átomos de carbono en 3-etil-2,5-dimetilhexano que se muestra en la Figura 6.1 es de 6 átomos de carbono, por lo que el nombre se basa en el hexano. Los nombres de las ramas de la cadena también se basan en los alcanos de los que se derivan. Como se indica a continuación,
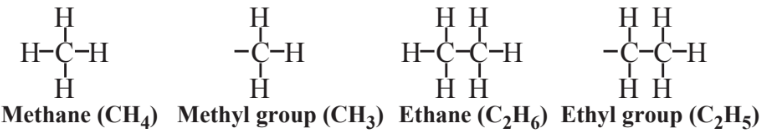
los dos alcanos de cadena más corta son metano con 1 átomo de carbono y etano con 2 átomos de carbono. La eliminación de 1 de los átomos de H del metano da el grupo metilo y la eliminación de 1 de los átomos de H del etano da el grupo etilo. Estos términos se utilizan en el nombre 3-etil-2,5-dimetilhexano para mostrar grupos unidos a la cadena básica del hexano. Los átomos de carbono en esta cadena se numeran secuencialmente de izquierda a derecha. Un grupo etilo está unido al 3er átomo de carbono, produciendo la parte “3-etilo” del nombre, y los grupos metilo están unidos a los átomos de carbono 2do y 5to, lo que da la parte “2,5-dimetil” del nombre.
Los nombres discutidos anteriormente son nombres sistemáticos, los cuales se basan en las fórmulas estructurales reales de las moléculas. Además, existen nombres comunes de compuestos orgánicos que no indican las fórmulas estructurales. Nombrar compuestos orgánicos es un tema complejo, y aquí no se intenta enseñarlo al lector. Sin embargo, a partir de los nombres de los compuestos dados en este y en capítulos posteriores, se debe obtener cierta apreciación de la justificación de los nombres de compuestos orgánicos.
Aparte de quemarlos para obtener energía, el tipo principal de reacción con alcanos consiste en reacciones de sustitución tales como,
\[\ce{C2H6 + 2Cl2 \rightarrow C2H4Cl2 + 2HCl}\]
en el que uno o más átomos de H son desplazados por otro tipo de átomo. Este es normalmente el primer paso para convertir alcanos en compuestos que contienen elementos distintos de carbono o hidrógeno para su uso en la síntesis de una amplia variedad de compuestos orgánicos.
Alquenos
Cuatro alquenos comunes se muestran en la Figura 6.2. Los alquenos tienen al menos un doble enlace C=C por molécula y pueden tener más. El primero de los alquenos de la Figura 6.2, etileno, es un hidrocarburo muy ampliamente producido que se utiliza para sintetizar plástico de polietileno y otros compuestos orgánicos. Alrededor de 25 mil millones de kilogramos (kg) de etileno se procesan en Estados Unidos cada año. Alrededor de 14.5 mil millones de kg de propileno se utilizan en Estados Unidos cada año para producir plástico de polipropileno y otros productos químicos. Los dos compuestos de 2-buteno ilustran un aspecto importante de los alquenos, la posibilidad de isomerismo cis-trans. Mientras que los átomos de carbono y los grupos sustituidos en ellos unidos por enlaces simples pueden rotar libremente entre sí como si estuvieran unidos por un solo eje, los átomos de carbono conectados por un doble enlace se comportan como si estuvieran unidos por dos ejes paralelos y no son libres de rotar. Entonces, cis- 2-buteno en el que los dos grupos metilo terminales (-CH3) están en el mismo lado de la molécula es un compuesto diferente del trans- 2-buteno en el que están en lados opuestos. Estos dos compuestos son isómeros cis-trans
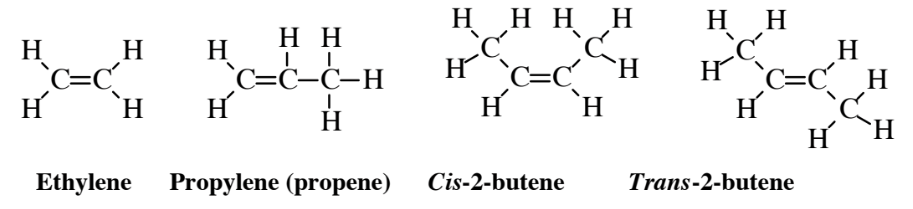
Los alquenos son químicamente mucho más activos que los alcanos. Esto se debe a que el doble enlace es insaturado y tiene electrones disponibles para formar enlaces adicionales con otros átomos. Esto conduce a reacciones de adición en las que se agrega una molécula a través de un doble enlace. Por ejemplo, la adición de H 2 O a etileno
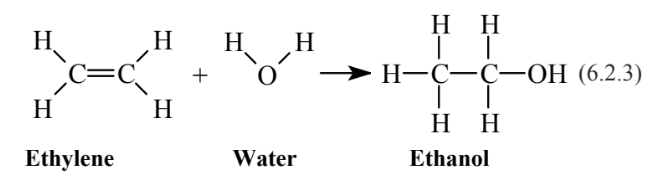
produce etanol, el mismo tipo de alcohol que se encuentra en las bebidas alcohólicas. Además de agregar inmensamente a la versatilidad química de los alquenos, las reacciones de adición los hacen bastante reactivos en la atmósfera durante la formación de smog fotoquímico. La presencia de dobles enlaces también se suma a la actividad bioquímica y toxicológica de los compuestos en organismos
Debido a sus dobles enlaces, los alquenos pueden sufrir reacciones de polimerización en las que un gran número de moléculas individuales se suman entre sí para producir moléculas grandes llamadas polímeros (ver Sección 6.5). Por ejemplo, 3 moléculas de etileno se pueden sumar de la siguiente manera:
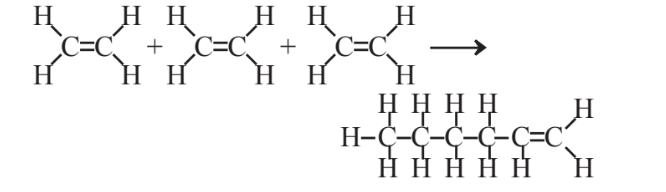
un proceso que puede continuar, formando cadenas cada vez más largas y dando como resultado la formación de moléculas enormes moléculas de polietileno
Hidrocarburos Aromáticos
Una clase especial de hidrocarburos consiste en anillos de átomos de carbono, que casi siempre contienen átomos de 6C, los cuales pueden verse como que tienen enlaces simples y dobles alternantes como se muestra a continuación:
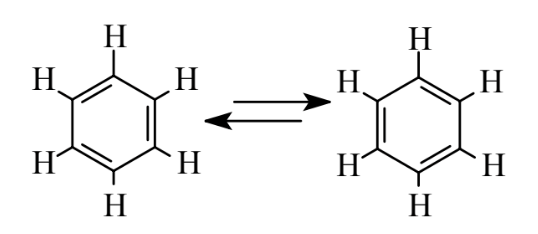
Estas estructuras muestran el hidrocarburo aromático más simple, benceno, C6H6. Aunque la molécula de benceno está representada con 3 dobles enlaces, químicamente difiere mucho de los alquenos, por ejemplo, experimentando reacciones de sustitución en lugar de reacciones de adición. Las propiedades de los compuestos aromáticos son propiedades especiales llamadas aromaticidad. Las dos estructuras mostradas anteriormente son estructuras de resonancia equivalentes, las cuales pueden verse como que tienen átomos que permanecen en los mismos lugares, pero en las que los enlaces que unen los átomos pueden desplazar posiciones con el movimiento de los electrones que componen los enlaces. Dado que el benceno tiene diferentes propiedades químicas de las implícitas por cualquiera de las estructuras anteriores, comúnmente se representa como un hexágono con un círculo en el medio:
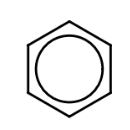
Muchos hidrocarburos aromáticos tienen dos o más anillos. El más simple de estos es el naftaleno,
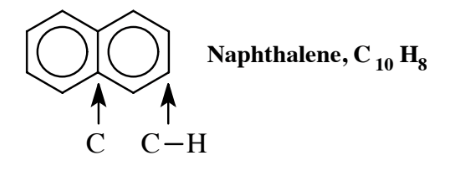
un compuesto de dos anillos en el que dos anillos de benceno comparten los átomos de carbono a los que están unidos; estos dos átomos de carbono no tienen ningún H unido, cada uno de los otros 8 átomos de C en el compuesto tiene 1 H unido. Los hidrocarburos aromáticos con múltiples anillos, llamados hidrocarburos aromáticos policíclicos, PAH, son comunes y a menudo se producen como subproductos de la combustión. Uno de los más estudiados es el benzo (a) pireno,
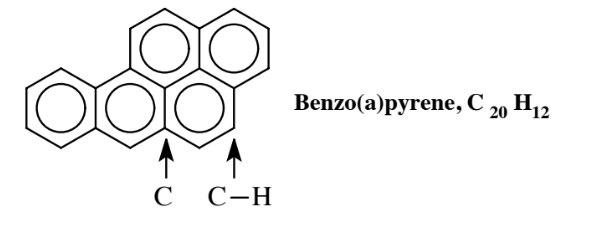
encontrado en humo de tabaco, gases de escape de diesel y carne asada a la brasa. Este compuesto es toxicológicamente significativo porque es parcialmente oxidado por enzimas en el cuerpo para producir un metabolito causante de cáncer.
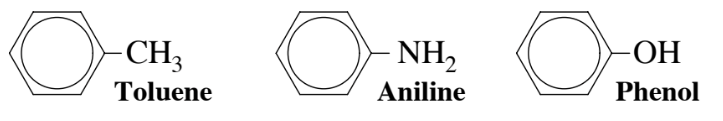
La presencia de grupos hidrocarbonados y de elementos distintos de carbono e hidrógeno unidos a un anillo de hidrocarburo aromático proporciona una variedad de compuestos aromáticos. A continuación se dan tres ejemplos de compuestos aromáticos comunes. El tolueno es ampliamente utilizado para la síntesis química y como solvente. La práctica de la química verde exige ahora sustituir tolueno por benceno siempre que sea posible porque se sospecha que el benceno causa leucemia, mientras que el organismo es capaz de metabolizar tolueno a metabolitos inofensivos (ver Capítulo 7). Alrededor de 850 millones de kg de anilina se elaboran en Estados Unidos cada año como intermedio en la síntesis de colorantes y otros químicos orgánicos. El fenol es un compuesto aromático que contiene oxígeno relativamente tóxico que, a pesar de su toxicidad para los humanos, fue el primer antiséptico utilizado en el siglo XIX.