7.7: Enzimas
- Page ID
- 69644
Recordemos del Capítulo 5, Sección 5.5, que los catalizadores son sustancias que aceleran una reacción química sin que ellos mismos se consuman en la reacción. La catálisis es uno de los aspectos más importantes de la química verde porque la capacidad de hacer que las reacciones vayan más rápidas, así como de manera más eficiente, segura, y específicamente significa que se utilizan menos energía y materias primas y se producen menos desechos. Los catalizadores bioquímicos llamados enzimas incluyen algunos de los catalizadores más sofisticados. Las enzimas aceleran las reacciones bioquímicas hasta de diez a cien millones de veces. A menudo permiten que se produzcan reacciones que de otra manera no se producirían, es decir, tienden a ser muy selectivas en las reacciones que promueven. Una de las mayores ventajas de las enzimas como catalizadores es que han evolucionado para funcionar bajo las condiciones benignas en las que existen los organismos. Este rango de temperatura óptimo es generalmente desde aproximadamente el punto de congelación del agua (0° C) hasta ligeramente por encima de la temperatura corporal (hasta aproximadamente 40° C). Las reacciones químicas van más rápido a temperaturas más altas, por lo que existe un interés considerable en enzimas aisladas de microorganismos que prosperan a temperaturas cercanas al punto de ebullición del agua (100° C) en piscinas de agua caliente calentadas por actividad térmica subterránea como las que se encuentran en el Parque Nacional Yellowstone.
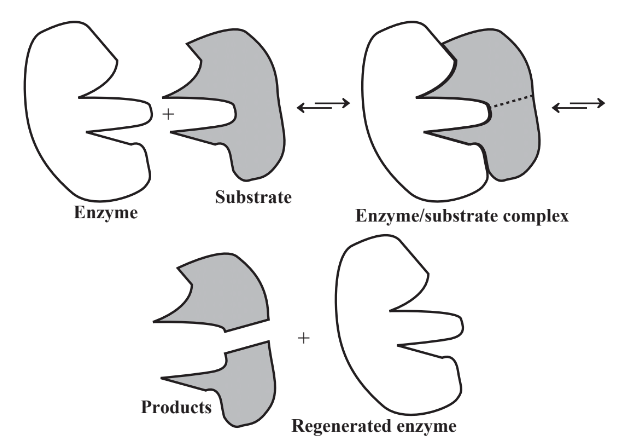
Las enzimas son sustancias proteínicas. Su estructura es altamente específica para que se unan con lo que sea sobre lo que actúen, una sustancia llamada sustrato. El mecanismo básico de acción enzimática se muestra en la Figura 7.9. Como indica la figura, una enzima reconoce un sustrato por su forma, se une con el sustrato para producir un complejo enzima-sustrato, provoca un cambio como dividir un sustrato en dos con adición de agua (hidrólisis), luego emerge sin cambios para volver a hacer lo mismo. El proceso básico se puede representar de la siguiente manera:
\[\textrm{enzyme + substrate} \leftrightarrows \textrm{ enzyme-substrate complex} \leftrightarrows \textrm{ enzyme + product}\]
Tenga en cuenta que las flechas en la fórmula para la reacción enzimática apuntan en ambos sentidos. Esto quiere decir que la reacción es reversible. Un complejo enzima-sustrato simplemente puede volver a la enzima y al sustrato. Los productos de una reacción enzimática pueden reaccionar con la enzima para formar nuevamente el complejo enzima-sustrato. A su vez, puede volver a formar la enzima y el sustrato. Por lo tanto, la misma enzima puede actuar para hacer que una reacción vaya en cualquier dirección.
Para que algunas enzimas funcionen, primero deben unirse a las coenzimas. Las coenzimas normalmente no son materiales proteicos. Algunas de las vitaminas son coenzimas importantes.
Los nombres de las enzimas se basan en lo que hacen y dónde ocurren. Por ejemplo, la proteasa gástrica, comúnmente llamada pepsina, es una enzima liberada por el estómago (gástrica), que divide las moléculas de proteína como parte del proceso de digestión (proteasa). De igual manera, la enzima producida por el páncreas que descompone las grasas (lípidos) se llama lipasa pancreática. Su nombre común es steapsin. En general, las enzimas lipasa hacen que los triglicéridos lipídicos se disocien y formen glicerol y ácidos grasos.
Las enzimas lipasa y proteasa son enzimas hidrolizantes, que permiten la descomposición de compuestos biológicos de alta masa molecular y agregan agua, uno de los tipos más importantes de reacciones involucradas en la digestión de carbohidratos, proteínas y grasas de los alimentos. Recordemos que los carbohidratos más altos que comen los humanos son en gran parte disacáridos (sacarosa o azúcar de mesa) y polisacáridos (almidón). Éstas están formadas por la unión de unidades de azúcares simples, C 6 H 12 O 6, con la eliminación de una molécula H 2 O en el enlace donde se unen. Las proteínas se forman por la condensación de aminoácidos, nuevamente con la eliminación de una molécula de agua en cada enlace. Las grasas son ésteres que se producen cuando el glicerol y los ácidos grasos se unen entre sí. Una molécula de agua se pierde por cada uno de estos enlaces cuando se sintetiza una proteína, grasa o carbohidrato. Para que estas sustancias sean utilizadas como fuente de alimento, el proceso inverso debe catalizarse hidrolizando enzimas para descomponer moléculas grandes y complicadas de proteínas, grasas o carbohidratos en sustancias simples y solubles que puedan penetrar en una membrana celular y participar en procesos químicos en la célula.
Un proceso bioquímico importante es el acortamiento de cadenas de átomos de carbono, como las de los ácidos grasos, comúnmente por la eliminación del CO 2 de los ácidos carboxílicos. Por ejemplo, la enzima piruvato descarboxilasa elimina CO 2 del ácido pirúvico,
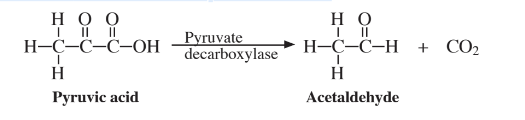
para producir un compuesto con un carbono menos. Es por tales reacciones de descomposición carbono por carbono que los compuestos de cadena larga finalmente se degradan a CO 2 en el cuerpo. Otra consecuencia importante de este tipo de reacción es la biodegradación de hidrocarburos de cadena larga por la acción de microorganismos en los ambientes de agua y suelo.
La energía se intercambia en los sistemas vivos principalmente por oxidación y reducción mediada por enzimas oxidorreductasa. La respiración celular es una reacción de oxidación en la que un carbohidrato, C 6 H 12 O 6, se descompone en dióxido de carbono y agua con la liberación de energía
\[\ce{C6H12O6 + 6O2 \rightarrow 6 CO2 + 6H2O + energy}\]
En realidad, tal reacción general ocurre en sistemas vivos por una serie complicada de etapas individuales que incluyen la oxidación. Las enzimas que provocan la oxidación en presencia de O2 libre se denominan oxidasas.
Además de los principales tipos de enzimas discutidos anteriormente existen numerosas otras enzimas que realizan diversas funciones. Las isomerasas forman isómeros de compuestos particulares. Por ejemplo, las isomerasas convierten varios azúcares simples con la fórmula C 6 H 12 O6 en glucosa, el único azúcar que puede usarse directamente para los procesos celulares. Las enzimas transferasa mueven grupos químicos de una molécula a otra, las enzimas liasas eliminan los grupos químicos sin hidrólisis y participan en la formación de enlaces C=C o adición de especies a dichos enlaces, y enzimas ligasa s trabajar en conjunto con ATP (trifosfato de adenosina, una molécula de alta energía que juega un papel crucial en los procesos metabólicos que producen energía y oxidan la glucosa) para unir moléculas junto con la formación de enlaces como los enlaces carbono-carbono o carbono-azufre.
Las enzimas se ven afectadas por las condiciones y medios en los que operan. Entre estos se encuentra la concentración de iones hidrógeno (pH). Un ejemplo interesante es la proteasa gástrica que requiere que el ambiente ácido del estómago funcione bien pero deja de funcionar cuando pasa al medio mucho más alcalino del intestino delgado. Esto evita daños en las paredes intestinales, lo que ocurriría si la enzima intentara digerirlas. Parte del daño al esófago por esofagitis por reflujo (reflujo ácido) se debe a la acción de la enzima proteasa gástrica que fluye de regreso al esófago desde el estómago con los jugos ácidos del estómago. La temperatura es crítica para la función enzimática. No es sorprendente que las enzimas en el cuerpo humano funcionen mejor a alrededor de 37° C (98.6° F), que es la temperatura corporal normal. Calentar estas enzimas a alrededor de 60° C las destruye permanentemente. Algunas bacterias que prosperan en las aguas termales tienen enzimas que funcionan mejor a temperaturas tan altas como la del agua hirviendo. Otras bacterias “que buscan frío” tienen enzimas adaptadas a cerca del punto de congelación del agua.
Enzimas Inmovilizadas en Química Verde
Como se señaló anteriormente, las enzimas en los organismos tienen una variedad de usos existentes y potenciales en la práctica de la química verde. En muchos casos es ventajoso aislar de las células la enzima utilizada para un proceso particular y utilizarla fuera del entorno celular. En una síntesis discontinua esto se puede hacer mezclando la enzima con los reactivos y permitiéndole catalizar la reacción deseada asegurándose de que se mantengan las condiciones óptimas de temperatura y pH. Este enfoque tiene varias desventajas. Las enzimas son caras y el aislamiento de la enzima de la mezcla de reacción suele ser muy costoso y a menudo no es posible. La contaminación enzimática del producto puede causar dificultades.
La solución al problema descrito anteriormente es a menudo emplear la inmovilización enzimática que utiliza un sistema de dos fases en el que la enzima está en una fase y la reacción ocurre en otra. El secuestro de la enzima en una fase separada permite su reutilización o uso continuo en sistemas de flujo continuo y evita la contaminación enzimática de los productos. Se han empleado varias técnicas importantes para la inmovilización enzimática, incluyendo (1) adsorción sobre un sólido, (2) unión covalente a una fase separada, (3) atrapamiento en una fase separada, (4) confinamiento con una membrana que permite el transporte de reactivos y productos pero retiene la enzima. Idealmente, la matriz que contiene la enzima debe ser capaz de retener la enzima además de ser inerte, físicamente fuerte, químicamente estable y capaz de regenerarse. Los materiales más comunes utilizados para contener enzimas han sido carbono poroso, matrices de intercambio iónico, arcillas, resinas poliméricas, óxidos metálicos hidratados y vidrios.
El procedimiento de inmovilización de una enzima comienza con la mezcla de la enzima y los materiales sólidos en condiciones adecuadas de pH y fuerza iónica, a veces junto con agentes aglutinantes. El soporte que sostiene la enzima inmovilizada se incuba entonces por algún tiempo. Finalmente, el exceso de enzima y, cuando se usa, los agentes aglutinantes se eliminan por lavado del soporte.
En lugar de aislar enzimas e inmovilizarlas sobre un soporte, a menudo se utilizan células de microorganismos vivos, generalmente las de bacterias. Se emplean dos categorías principales de inmovilización, apego y atrapamiento. El tipo más simple de inmovilización es la reticulación por agregación en la que las células microbianas forman redes que componen su propio soporte. Este enfoque generalmente se limita a procesos por lotes. De lo contrario, los principales tipos de inmovilización de unión son la unión covalente, la unión en intercambiadores iónicos, la unión por adsorción y la formación de biopelículas. Probablemente la forma más común de reactor de biopelícula es el filtro de goteo utilizado para el tratamiento de aguas residuales (ver Capítulo 9) en el que las bacterias y protozoos en crecimiento forman una película sobre material de soporte sólido (generalmente roca) y las aguas residuales se rocían sobre la biopelícula. Esto permite el contacto de los microorganismos inmovilizados tanto con el material biodegradable en las aguas residuales como con el oxígeno atmosférico. El atrapamiento de microorganismos puede ser sobre un polímero orgánico, un polímero inorgánico o detrás de una membrana semipermeable.
El uso de organismos vivos como fuentes de enzimas inmovilizadas ofrece la ventaja de no tener que aislar la enzima y, en los casos en que el organismo se está reproduciendo, de reponer continuamente la enzima. Una desventaja incluye tener que mantener condiciones bajo las cuales el organismo sea viable. Además, las células vivas albergan numerosas enzimas, por lo que las reacciones secundarias y los productos no deseados pueden ser un problema.
Efectos de las sustancias tóxicas en las enzimas
Las sustancias tóxicas pueden destruir enzimas o alterarlas para que funcionen indebidamente o nada en absoluto. Entre las muchas sustancias tóxicas que actúan de manera adversa con las enzimas se encuentran los metales pesados, el cianuro y diversos compuestos orgánicos como el paratión insecticida. Muchos sitios activos enzimáticos a través de los cuales una enzima reconoce y se une con un sustrato contienen grupos -SH. Los iones tóxicos de metales pesados como Pb 2 + o Hg 2 + son “buscadores de azufre” que se unen al azufre en el sitio activo de la enzima causando que la enzima no funcione. Una clase particularmente potente de sustancias tóxicas consiste en los organofosfatos “gases nerviosos” como el Sarín que inhiben la enzima acetilcolinesterasa requerida para detener los impulsos nerviosos. Dosis muy pequeñas de Sarin detienen la respiración al unirse con acetilcolinesterasa y hacer que no funcione. Discutida más a fondo en la Sección 7.9 bajo el tema de la química toxicológica, la toxicidad a las enzimas es una consideración importante en la práctica de la química verde.


