13.11: Catalizadores y Catálisis
- Page ID
- 70257
Los componentes principales de un proceso químico se pueden dividir en las categorías de catalizadores, medios, materias primas y reactivos, todos los cuales son importantes en la práctica de la química verde. Catalizadores y catálisis se abordan en esta sección y los demás aspectos de la producción química se abordan en las Secciones 13.13 y 13.14.
Una reacción química verde ideal ocurre con una eficiencia atómica del 100% utilizando solo reactivos y ningún otro reactivo en condiciones suaves con solo aporte moderado de energía térmica y sin ningún catalizador. Desafortunadamente, pocos procesos químicos cumplen con estos criterios.
En el pasado, especialmente en la síntesis de productos químicos finos y farmacéuticos donde el objetivo ha sido simplemente hacer el producto deseado sin mucha consideración de residuos, se han utilizado los llamados reactivos estequiométricos. Estos han incluido oxidantes inorgánicos como MnO 2, KMnO 4, K 2 Cr 2 O 7; reductores metálicos incluyendo zinc, magnesio, sodio y hierro; y agentes reductores de hidruro metálico, especialmente LiAlH 4 y NaBH 4. Diversas reacciones orgánicas incluyendo sulfonaciones y nitraciones emplean ácidos de Lewis (BF 3, AlCl 3, ZnCl 2) y ácidos minerales (HF, H 2 SO 4 y H 3 PO4). Muchos de estos procesos son métodos indirectos para agregar a las moléculas orgánicas hidrógeno (reducción), oxígeno (oxidación), carbono y nitrógeno. Un problema con estos reactivos es la gran cantidad de desechos inorgánicos producidos. Cuando sea posible, es mucho más deseable emplear catalizadores para unir las formas más simples posibles de los elementos, incluyendo H2 para reducción, O2 o H2 O2 para oxidación, CO o CO 2 para la unión de carbono, y NH 3 para la unión de N.
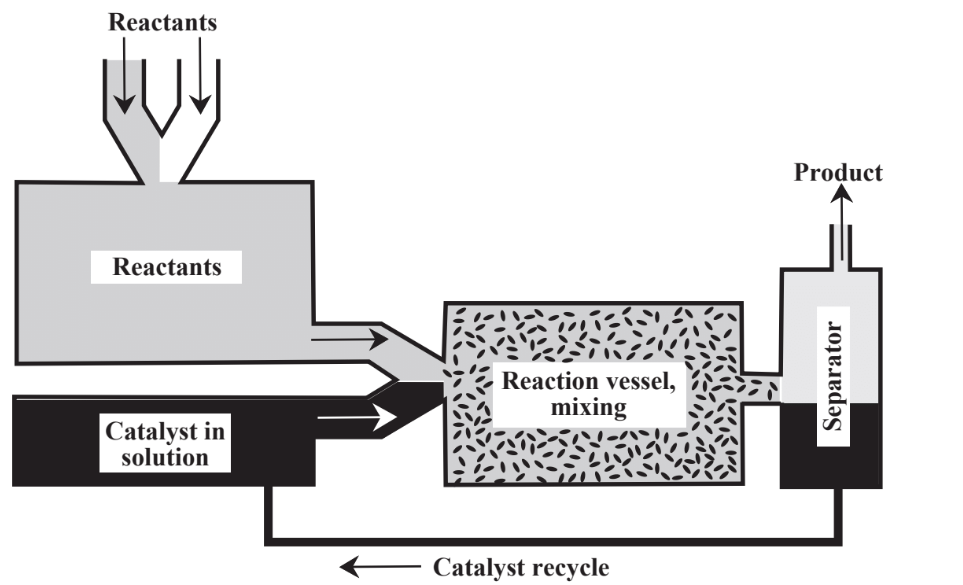
En lugar de depender únicamente de reactivos estequiométricos, se emplean comúnmente catalizadores. Como se discute en el Capítulo 5, Sección 5.5, los catalizadores, son sustancias que permiten que las reacciones procedan a velocidades significativas sin que ellas mismas sean consumidas. Los catalizadores son de gran importancia en la práctica de la química verde por varias razones, incluida su capacidad para facilitar las reacciones y reducir la energía requerida para permitir que las reacciones continúen. Hay dos enfoques principales para poner en contacto el catalizador con una mezcla de reacción como se muestra en la Figura 13.4. En catálisis heterogénea el catalizador se mantiene sobre un soporte y los reactivos fluyen sobre él. En catálisis homogénea
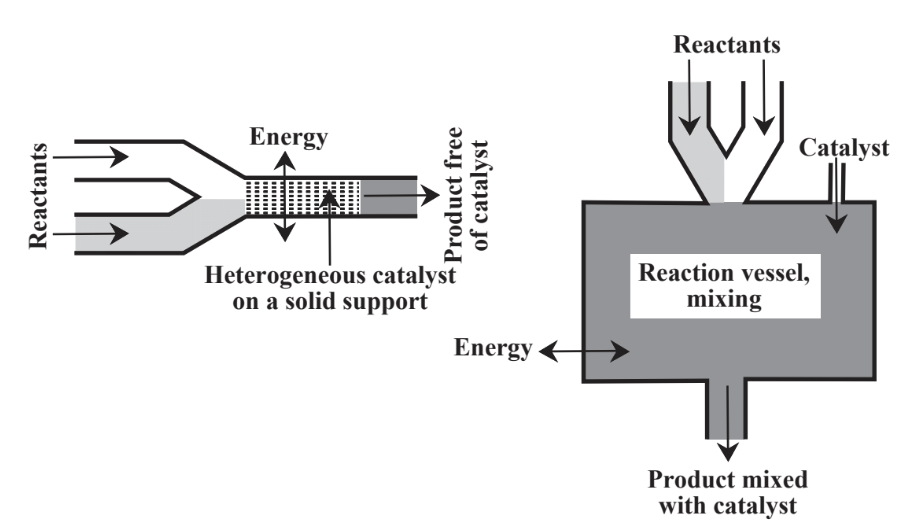
el catalizador se coloca en la mezcla de reacción y o bien permanece en el producto o se separa del producto en una etapa separada. En general, los catalizadores homogéneos tienen alta actividad y selectividad, mientras que los catalizadores heterogéneos se recuperan y reciclan más fácilmente. Gran parte de la actividad en la química verde ha sido en el área de catálisis, especialmente en el desarrollo de catalizadores heterogéneos que no contaminan el producto y que pueden ser reutilizados múltiples veces. En los procesos químicos se utilizan grandes cantidades de catalizadores diferentes y sus posibles toxicidades, producción de subproductos y contaminantes, reciclaje y eliminación son asuntos de considerable importancia en la industria química.
Un área importante de esfuerzo en el desarrollo de catalizadores mejorados con respecto a la química verde es la mejora de la selectividad. Básicamente, esto significa desarrollar un catalizador que sea muy selectivo en lo que hace, idealmente hacer el producto adecuado y nada más. Un catalizador altamente selectivo aumenta el porcentaje de utilización de la materia prima (mayor porcentaje de rendimiento) y disminuye la cantidad de subproductos de desecho de reacciones secundarias no deseadas.
Otro atributo importante de un buen catalizador está relacionado con la forma básica en que funciona un catalizador, que es al disminuir la energía de activación que se requiere para hacer que una reacción proceda a una velocidad significativa. Como consecuencia, los catalizadores disminuyen la cantidad total de energía que se debe poner en un proceso químico para que ocurra. La disminución de los requerimientos energéticos es una parte básica de la práctica de la química verde y, en este sentido, los catalizadores altamente eficientes pueden ser extremadamente beneficiosos para reducir el consumo de energía y reducir los costos y el impacto ambiental.
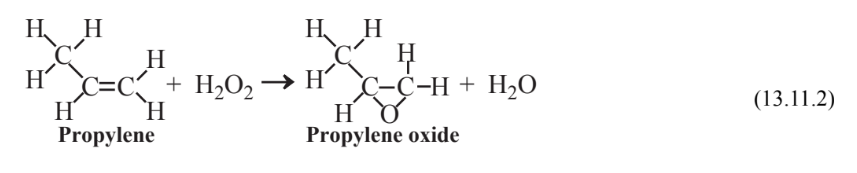
Numerosas reacciones químicas industriales verdes se han desarrollado en los últimos años, la mayoría empleando algún tipo de catalizador. Un ejemplo es la síntesis del óxido de propileno químico industrial ampliamente utilizado a partir de H 2 y O 2 elementales. Alrededor de 1985 se descubrió que el propileno podría oxidarse a óxido de propileno con 30% de peróxido de hidrógeno usando un catalizador de silicato de titanio, pero el proceso no fue económico debido al alto costo del peróxido de hidrógeno. En 2007 se otorgó el premio Green Chemistry Presidential Challenge por un proceso económico para elaborar peróxido de hidrógeno combinando H 2 y O 2 en una mezcla de gases a niveles de H 2 directamente por debajo del límite inferior de inflamabilidad de H 2 usando un catalizador compuesto por nanopartículas de paladio-platino:
\[\ce{H2 + O2 \rightarrow 2H2O2}\]
Como segunda etapa en el proceso, el peróxido de hidrógeno se hace reaccionar con propileno para producir óxido de propileno con agua como único subproducto: