13.12: Biocatálisis con Enzimas
- Page ID
- 70282
La naturaleza ha proporcionado algunos catalizadores ideales en forma de enzimas, cuyo uso ofrece algunas ventajas sustanciales en la química verde. La ventaja más obvia es que las enzimas han evolucionado para funcionar bajo las condiciones suaves en las que funcionan los organismos, especialmente temperaturas moderadas y pH fisiológico. A diferencia de los catalizadores de metales preciosos que se usan comúnmente, las enzimas se fabrican de forma renovable a partir de biomateriales. Las enzimas tienen generalmente altas actividades y son altamente selectivas en los procesos químicos que llevan a cabo. Mientras que las síntesis orgánicas convencionales a menudo requieren la activación o protección de grupos funcionales, los cuales pueden consumir reactivos y, por lo tanto, producir más desechos, estas medidas a menudo no son necesarias con enzimas. El resultado es que las reacciones biocatalizadas se pueden llevar a cabo frecuentemente con relativamente menos pasos y menos desechos haciéndolos más atractivos ambiental y económicamente.
Aunque algunas reacciones biocatalizadas se han utilizado para la producción de productos químicos durante siglos —la producción de etanol por fermentación de levadura de azúcar viene inmediatamente a la mente— los avances relativamente recientes en biotecnología han aumentado enormemente su versatilidad y utilidad. Uno de esos avances ha sido con el ADN recombinante en el que las enzimas que realizan funciones específicas pueden transferirse entre organismos. El otro avance importante ha sido con la evolución dirigida en la que las secuencias de aminoácidos en las enzimas producidas por los genes se barajan aleatoriamente y se muestrean grandes cantidades de los productos por su actividad, particularmente para llevar a cabo una etapa sintética bioquímica particular. Esto se puede hacer dentro de las células vivas, pero se puede llevar a cabo a una escala mucho mayor fuera de las células, un proceso llamado evolución in vitro. Obviamente, la mayoría de las enzimas producidas por esta técnica no son superiores, o incluso son inútiles, pero de los enormes números generados, algunas serán superiores. La evolución in vitro se lleva a cabo para proporcionar enzimas con propiedades tales como actividad catalítica mejorada o diferente, especificidad catalítica, termoestabilidad y pH óptimo que pueden ser utilizados en aplicaciones industriales, médicas o agrícolas. Está demostrando ser particularmente útil en el desarrollo de enzimas que actúan sobre compuestos que no ocurren en la naturaleza y para los cuales las enzimas no han evolucionado a través de la evolución natural.
Catalizadores de enzimas inmovilizadas
Las desventajas de las enzimas catalíticas incluyen a menudo baja estabilidad, tiempos de almacenamiento limitados, difícil recuperación y contaminación del producto, casi siempre una consideración con catalizadores homogéneos. La estabilidad y reciclabilidad de las enzimas a menudo pueden mejorarse inmovilizándolas sobre soportes sólidos. Un medio común de inmovilizar enzimas es por su precipitación a partir del caldo de fermentación en el que son generadas por un tampón como sulfato de amonio y estabilizar los agregados precipitados con un reactivo que posee dos grupos funcionales de unión, comúnmente glutaraldehído un reactivo que es ampliamente utilizado para proteínas de reticulación:
La precipitación y reticulación de la enzima combina su aislamiento e inmovilización en una sola etapa. Las enzimas preparadas de esta manera suelen ser altamente productivas, estables y resistentes a la desnaturalización (pérdida de la función enzimática por alteración estructural) debido a la exposición a disolventes orgánicos, calentamiento, o descomposición a cadenas peptídicas o aminoácidos más cortos por la acción de enzimas proteolíticas (proteólisis).
Reducción en las etapas de síntesis con catalizadores enzimáticos
La síntesis típica de un compuesto orgánico, especialmente uno tan complicado como muchos agentes farmacéuticos, puede implicar múltiples etapas. Debido a factores como la pérdida de producto, la necesidad de proteger y desproteger grupos funcionales y la generación de desechos de cada paso, estas síntesis de múltiples etapas tienden a construir factores E altos en general. La síntesis ideal es un proceso “one-pot” en el que todas las etapas se llevan a cabo en una misma operación sin necesidad de aislar intermedios. Las células vivas suelen ser fábricas sintéticas “de un solo recipiente”, por lo que es natural buscar enzimas para lograr lo mismo en el laboratorio y en la producción química usando múltiples enzimas en un solo recipiente y para una sola operación de varios pasos. La realización de dicho proceso puede complicarse por la incompatibilidad de diferentes enzimas y las diferentes condiciones bajo las cuales operan las enzimas aunque en general operan en agua bajo condiciones ambientales compatibles con la vida. (El descubrimiento relativamente reciente de organismos que viven en condiciones cálidas y extremas en el fondo del océano profundo plantea algunas posibilidades interesantes para el aislamiento de enzimas que podrían funcionar en condiciones inusuales, particularmente temperaturas elevadas).
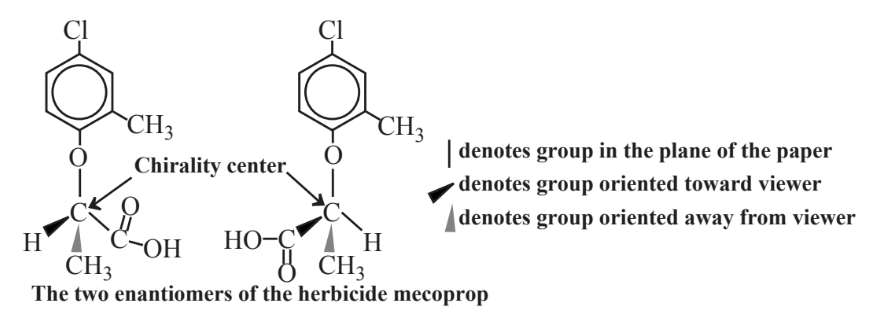
Catalizadores enzimáticos y quiralidad
Como muestra el ejemplo del herbicida mecoprop en la Figura 13.6, las moléculas quirales son moléculas tridimensionales con estructuras tales que una molécula no puede imponerse directamente sobre su imagen especular. Las moléculas quirales tienen diferentes grupos dispuestos alrededor de un átomo, generalmente de carbono, que constituye un centro quiral. Dos moléculas quirales del mismo compuesto se denominan enantiómeros comúnmente designados como R y S. Las propiedades físicas y químicas de los enantiómeros son generalmente idénticas, teniendo los mismos puntos de fusión, puntos de ebullición y solubilidades. Sin embargo, un enantiómero de un compuesto puede encajar exactamente con un sitio activo enzimático mientras que el otro no. Esto da como resultado propiedades bioquímicas a menudo marcadamente diferentes de los enantiómeros y, en consecuencia, comportamientos ambientales y toxicológicos completamente diferentes. Un enantiómero de un farmacéutico quiral puede funcionar muy bien mientras que el otro no funciona en absoluto o incluso puede ser tóxico. Las diferencias bioquímicas entre los enantiómeros pueden ser especialmente pronunciadas para los pesticidas. Por ejemplo, el enantiómero R del mecoprop herbicida (Figura 13.6) mata las malas hierbas de manera muy efectiva mientras que el enantiómero S es inactivo; por lo tanto, el enantiómero R puro ahora se comercializa como herbicida en lugar de la mezcla racémica con el enantiómero S.
Normalmente, cuando se sintetiza un compuesto quiral por medios químicos convencionales, se produce una mezcla racémica de los dos enantiómeros. Debido a sus propiedades químicas esencialmente idénticas, son muy difíciles de separar. Sin embargo, es posible producir compuestos químicos enantioméricamente puros con catalizadores enzimáticos apropiados. Además, es posible utilizar catalizadores enzimáticos para convertir mezclas racémicas de compuestos en formas enantioméricamente puras. En una de las operaciones industriales más grandes, BASF ahora utiliza procesos enzimáticamente catalizados para preparar aminas enantioméricamente puras en cantidades de mil toneladas.
Los catalizadores de la naturaleza, las enzimas en los organismos, son expertos en llevar a cabo procesos químicos de manera eficiente en condiciones suaves. En consideración a este hecho, se está dedicando mucha atención al uso de organismos, especialmente bacterias, para llevar a cabo procesos químicos. Al empalmar genes deseados para hacer enzimas específicas en bacterias para que lleven a cabo las reacciones deseadas, la ingeniería genética está haciendo una contribución creciente al desarrollo de procesos químicos verdes catalizados por enzimas.
Los químicos están tratando de usar enzimas como modelos para catalizadores sintéticos que tienen características de desempeño de las enzimas, pero que son mucho más simples y funcionan en condiciones que destruirían los catalizadores enzimáticos. Un área prometedora en la que esto podría lograrse es el uso de catalizadores que contienen hierro para oxidar grupos alquenos (C=C) en compuestos orgánicos usando reactivo de peróxido de hidrógeno relativamente suave, H 2 O 2. Los organismos realizan esta tarea usando catalizadores en los que el ion Fe 2 + está unido por cuatro átomos de N en moléculas de hemo-porfirina relativamente grandes. La misma oxidación se ha logrado ahora con un catalizador en el que Fe 2 + está unido por cuatro átomos de N por una molécula orgánica con el formidable nombre de N, N'-dimetil-N, N'bis (2-piridilmetil) -etilendiamina como se muestra en la Figura 13.7. Una gran ventaja de este catalizador que se comparte con los catalizadores enzimáticos que permiten oxidaciones de peróxido es que no causa la descomposición del peróxido de hidrógeno como lo hacen varios catalizadores sintéticos.


