13.15: Materias primas y reactivos
- Page ID
- 70202
Materias primas
Las materias primas son los principales ingredientes que entran en la producción de productos químicos. Como se analiza a continuación, los reactivos pueden actuar sobre las materias primas, y a menudo hay cierto solapamiento entre las dos categorías de materiales. Las materias primas son tan importantes en la práctica de la química verde que gran parte del Capítulo 14, “Alimentar la antrosfera: utilización de materiales renovables y biológicos”, se dedica a las materias primas renovables. Aquí se presentan brevemente ya que se relacionan con la química verde y la sustentabilidad.
Hay tres componentes principales del proceso por los cuales las materias primas de una fuente se obtienen en una forma que puede ser utilizada en una síntesis química, luego convertida en un producto. El primero de ellos es la fuente de la materia prima, aspecto que tiene una serie de consideraciones ambientales y de sustentabilidad. Esto puede consistir en un recurso agotador, como el petróleo, en cuyo caso se debe considerar la vida útil del recurso y las implicaciones ambientales de su obtención. Desde el punto de vista de la sustentabilidad es preferible utilizar materiales reciclados como materias primas, aunque la disponibilidad de materiales reciclados adecuados para este propósito es limitada. Una tercera fuente que es muy deseable consiste en recursos renovables, particularmente de materiales elaborados por fotosíntesis y procesos biológicos.
El segundo aspecto principal de la conversión de materias primas en productos finales es la separación y aislamiento de la sustancia deseada. Un ejemplo de esta etapa es el aislamiento de compuestos orgánicos específicos del petróleo crudo para proporcionar una materia prima para la síntesis química orgánica. Puede ser necesario procesar materias primas de una fuente para convertirla en el material específico utilizado como materia prima para un proceso químico. A menudo, la mayor parte del daño ambiental al proporcionar materias primas se produce durante el proceso de aislamiento, en gran parte debido a la cantidad relativamente grande de material de desecho que a menudo se genera para obtener la materia prima necesaria.
La industria química mundial se ha construido principalmente sobre materias primas de carbono fósil. Gran parte del ímpetu para la industria química orgánica se construyó a finales del siglo XIX y principios del siglo XX sobre la base de productos químicos orgánicos aislados del subproducto de alquitrán de hulla de la coquización de carbón. Posteriormente, el petróleo y el gas natural se convirtieron en la base de la industria petroquímica que ha producido enormes cantidades de polímeros, plásticos, caucho sintético y miles de otros tipos de productos químicos. Eventualmente, esta dependencia del agotamiento de los recursos fósiles de carbono debe terminar. Por lo tanto, uno de los principales objetivos de la química verde se ha convertido en un cambio hacia materias primas renovables —biomasa producida por la fotosíntesis— y hacia medios de reacción renovables, específicamente agua y dióxido de carbono líquido supercrítico y presurizado. Además de ser renovables, tales materias primas ofrecen ventajas sobre el petróleo ya que no son tóxicas y ellas, y la mayoría de sus productos e intermedios, son biodegradables.
Materias primas de biomasa
El cambio continuo hacia una economía de base biológica ofrece la oportunidad de diseñar su procesamiento y productos sobre la base de la química verde y la sustentabilidad. En lugar de refinerías de petróleo, las biorrefinerías se utilizan para procesar materias primas de base biológica. Inicialmente, las materias primas utilizadas han sido de granos de maíz y semillas oleaginosas, como la soja. El almidón de maíz se hidroliza a azúcares que se convierten en alcoholes por procesos de fermentación y en combustible biodiesel por esterificación de los ácidos grasos en los lípidos de las semillas oleaginosas. Algunos productos químicos básicos como el ácido láctico también están hechos de fuentes de granos. Sin embargo, estas son formas ineficientes de utilizar la biomasa, compiten con el consumo de grano como alimento, y la producción máxima de grano requiere un cultivo intensivo (a menudo de tierras marginales), un uso intensivo de fertilizantes y una fuerte dependencia de pesticidas. Un enfoque mucho más renovable es utilizar lignocelulosa, el material estructural de las plantas (como la paja de trigo) ya sea de cultivos dedicados o preferiblemente de biomasa de subproductos de cultivos o algas altamente productivas que crecen en el agua. Aunque se están haciendo intentos de descomponer estos materiales lignocelulósicos con enzimas para producir azúcares fermentables, una vía preferible es la ruta termoquímica. Esto puede ser por pirólisis de la biomasa para producir una variedad de líquidos orgánicos, algo de gas y un residuo de carbono que se puede quemar para proporcionar calor para la pirólisis. Alternativamente, la biomasa puede hacerse reaccionar directamente con hidrógeno para producir productos líquidos y gaseosos. Tanto la pirólisis como la hidrogenación producen una gran variedad de líquidos, incluidos los orgánicos oxigenados que se pueden pasar a través de una biorrefinería. Como se discute en el Capítulo 15 sobre energía, el mejor enfoque es la gasificación termoquímica de la biomasa para producir una mezcla de gas de síntesis de CO y H 2 que puede ser utilizada con tecnología bien conocida para sintetizar gasolina, combustible diesel, combustible de aviones, alcoholes, gas natural sustituto, y diversos orgánicos materias primas químicas.
La ingeniería genética puede ser muy útil en la producción de biomasa para materias primas. Un área en la que hay mucho margen de mejora es la mejora de la eficiencia de la fotosíntesis. Los cultivos pueden ser criados para aumentar la cantidad de biomasa subproducto junto con el grano que producen. Los cultivos dedicados pueden ser desarrollados para la producción de grandes cantidades de biomasa, solos. Esto ya se ha hecho utilizando técnicas convencionales de fitomejoramiento para desarrollar álamo híbrido de rápido crecimiento que producen grandes cantidades de madera lignocelulósica.
Materias primas de carbohidratos
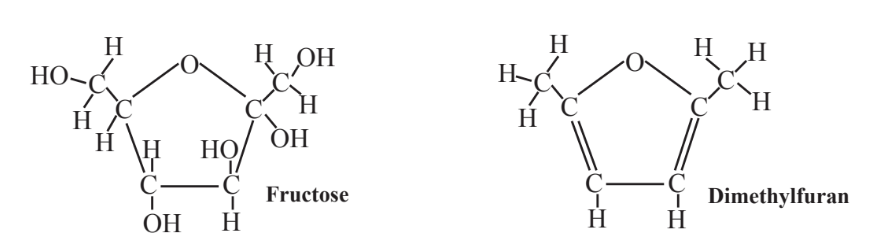
Las materias primas de biomasa más abundantes son los carbohidratos. De ello se deduce que una de las vías más prometedoras para obtener materias primas y combustibles útiles a partir de la biomasa es su síntesis directamente a partir de carbohidratos. Como ejemplo de un producto químico de materia prima que se puede sintetizar a partir de fructosa, un monosacárido hecho en abundancia a partir de almidón de maíz y sacarosa (azúcar de mesa común) es dimetilfurano (Figura 13.9), un compuesto orgánico cíclico que contiene oxígeno que tiene la mayoría de las propiedades deseables de los hidrocarburos como combustible y crudo material. Como se muestra en la Figura 13.9, la fructosa y el dimetilfurano tienen fórmulas estructurales similares y la conversión es en gran parte una cuestión de eliminar el oxígeno de la fructosa por reacción con hidrógeno. Esta síntesis y la glucosa monosacárida como materia prima se discuten en el Capítulo 14.
La química verde y el inevitable cambio de las materias primas de hidrocarburos de petróleo a materiales de base biológica provocarán un realineamiento masivo de la industria química. En lugar de fabricar materiales no degradables utilizando tecnologías respetuosas con el medio ambiente con materias primas agotables, el nuevo paradigma empleará procesos catalíticos verdes para convertir las materias primas de biomasa en productos biocompatibles (no tóxicos, biodegradables).
Reactivos
El término reactivos se utiliza aquí para describir las sustancias que actúan sobre las materias primas químicas básicas para convertirlas en nuevos químicos en procesos sintéticos. Los tipos de reactivos utilizados tienen un efecto muy fuerte sobre la aceptabilidad de un proceso químico con respecto a los aspectos químicos verdes. Gran parte del trabajo que se ha realizado en el desarrollo y uso de reactivos verdes ha involucrado procesos químicos orgánicos, muchos de los cuales están más allá del alcance de este libro. Sin embargo, algunos de los aspectos generales de los reactivos químicos desde una perspectiva química verde se discuten aquí.
La característica más obvia que se requiere de un buen reactivo químico es que haga lo que se supone que debe hacer por completo y a un ritmo aceptable. Un reactivo con una alta selectividad de producto produce un alto porcentaje del producto deseado con un bajo porcentaje de subproductos no deseados. Otra característica deseable de un buen reactivo es el alto rendimiento de producto, lo que significa que la mayoría de las materias primas se convierten en producto. El uso de reactivos que proporcionan alta selectividad y rendimiento significa que menos materia prima sin reaccionar y material de subproducto tienen que ser manejados, reciclados o desechados.
Una de las medidas más comunes que se toman en la implementación de procesos químicos verdes es la selección de reactivos alternativos. Los criterios utilizados para seleccionar un reactivo incluyen si está disponible o no, qué tan eficiente es y el efecto que tiene. Consideraciones importantes con la transformación química son si es estequiométrica o catalítica, el grado en que es económica atómica, y las cantidades y características de cualquier residuo producido.
Reactivos para Oxidación y Reducción
Uno de los principales tipos de reacciones para las que se utilizan reactivos es la oxidación, que generalmente consiste en la adición de oxígeno a un compuesto químico o a un grupo funcional sobre un compuesto. (Véase el Capítulo 5, Sección 5.7 para una discusión sobre la oxidación y su fenómeno acompañante, la reducción y la sección 13.8 respecto a la disponibilidad de oxígeno en los oxidantes y la disponibilidad de hidrógeno en los reductores.) Un ejemplo de una reacción de oxidación es la conversión de etanol en ácido acético,
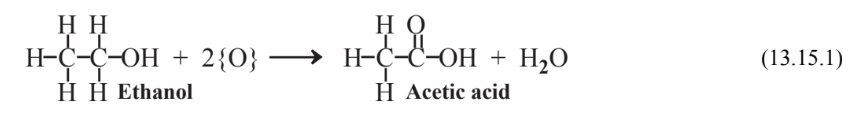
donde se usa {O} para representar el oxígeno de algún oxidante no especificado. La oxidación es uno de los pasos más comunes en la síntesis química. Se utilizan varios reactivos como oxidantes. Algunos de estos reactivos, como el dicromato de potasio, K 2 Cr 2 O 7 son peligrosos (las sales de dicromato se consideran cancerígenas cuando se inhalan por periodos prolongados de tiempo) y dejan residuos problemáticos que requieren eliminación.
Debido a problemas con los oxidantes que se usan comúnmente, un objetivo principal en la práctica de la química verde es usar oxidantes más benignos. Las alternativas a los reactivos oxidantes más tradicionales incluyen oxígeno molecular (O2), ozono (O3) y peróxido de hidrógeno (H 2 O 2), generalmente utilizados con un catalizador adecuado que permita que se produzca la reacción de oxidación. En las condiciones adecuadas, el peróxido de hidrógeno se puede usar como alternativa al cloro elemental, Cl 2, un oxidante fuerte que se usa para blanquear materiales coloreados, como pulpa de papel y tela. Dado que el cloro es tóxico (se utilizó como gas venenoso en la Primera Guerra Mundial) y tiene tendencia a reaccionar con compuestos orgánicos para producir compuestos orgánicos clorados indeseables, el peróxido de hidrógeno es un agente blanqueador muy preferible.
En contraste con las condiciones generalmente duras en las que se llevan a cabo las oxidaciones químicas, los organismos realizan oxidaciones bioquímicas en condiciones suaves. Al hacerlo, utilizan enzimas monooxigenasa y peroxidasa que catalizan la acción oxidante del oxígeno molecular o el peróxido de hidrógeno. Un área de interés significativo en la química verde es realizar tales oxidaciones en sistemas biológicos o intentar el uso de catalizadores que imiten la acción de las enzimas en la catalización de oxidaciones con oxígeno molecular o peróxido de hidrógeno.
La reducción, que consiste en la pérdida de O, ganancia de H o ganancia de electrones por una especie química, también es una operación común en la síntesis química. Como es el caso de los oxidantes, los reactivos utilizados para lograr la reducción pueden plantear peligros y producir subproductos indeseables. Dichos reductores incluyen hidruro de litio y aluminio (LiAlH 4) e hidruro de tributil estaño.
Electrones como Reactivos para Oxidación y Reducción
Como alternativa a los procedimientos potencialmente problemáticos de oxidación y reducción que utilizan reactivos, la electroquímica proporciona un medio libre de reactivos para hacer oxidación y reducción. Esto es posible porque una corriente eléctrica consiste en mover electrones y la oxidación consiste en la eliminación de electrones de una especie química y la reducción es la adición de un electrón. El paso de una corriente eléctrica entre electrodos de grafito metálico o carbono a través de una solución que resulta en reacciones de oxidación y reducción se denomina electrólisis. Consideremos el caso más simple posible de electrólisis, el del agua que contiene una sal no reactiva, como Na 2 SO 4, que se muestra en la Figura 13.10.
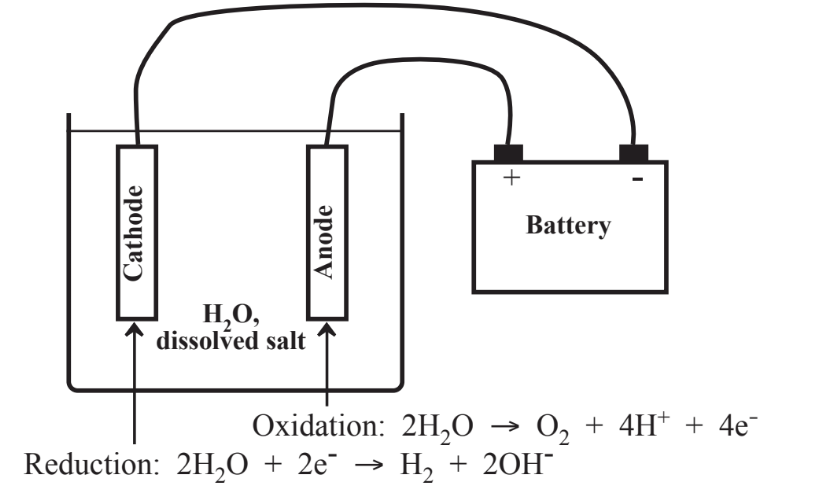
En el cátodo, donde se bombean electrones (e-) al sistema y donde se produce la reducción, se produce reducción de agua liberando H 2,
\[\ce{2H2O + 2e^{-} \rightarrow H2 + 2OH^{-}}\]
y en el ánodo donde se eliminan los electrones, O 2 se libera a medida que se oxida el agua:
\[\ce{2H2O \rightarrow O2 + 4H+ + 4e-}\]
En la configuración mostrada, el ion H+ generado en el ánodo OH-ion generado en el ánodo se difunde a través de la solución y reacciona al contacto para producir agua nuevamente. En el cátodo, una especie química disuelta podría reducirse directamente o el hidrógeno generado podría agregarse a una especie, reduciéndola. Y en el ánodo otra especie podría oxidarse directamente por pérdida de electrones o el oxígeno generado podría agregarse a una especie, oxidándola.
Reacciones Diversas con Reactivos
Reacciones distintas a la oxidación y reducción se llevan a cabo mediante reactivos. Como ejemplo de una reacción comúnmente realizada que normalmente requiere reactivos potencialmente problemáticos, considere la alquilación con reactivos alquilantes en los que un grupo alquilo, más frecuentemente el grupo -CH 3 (metilo), se agrega a un átomo en un compuesto orgánico. La reacción de metilación,
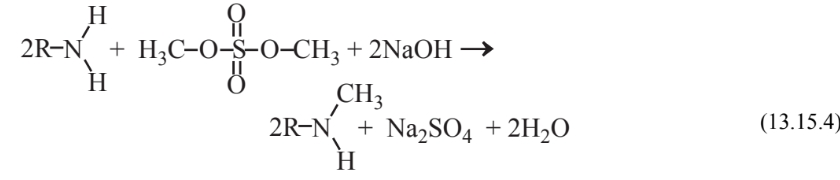
“muestra la unión de un grupo metilo a un grupo amina, -NH2, que es parte de una molécula no especificada representada “" R "”.” La metilación del nitrógeno se utiliza en una serie de síntesis químicas incluyendo la preparación de analgésicos como el ibuprofeno. El reactivo de sulfato de dimetilo utilizado para lograr la metilación plantea problemas de toxicidad ya que es un carcinógeno humano sospechoso. La reacción también produce un subproducto de Na 2 SO 4, que si se contamina con reactivo de sulfato de dimetilo puede plantear problemas de eliminación.
Carbonato de dimetilo preparado por reacción de metanol, CH 3 OH, con monóxido de carbono, CO, en presencia de oxígeno elemental y un catalizador de sal de cobre se ha desarrollado como una alternativa verde al sulfato de dimetilo como reactivo metilante. Cuando el carbonato de dimetilo actúa como un agente metilante,
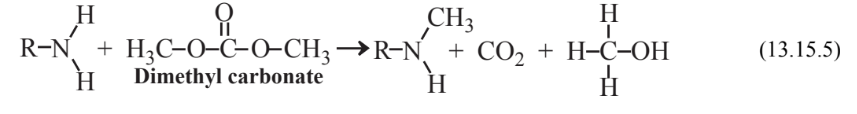
metanol y dióxido de carbono inocuo se generan como subproductos. El metanol puede recircularse a través del sistema para generar reactivo de carbonato de dimetilo adicional.


