13.14: Disolventes y Medios de Reacción Alterna
- Page ID
- 70214
Las reacciones químicas a menudo se llevan a cabo en medios, generalmente disolventes orgánicos o agua, para proporcionar un medio en el que las materias primas y reactivos pueden disolverse y entrar en contacto cercano y rápido a nivel molecular. Un buen disolvente para la síntesis química es aquel que permite la separación fácil del producto y es susceptible de purificación y reutilización con una pérdida mínima. Las sustancias disueltas en un disolvente son solvatadas por la unión del disolvente a las moléculas o iones de la sustancia disuelta, el soluto. La solvatación de reactivos y productos a menudo juega un papel importante en la determinación de los tipos y velocidades de las reacciones. Muchas materias primas y reactivos orgánicos no son solubles en agua o se descomponen por ella, por lo que los solventes orgánicos incluyendo hidrocarburos, hidrocarburos clorados y éteres tienen que ser utilizados como medios de reacción.
Los solventes orgánicos causan varios problemas en la síntesis química. Particularmente debido a los problemas asociados con su contención, recuperación y reutilización, los solventes orgánicos son especialmente contribuyentes importantes a factores E indesablemente altos. Muchos de los problemas ambientales y de salud asociados con la fabricación de productos químicos son el resultado del uso de solventes orgánicos como medios. Los disolventes de hidrocarburos se quemarán y los vapores de hidrocarburos en el aire son explosivos. Aunque muchos disolventes hidrocarbonados no son particularmente tóxicos, algunos pueden causar la condición de neuropatía periférica (daño a los nervios periféricos como los de pies y piernas), y el benceno es considerado como un carcinógeno que se cree que causa leucemia. Liberados a la atmósfera, los hidrocarburos también pueden participar en procesos fotoquímicos que conducen a la formación de smog fotoquímico (ver Capítulo 10, Sección 10.11).
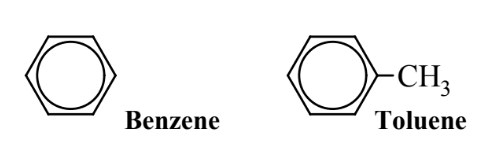
Un enfoque para hacer que los procesos de síntesis química sean más ecológicos es reemplazar solventes específicos por otros menos peligrosos. Por esta razón, el solvente bencénico tóxico es reemplazado por tolueno siempre que sea posible. Como muestran sus fórmulas estructurales a continuación, el tolueno tiene un grupo metilo, −CH 3, que el benceno no posee. El grupo metilo en el tolueno puede ser actuado por los sistemas metabólicos humanos para producir un metabolito inofensivo (ácido hipúrico) que se elimina en la orina, mientras que los procesos metabólicos que actúan sobre el benceno lo convierten en un intermedio tóxico que puede reaccionar con el ADN celular.
Como otro ejemplo de reemplazo de solvente, el n-hexano, que puede causar neuropatía periférica en individuos expuestos, puede ser reemplazado por 2,5-dimetilhexano, que no causa esta condición, para reacciones donde la mayor temperatura de ebullición de este último compuesto no es un problema.
Existe un interés significativo en medios de reacción distintos a los disolventes orgánicos. El enfoque final para eliminar problemas con disolventes en la síntesis química es hacer reacciones sin disolventes de ningún tipo. Se pueden realizar algunas reacciones en las que los reactivos simplemente se mezclan entre sí o se mantienen sobre soportes sólidos, como arcillas. El calentamiento por microondas de tales mezclas de reacción ha demostrado ser efectivo para proporcionar energía para permitir que las reacciones ocurran rápidamente. Sin embargo, en muchos casos eso no es posible y se requieren solventes. Algunos disolventes alternativos se discuten a continuación.
Solvente de agua
Aunque muchos reactivos son reactivos con el agua haciendo imposible su uso, en su caso, el solvente más verde para los procesos químicos verdes es el agua. El agua es abundante, barata, no tóxica y no se quema. Debido a su naturaleza polar y a la capacidad de formar enlaces de hidrógeno (ver Capítulo 9, Sección 9.1 y Figura 9.1), el agua es un disolvente especialmente bueno para compuestos iónicos: ácidos, bases y sales. El agua es particularmente útil como uno de los disolventes en catálisis bifásica descritos en la Sección 13.11. Normalmente el catalizador se mantiene en la fase acuosa y el producto en un disolvente orgánico inmiscible en agua, lo que permite una fácil separación del catalizador una vez completada la reacción.
Debido a las muchas ventajas del agua, se han realizado esfuerzos significativos para reemplazar los solventes orgánicos utilizados para los medios de reacción por agua. Aunque el agua no disuelve apreciablemente muchos compuestos orgánicos no polares, en algunos casos estos materiales pueden suspenderse como partículas coloidales muy pequeñas en agua, lo que permite un contacto lo suficientemente cercano de los materiales orgánicos para sufrir reacciones. El agua es un buen solvente para algunos de los materiales biológicos, como la glucosa, ahora favorecida como materia prima química donde se pueden usar.
Solvente de dióxido de carbono
A una presión alta por encima de 73.8 atm (73.8 veces la presión atmosférica normal al nivel del mar) y una temperatura superior a 31.1° C, el dióxido de carbono se convierte en un fluido supercrítico, un estado de materia relativamente denso en el que ya no hay distinción entre líquido y gas. Un buen solvente para compuestos orgánicos, el dióxido de carbono supercrítico se puede usar como medio de reacción para reacciones químicas orgánicas. Una ventaja del dióxido de carbono supercrítico en esta aplicación es que su viscosidad es solo de aproximadamente 1/30 la de los solventes orgánicos líquidos comunes, lo que permite que las especies reaccionantes se muevan mucho más rápido a través del fluido, acelerando así las reacciones que experimentan. A temperaturas y presiones algo por debajo de aquellas a las que el dióxido de carbono se vuelve crítico, existe como fases gaseosas y líquidas separadas al tiempo que conserva muchas de las propiedades solventes del dióxido de carbono supercrítico. En estas condiciones, el dióxido de carbono se denomina fluido de fase densa, término que también engloba fluidos supercríticos.
El ajuste de la composición y las condiciones bajo las cuales se mantiene el dióxido de carbono fluido de fase densa puede proporcionar variaciones significativas en sus propiedades solventes y ajuste de su capacidad para actuar como medio de reacción. Además de las variaciones de temperatura y presión, el dióxido de carbono fluido de fase densa puede mezclarse con pequeñas cantidades de otros disolventes (modificadores), como el metanol, para variar aún más sus propiedades de disolvente.
Además de sus propiedades solventes, el dióxido de carbono fluido de fase densa ofrece la ventaja de baja toxicidad y bajo potencial de daño ambiental (las pequeñas cantidades de dióxido de carbono de gases de efecto invernadero liberadas por su aplicación como solvente son insignificantes en comparación con las cantidades liberadas por la combustión de combustibles fósiles). Una gran ventaja del dióxido de carbono fluido de fase densa es su volatilidad, lo que significa que se separa fácilmente de los productos de reacción cuando se libera presión. Además, el dióxido de carbono liberado de una mezcla de reacción puede capturarse y reciclarse para la misma aplicación. El dióxido de carbono se puede obtener a bajo costo a partir de procesos de fermentación biológica.
Solventes líquidos iónicos
Los líquidos iónicos presentan otra alternativa a los solventes orgánicos para su uso como medio de síntesis química. Las sales inorgánicas constituidas por iones, como el NaCl compuesto por iones Na + y Cl -, son normalmente sólidos duros y de alto punto de ebullición. Sin embargo, cuando uno o ambos de los iones están compuestos de grandes moléculas orgánicas cargadas, como se muestra por el catión en el ejemplo de un líquido iónico a continuación,
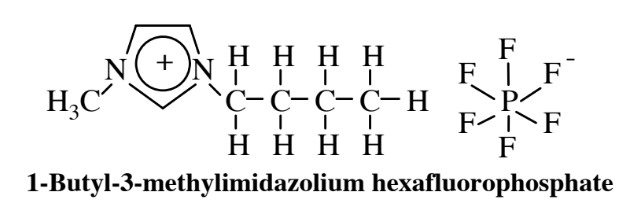
las sales pueden ser líquidos a temperatura ambiente y se llaman líquidos iónicos. Estos materiales tienen el potencial de actuar como medios adecuados en los que las sustancias pueden disolverse y sufrir reacciones, y se están realizando investigaciones activas para explorar esta posibilidad. Existe una enorme variedad de tales líquidos iónicos con propiedades solventes ampliamente variables debido a la gran cantidad de tipos de iones que se pueden combinar, lo que lleva a posibilidades casi ilimitadas para varios líquidos iónicos. Una posibilidad interesante que se ha probado experimentalmente es utilizar una fase fluida mixta de líquido iónico/dióxido de carbono supercrítico en la que la reacción procede con un catalizador homogéneo seguido de reducción de presión que provoca que el dióxido de carbono supercrítico y el líquido iónico se separen en dos fases con el catalizador restante en el líquido iónico —por lo tanto disponible para su reutilización— y el producto en el dióxido de carbono supercrítico.


