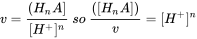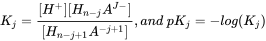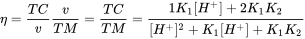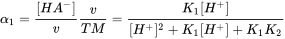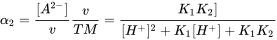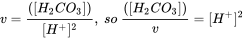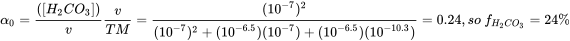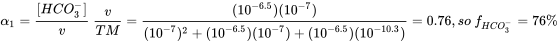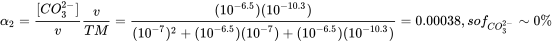2.2: Contaminantes con propiedades específicas
- Page ID
- 70509
2.2. Contaminantes con propiedades específicas
2.2.1. Metales y metaloides
Autor: Kees van Gestel
Críticos: John Parsons, Jose Alvarez Rogel
Objetivos de aprendizaje:
Deberías ser capaz de:
- describir la diferencia entre metales y metaloides
- describir una clasificación usando diferentes afinidades de unión de metales a macromoléculas e inferir su importancia para su toxicidad y/o bioacumulación
- mencionar fuentes importantes de contaminación por metales
Palabras clave: Metales pesados, Metaloides, Elementos de tierras raras, Elementos esenciales
Introducción
La mayoría de los elementos de la tabla periódica consiste en metales: Figura 1.
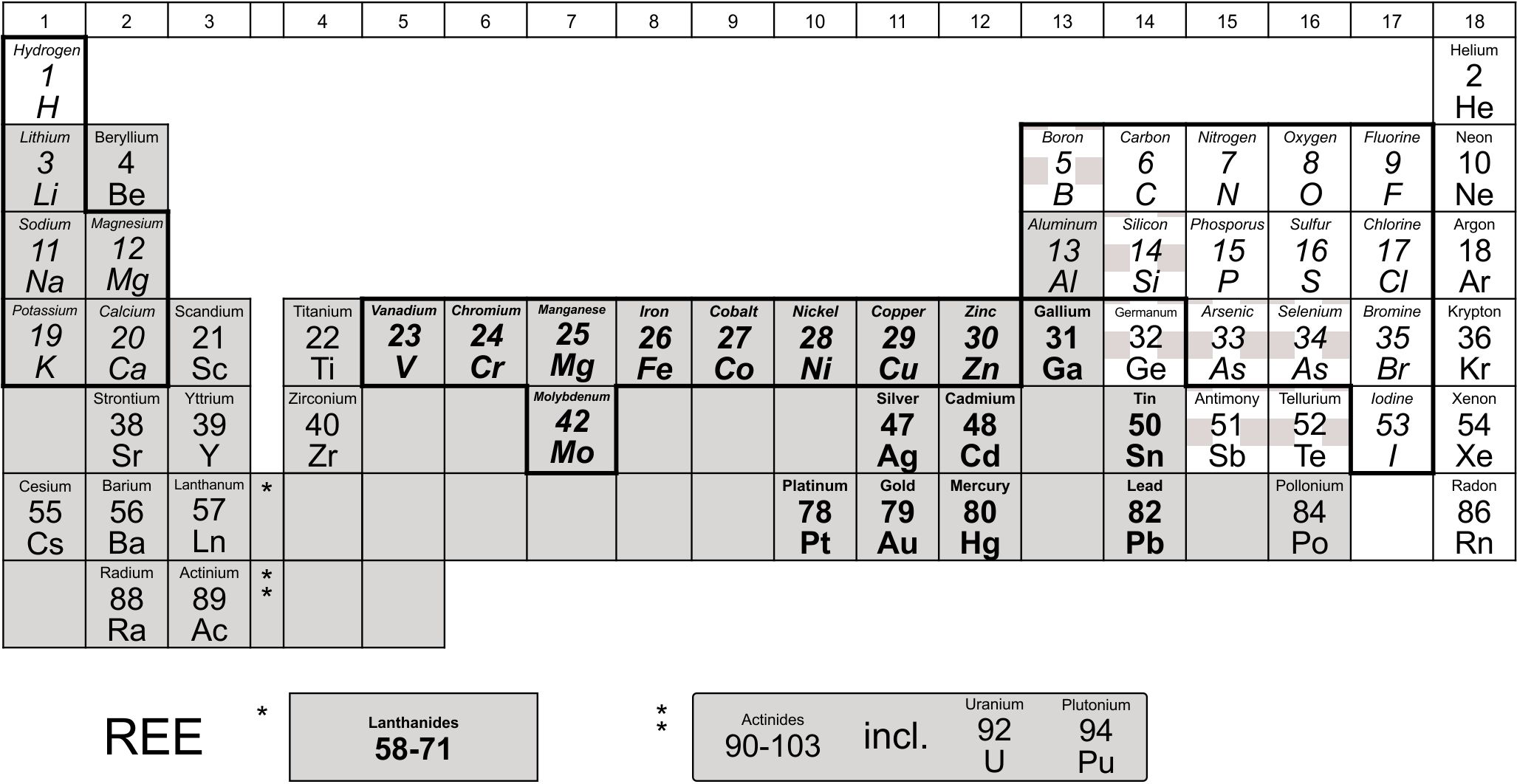
La distinción entre metales y metales pesados (densidad relativa al agua5 < or > g cm -3) no es muy significativa para un grupo tan heterogéneo de elementos con propiedades biológicas y químicas bastante diferentes. Los elementos de tierras raras (REE), lantánidos y actínidos, tienen, por ejemplo, una alta densidad o peso específico pero generalmente no se consideran metales pesados debido a su comportamiento químico bastante diferente. Los metaloides tienen propiedades tanto metálicas como no metálicas o son elementos no metálicos que pueden combinarse con un metal para producir una aleación. En la Figura 1 se muestra la tabla periódica de elementos, indicando los grupos de metales (pesados), metaloides y elementos de tierras raras.
También se indican en la Figura 1 los elementos que se sabe que son esenciales para la vida e incluyen además de C, H, O y N, los elementos esenciales principales Ca, P, K, Mg, Na, Cl y S, los oligoelementos Fe, I, Cu, Mn, Zn, Co, Mo, Se, Cr, Ni, V, Si, As y B (este último solo para plantas) y algunos elementos que pueden apoyar las funciones fisiológicas a niveles ultra-traza (Li, Al, F y Sn) (Walker et al., 2012).
Propiedades químicas y físicas
A excepción del mercurio, la mayoría de los metales puros son sólidos a temperatura ambiente. En general, los metales son buenos conductores eléctricos y térmicos que tienen alto brillo y maleabilidad. Al calentarse, los metales emiten electrones fácilmente. Estos descriptores de metales, sin embargo, no son muy útiles cuando se tienen que tratar con elementos que no existen de manera prominente en el estado elemental puro, sino que están presentes como compuestos metálicos, complejos e iones a concentraciones ambientales bastante bajas.
Más útiles son las características que influyen en el transporte de metales entre los compartimentos ambientales y su interacción con los componentes abióticos y bióticos del ambiente. La especiación, la forma química en la que se produce un elemento (p. ej., oxidado, ion libre o complejado con moléculas inorgánicas u orgánicas), determina su transporte e interacción en el ambiente (ver Sección Especiación Metálica). La unión química está determinada por el comportamiento externo de los electrones orbitales, con metales que tienden a perder electrones cuando reaccionan con no metales. En muchas reacciones biológicas normales, los metales son cofactores dentro de las coenzimas (por ejemplo, en vitaminas) y pueden actuar como aceptores y donantes de electrones durante las reacciones de oxidación y reducción (Newman, 2015).
Nieboer y Richardson (1980) propusieron una clasificación, basada en la constante de equilibrio para la formación de complejos metálicos. Distinguieron:
- Metales Clase A: actúan como ácidos de Lewis duros (aceptores de electrones) con alta afinidad por grupos que contienen oxígeno en macromoléculas, como los grupos carboxilo y alcohol. Al, Ba, Be, Ca, K, Li, Mg, Na y Sr pertenecen a este grupo;
- Metales Clase B: actúan como ácidos de Lewis blandos con alta afinidad por grupos que contienen nitrógeno y azufre en macromoléculas, como los grupos amino y sulfhidrilo. Este grupo incluye Ag, Au, Bi, Hg, Pd, Pt y Tl.
Además, se define un grupo intermedio o límite, en el que las características de tipo A o B son menos pronunciadas. Como, Cd, Co, Cr, Cu, Fe, Mn, Ni, Pb, Sb, Sn, Ti, V y Zn pertenecen a este grupo.
Esta clasificación de metales es altamente relevante para el transporte a través de las membranas celulares, el almacenamiento intercelular en gránulos y la inducción de proteínas de unión a metales, así como para su comportamiento en el ambiente en general.
Ocurrencia
Los metales (pesados) y los elementos de tierras raras se distribuyen difusamente sobre la Tierra, pero en algunos lugares ciertas combinaciones elementales están altamente concentradas (en minerales metálicos). A pesar de esta distribución difusa, las diferencias en las concentraciones de metales de fondo en los suelos pueden ser grandes, dependiendo del tipo y origen de roca o sedimento (Cuadro 1).
Cuadro 1. Concentraciones de fondo (mg/kg peso seco) de metales (pesados) y metaloides en el material de la corteza y concentraciones medias y máximas en diferentes suelos superiores del mundo. Derivado de Kabata-Pendias y Mukherjee (2007) y Alloway (2013).

En general, la roca volcánica (por ejemplo, basalto) contiene rocas altas y sedimentadas (por ejemplo, piedra caliza) bajos niveles de metal. Pero no hay relación entre las concentraciones de metales en la corteza terrestre y los requerimientos elementales de los organismos.
Emisiones de metales
Tras la meteorización de formaciones pétreas y minerales, los elementos se liberan y entran en ciclos biogeoquímicos locales, regionales y globales. Dependiendo de su solubilidad en agua y de las propiedades del suelo y la vegetación, los metales pueden ser transportados a través del ambiente y depositados o precipitados en lugares cercanos o alejados de su fuente.
Los volcanes tienen en cuenta el mayor aporte natural de metales al medio ambiente, pero las concentraciones de estos metales en el suelo rara vez se elevan a niveles tóxicos debido a la dilución masiva que tiene lugar en la atmósfera. Los volcanes permanentemente activos pueden ser una fuente local importante de contaminación (metálica).
Un caso especial es el arsénico, que puede ocurrir como elemento natural de los suelos. En algunos lugares, As los niveles son bastante altos, particularmente en aguas subterráneas. Las áreas de agua subterránea alta se encuentran en Argentina, Chile, México, China y Hungría, y también en Bangladesh, India (Bengala Occidental), Camboya, Laos y Vietnam. En estos últimos países, especialmente en la Cuenca de Bengala, se han excavado millones de pozos para proporcionar agua potable segura. El bombeo de riego conduce a una entrada de oxígeno y carbono orgánico, lo que provoca una movilización de arsénico normalmente unido a oxihidróxidos férricos en estos suelos. Como resultado en muchos pozos disueltos Las concentraciones de As están superando el valor orientativo de la Organización Mundial de la Salud (OMS) de 10 µg/L para el agua potable.
Las fuentes antropogénicas importantes de metales en el medio ambiente incluyen:
- La minería metálica, que también puede conducir a una enorme perturbación física del medio ambiente (destrucción de ecosistemas).
- Fundición de metales.
- Uso de metales en productos domésticos e industriales, y descarga de desechos domésticos y aguas residuales.
- Plaguicidas que contienen metales, por ejemplo, 'Mezcla de Burdeos (sulfato de cobre con cal (Ca (OH) 2), utilizada como fungicida en viticultura, lúpulo y cultivo de frutas, y fungicidas que contienen metales, como compuestos de órgano-estaño.
- El uso de metales y especialmente de REE en microelectrónica.
- Industrias productoras de energía que queman carbón y petróleo, y producen cenizas volantes que contienen metal.
- Transporte de energía y tráfico haciendo uso de la electricidad, dando lugar a la corrosión de cables eléctricos y pilones.
- Industrias no metálicas, por ejemplo, la producción de cuero (cromo) y cemento (talio).
- , utilizando Tetra Etil Plomo (TEL) como agente antidetonante en la gasolina (hoy en día prohibido en la mayoría de los países) y el uso de catalizadores en automóviles (platino, paladio).
Las liberaciones antropogénicas de muchos metales, como Pb, Zn, Cd y Cu, se estiman entre uno y tres órdenes de magnitud mayores que los flujos naturales (Depledge et al. 1998). Una cantidad estimada de hasta 50,000 toneladas de mercurio se liberan naturalmente al año como resultado de la desgasificación de la corteza terrestre, pero las actividades humanas representan emisiones aún mayores (Walker et al. 2012).
Referencias
Alloway, B.J. (2013). Metales Pesados en Suelos. Metales traza y metaloides en suelos y su biodisponibilidad. Tercera Edición. Contaminación Ambiental, Volumen 22, Springer, Dordrecht.
Depledge, M.H., Weeks, J.M., Bjerregaard, P. (1998). Metales pesados. En: Calow, P. (Ed.). Manual de Ecotoxicología. Blackwell Science, Oxford, pp. 543-569.
Kabata-Pendias, A., Mukherjee, A.B. (2007). Los oligoelementos del suelo al ser humano. Springer Verlag, Berlín.
Newman, M.C. (2015). Fundamentos de Ecotoxicología. La ciencia de la contaminación. Cuarta Edición. CRC Press, Taylor & Francis Group. Boca Ratón.
Nieboer, E., Richardson, D.H.S. (1990). La sustitución del término nodescripto 'metales pesados' por una clasificación biológica y químicamente significativa de iones metálicos. Contaminación Ambiental (Ser. B) 1, 3-26.
Walker, C.H., Hopkin, S.P., Sibly, R.M., Peakall, D.B. (2012). Principios de Ecotoxicología, Cuarta Edición. CRC Press Taylor & Francis Group, Londres.
¿Por qué no se puede usar el término heavy metal cuando se refiere a diferentes elementos considerados metales?
¿Por qué algunos elementos se indican como elementos esenciales?
¿Por qué es relevante la clasificación de Nieboer y Richardson para las interacciones biológicas de los metales con los organismos vivos?
Nombrar al menos 5 fuentes de emisión de metales al medio ambiente.
Además de conducir a la emisión de metales, la minería metálica puede ser otro efecto ambiental importante. ¿Cuál?
2.2.2. Compuestos radiactivos
en preparación
2.2.3. Productos Químicos Industriales
Autores: Steven Droge
Crítico: Michael McLachlan
Objetivos de Inclinación:
Deberías ser capaz de
- discutir una perspectiva histórica sobre legislaciones químicas clave en todo el mundo
- busque los expedientes de registro usted mismo para obtener información ecotoxicológica relevante
- darse cuenta de que los expedientes completos son más urgentes para las sustancias de alto tonelaje de producción y las sustancias más peligrosas
- entender por qué para algunos grupos de productos químicos ya estaban vigentes regulaciones específicas aparte de las sustancias industriales comunes.
Palabras clave: Industria química, tonelaje, químicos peligrosos, REACH, regulación
Introducción
La industria química produce una amplia variedad de químicos que encuentran uso en procesos industriales y como ingredientes en productos del día a día para los consumidores. En lugar de productos químicos, las 'sustancias' pueden ser una descripción más cuidadosamente redactada ya que también incluye mezclas complejas, polímeros y nanopartículas. Muchas sustancias son producidas por empresas distribuidas a nivel mundial en volúmenes muy altos, que van por ejemplo entre 100 y 10,000 toneladas (1 tonelada = 1000 kg) al año. En todo el mundo, los gobiernos han tratado de controlar y evaluar la seguridad química, como se resume muy bien en el sitio web de ChemHat. Australia por ejemplo, cuenta con la Ley de Productos Químicos Industriales (Notificación y Evaluación) de 1989 (versión 2013). Al igual que en otras partes del mundo, en la Unión Europea (UE) una variedad de institutos reguladores en todos los niveles de gobierno utilizan para realizar evaluaciones de seguridad con respecto al uso de sustancias en los productos, y cómo estas se emiten a las corrientes de desechos. Esto cambió drásticamente en 2007.
El 1 de junio de 2007 (Figura 1), entró en vigor un nuevo reglamento de la UE llamado REACH (documentos de legislación oficial C 1907/2006; sobre REACH; EU info sobre REACH). Esta ley revirtió el papel de los gobiernos en la evaluación de la seguridad química, porque colocó la carga de la prueba en las empresas que fabrican un químico, importan un químico a la UE o aplican químicos en sus productos. Dentro de REACH las empresas deben identificar y gestionar los riesgos vinculados a los productos químicos que fabrican y comercializan en la UE. REACH significa Registro, Evaluación, Autorización y Restricción de Sustancias Químicas. China pronto siguió con el análogo “China REACH” en 2010, y luego llegó Corea del Sur en 2015 con "K-REACH". El enfoque principal de este módulo está en EU-REACH como ejemplo líder y bien documentado. Otra legislación que regula los productos químicos industriales a menudo se puede encontrar fácilmente en línea, por ejemplo, a través del enlace ChemHat anterior.
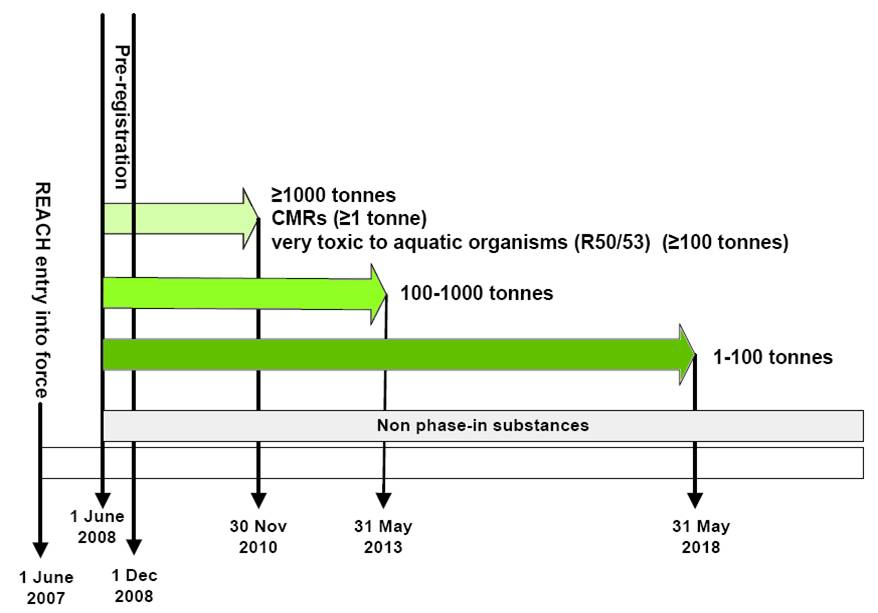
En REACH, cada químico se registra sólo una vez. En consecuencia, las empresas deben trabajar juntas para elaborar un dossier que demuestre a la Agencia Europea de Sustancias Químicas (ECHA) cómo se pueden utilizar los productos químicos de manera segura, y deben comunicar las medidas de gestión de riesgos a los usuarios. La ECHA, o cualquier Estado miembro, autoriza los expedientes, y puede iniciar un “procedimiento de restricción” cuando les preocupa que una determinada sustancia suponga un riesgo inaceptable para la salud humana o el medio ambiente. Si no se pueden gestionar los riesgos, las autoridades pueden restringir el uso de sustancias de distintas maneras. A la larga, las sustancias más peligrosas deben sustituirse por otras menos peligrosas.
Entonces, ¿qué químicos se han registrado en la última década (2008-2018) en REACH?
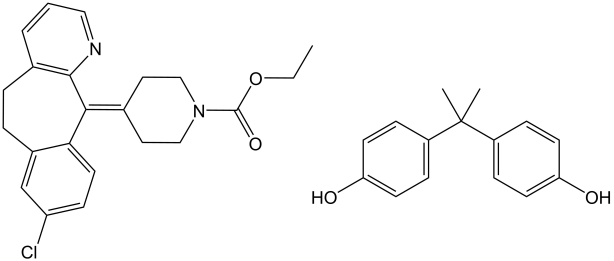
En principio, REACH se aplica a todas las 'sustancias' químicas en la zona de la UE. Esto incluye metales, como “hierro” y “cromo”, productos químicos orgánicos como “metanol” y “ácidos grasos” y “etil-4- (8-cloro-5,6-dihidro-11H-benzo [5,6] ciclohepta [1,2-b] piridin-11-iliden) piperidina-1-carboxilato (ver Recuadro 1)”, y (nano) partículas como “óxido de zinc” y “dióxido de silicio” , y polímeros. Descubre por ejemplo el enlace del dossier de registro en el Recuadro 1.
|
Caja 1. Ejemplos de los expedientes REACH La base de datos de registro REACH se puede buscar a través de LINK. Acepte el descargo de responsabilidad y estás listo para buscar productos químicos basados en el nombre, número CAS, datos de sustancias o datos de uso y exposición. Busca por ejemplo el nombre “etil 4- (8-cloro-5,6-dihidro-11H-benzo [5,6] ciclohepta [1,2-b] piridin-11-iliden) piperidina-1-carboxilato” y encuentra el link al expediente de esta sustancia con CAS 79794-75-5 compilado por el registrante. Este complejo nombre químico es mejor conocido como el medicamento antihistamínico Loratadina, ¡pero este nombre no aparece en la búsqueda de dossier! Haga clic en el nombre para obtener información básica sobre el compuesto. La clasificación de peligros dice: "¡Advertencia! Según la clasificación proporcionada por las empresas a la ECHA en los registros REACH esta sustancia es muy tóxica para la vida acuática, es muy tóxica para la vida acuática con efectos de larga duración, se sospecha que causa cáncer, causa irritación ocular grave, se sospecha que causa genética defectos, causa irritación de la piel, puede causar una reacción alérgica en la piel y puede causar irritación respiratoria. “Este compuesto está etiquetado con “PBT” basado en datos limitados disponibles (clasificándose como una combinación de Persistente/Bioacumulativo/Tóxico). No obstante, la sección [Acerca de esta sustancia] dice: “para uso industrial que resulte en la fabricación de otra sustancia (uso de intermedios)”. Como intermedio en un proceso restringido, muchas partes del expediente no tuvieron que ser completadas para REACH. Como medicamento, la loratadina está estrictamente regulada en otros lugares. Desplácese hacia abajo hasta el enlace REACH para el dossier de registro (... /21649) para conocer más las diferentes entradas para este químico.
Si hacemos una búsqueda de [” Bisfenol “], obtenemos una larga lista de químicos opcionales, por ejemplo Bisfenol A (CAS 80-05-7) pero también por ejemplo Bisfenol S si se desplaza más abajo (CAS 80-09-1). Si nos fijamos en el dossier de la primera entrada del Bisfenol A, con tonelaje “100 000 - 1 000 000 toneladas anuales”, se puede encontrar una larga lista de paquetes de información REACH además del dossier, ya que este químico es acaloradamente debatido. El dossier para Bisfenol A fue evaluado en 2013, y también este está disponible (busque el pdf en el estado de evaluación del Dossier). En esta verificación de cumplimiento, se solicita al registrante que presente datos adicionales de toxicidad en ratas y ratones, junto con declaraciones de motivos. Existe por ejemplo también un enlace a la [Lista de restricción (anexo XVII)], que conduce a un pdf llamado 66.pdf, que establece una restricción adoptada para este químico dentro del marco REACH y la legislación anterior, la Directiva 76/769/CEE: “No se pondrá en el mercado en papel térmico en concentración igual o superior al 0,02% en peso después del 2 de enero de 2020". Encuentre su propio químico de interés para descubrir más sobre la transparencia de la información química en la que se basa la evaluación de riesgos. |
Sin embargo, algunos grupos de químicos están (en parte) exentos de REACH porque están cubiertos por otra legislación de la UE:
- Se considera que las sustancias activas utilizadas en los productos fitosanitarios (sección 2.3.1) y los biocidas (sección 2.3.2) ya han sido registradas y evaluadas por institutos independientes de la ECHA. Los biocidas como los desinfectantes y los productos para el control de plagas son por definición químicos peligrosos, pero también son muy útiles de muchas maneras. Las leyes muy estrictas y elaboradas sobre biocidas tienen como objetivo verificar que el riesgo potencial de daño asociado a los escenarios de emisión previstos esté en equilibrio con los beneficios esperados.
- Los aditivos para alimentos y piensos (Sección 2.3.9) tienen diferentes legislaciones y leyes de autorización para demostrar (tras una evaluación científica) que el aditivo no tiene efectos nocivos sobre la salud humana y animal o sobre el medio ambiente (desarrollado desde 1988, gráfico esquemático , Reglamento (CE) no 1331/2008)
- Los medicamentos (Secciones 2.3.3 y 2.3.4) cuentan con diferentes legislaciones y leyes de autorización para garantizar altos estándares de calidad e inocuidad de los medicamentos, al tiempo que promueven el buen funcionamiento del mercado interior con medidas que fomenten la innovación y competitividad (a partir de la Directiva 65/65 en 1965, una visión general desde, un pdf de la legislación 2001 de la UE 2001/83/CE)
- “Residuos” no forma parte del dominio REACH, pero un producto recuperado de los desechos no lo es.
En la Figura 2 de Van Wezel et al. (2017) se presenta una descripción detallada de las directrices europeas de seguridad química relacionadas con los productos químicos con diferentes tipos de aplicación.
Tras el preregistro de los 145 mil 297 químicos con mayor probabilidad de requerir regulación, REACH entró en vigor en 2008 en un proceso gradual con diferentes plazos para diferentes grupos de químicos. Los primeros expedientes debían completarse para 2010 para los productos químicos de mayor volumen producido (>1000 toneladas/año) y los químicos más peligrosos (CMR >1 tonelada/año, y químicos con toxicidad acuática muy alta conocida >100 toneladas/año). Estos grupos representan potencialmente el mayor riesgo ya sea por sus altas emisiones o por su toxicidad inherente. En 2013 se debían completar los expedientes de registro de productos químicos de menor tonelaje (100-1000 toneladas/año). Para el 31 de mayo de 2018, todos los productos químicos con una cantidad de 1-100 toneladas/año de productos químicos en el mercado de la UE deberían haber sido registrados. Los nuevos químicos estarán sujetos a los procedimientos REACH.
En 2018 se habían registrado 21.787 sustancias bajo REACH. Un total de 14.262 empresas estuvieron involucradas. En comparación, en 2016 se registraron 15.500 sustancias (es decir, se agregaron 6287 productos químicos en los dos años siguientes). En 2018, 48% de todos los registros de sustancias se habían realizado en Alemania. Para 24% de las sustancias registradas ya se disponía de un expediente previo a REACH, 70% son “productos químicos antiguos” para los que no se había realizado ningún registro antes de que se iniciara REACH, y sólo 6% son sustancias de reciente desarrollo que necesitaban registrarse antes de que pudiera comenzar la fabricación o importación.
Existen múltiples beneficios de la regulación REACH de los productos químicos industriales. La mayoría de los datos sobre los productos químicos ingresados en el proceso de registro están disponibles públicamente, creando transparencia y mejorando la conciencia del cliente. Si los químicos registrados se clasifican como Sustancia de Muy Alta Preocupación (SVHC) con base en la información química en estos dossiers y previo acuerdo de paneles de investigación, se pueden sugerir alternativas que aprobaron la misma regulación.
La necesidad de agregar datos sobre la toxicidad potencial de tantos productos químicos se ha combinado con un fuerte enfoque en, y un mayor desarrollo de, métodos de prueba amigables con los animales. La lectura de los productos químicos relacionados, los enfoques del peso de la evidencia y los cálculos basados en estructuras químicas (QSAR) permiten eludir muchas pruebas experimentales. También se utilizan estudios in vitro, pero un documento REACH 2017 (alternativas REACH a las pruebas en animales 2017, que dio seguimiento a los informes de 2011 y 2014) informa que se utilizaron 5.795 estudios in vitro en general para determinar los criterios de valoración para REACH, en comparación con 9,287 in vivo estudios (relación de 0.6). Claramente, se han realizado muchos nuevos ensayos con animales bajo REACH para completar los expedientes sobre productos químicos industriales. Las pruebas de desarrollo prenatal y de toxicidad a dosis repetidas, así como los estudios extendidos de toxicidad reproductiva de una generación siguen siendo difíciles de eludir sin uso animal. Sin embargo, se debe garantizar y demostrar el uso seguro de los productos químicos industriales.
Referencias:
Van Wezel, A.P., Ter Laak, T.L., Fischer, A., Bäuerlein, P.S., Munthee, J., Posthuma, L. (2017). Opciones de mitigación para productos químicos de preocupación emergente en aguas superficiales; evaluación de riesgos centrada en soluciones operativas. Ciencia Ambiental: Investigación del Agua 3, 403-414.
Nombrar tres ventajas importantes de la puesta en marcha de una legislación química internacional como REACH.
Nombrar tres desafíos importantes, o incluso desventajas, de la puesta en marcha de una legislación química internacional como REACH.
El monto total de sustancias químicas para las que se han designado números CAS, fue de 68,062,538 el 28 de junio de 2019. El REGISTRO CAS se actualiza diariamente con miles de nuevas sustancias. Proporcione algunas razones por las que solo se han registrado 21,787 sustancias para REACH en 2018.
2.2.4. POPs
(borrador)
Autores: Jacob de Boer
Revisor:
Objetivos de Inclinación:
Deberías ser capaz de
- comprender cómo se definen los POP
- reconocer las estructuras químicas de los COP
- adquirir conocimientos sobre los propósitos del Convenio de Estocolmo sobre COP
Palabras clave: Persistencia, bioacumulación, transporte de largo alcance, toxicidad, análisis
Introducción
Los químicos generalmente se producen porque tienen un propósito útil. Estos propósitos pueden variar ampliamente, como proteger los cultivos matando insectos u hongos dañinos, proteger los materiales contra el fuego, actuar como medicamento, permitir un empaque adecuado de materiales alimenticios, etc. Desafortunadamente, las propiedades que hacen que un químico sea atractivo de usar, a menudo tienen un inconveniente cuando se viene al comportamiento ambiental y/o a la salud humana. Una serie de químicos sintéticos tienen propiedades que los convierten en contaminantes orgánicos persistentes (COP). Los COP son sustancias químicas xenobióticas (ajenas a la biosfera) que son persistentes, bioacumulativas y tóxicas ('PBT') en dosis bajas. Además, se transportan a largas distancias. Los criterios para estas propiedades, que se utilizan para definir un químico como POP, fueron establecidos por el Convenio de Estocolmo de las Naciones Unidas (ONU), el cual fue adoptado en 2001 y entró en vigor en 2004 (Fiedler et al., 2019). Estos criterios se resumen en el Cuadro 1 (http://chm.pops.int). El objetivo del Convenio de Estocolmo se define en el artículo 1: “Consciente del enfoque precautorio, para proteger la salud humana y el medio ambiente de los impactos nocivos de los contaminantes orgánicos persistentes”. Inicialmente, 12 productos químicos (aldrina, clordano, dieldrina, DDT, endrina, heptacloro, hexaclorobenceno (HCB), mirex, bifenilos policlorados (PCB), dibenzo- p-dioxinas policloradas (PCDD), dibenzofuranos policlorados (PCDF) y toxafeno) se incluyeron como COP. Poco a poco se amplió la lista con nuevos COP, los cuales parecían cumplir con los criterios. Para algunos de los nuevos químicos se hicieron excepciones para uso limitado, en caso de que no se disponga de alternativas adecuadas. Por ejemplo, en la batalla contra la malaria, el DDT todavía se puede utilizar de manera limitada para la fumigación interna en África (Van den Berg, 2009). Hasta ahora todos los COP son químicos que contienen átomos de carbono y halógeno. Algunos COP, como los PCDD y los PCDF (juntos a menudo denominados dioxinas) no se producen intencionalmente. Se forman y liberan involuntariamente durante los procesos térmicos. Los PCDD y los PCDF tendían a ser liberados por los incineradores de desechos (Karasek y Dickson, 1987). La combinación de temperaturas elevadas y la presencia de cloro de, por ejemplo, cloruro de polivinilo (PVC) condujo a la formación de los PCDD y PCDF extremadamente tóxicos. Las emisiones de apilamiento podrían contaminar áreas enteras alrededor de los incineradores con consecuencias para la calidad de la leche de vaca o el cultivo local. Las dioxinas se descubrieron por primera vez después del desastre de Seveso (Italia) (1976) cuando se liberaron altas cantidades de dioxinas después de una explosión en una fábrica de triclorofenol (Mocarelli et al., 1991). En tanto, en muchos países se han mejorado las incineradoras cambiando los procesos e instalando los filtros adecuados.
Cuadro 1. Criterios del Convenio de Estocolmo para la persistencia, bioacumulación, toxicidad y transporte a larga distancia de COP.
|
Persistencia |
|
|
i |
Evidencia de que la vida media del químico en el agua es mayor de dos meses, o que su vida media en el suelo es mayor de seis meses, o que su vida media en el sedimento es mayor de seis meses; o |
|
ii |
Evidencia de que el químico es lo suficientemente persistente como para justificar su consideración dentro del ámbito de la presente Convención |
|
Bioacumulación |
|
|
i |
Evidencia de que el factor de bioconcentración o factor de bioacumulación en especies acuáticas para el químico es mayor a 5,000 o, en ausencia de dichos datos, que el log K ow es mayor a 5 |
|
ii |
Evidencia de que una sustancia química presenta otras razones de preocupación, como alta bioacumulación en otras especies, alta toxicidad o ecotoxicidad; o |
|
iii |
Datos de monitoreo en biota que indican que el potencial de bioacumulación del el producto químico es suficiente para justificar su consideración dentro del ámbito de la presente Convención |
|
Potencial de transporte de largo alcance |
|
|
i |
Niveles medidos del químico en lugares distantes de las fuentes de su liberación que son de posible preocupación |
|
ii |
Datos de vigilancia que muestran que el transporte ambiental a largo plazo del producto químico, con el potencial de transferencia a un ambiente receptor, puede haber ocurrido vía aérea, agua o especies migratorias; o |
|
iii |
Propiedades del destino ambiental y/o resultados del modelo que demuestran que el químico tiene potencial para el transporte ambiental de largo alcance a través del aire, el agua o especies migratorias, con el potencial de transferencia a un ambiente receptor en lugares distantes de las fuentes de su liberación. Para una sustancia química que migra significativamente a través del aire, su vida media en el aire debe ser mayor a dos días |
|
Efectos adversos |
|
|
i |
Evidencia de efectos adversos para la salud humana o para el medio ambiente que justifiquen la consideración del producto químico dentro del ámbito de la presente Convención; o |
|
ii |
Datos de toxicidad o ecotoxicidad que indiquen el potencial de daño a la salud humana o al medio ambiente |
Estructuras y uso
Mientras que todos los COP iniciales eran productos químicos clorados y principalmente pesticidas, los COP que se agregaron en una etapa posterior también incluyeron compuestos bromados y fluorados y químicos con una aplicación más industrial. Los difenileteres bromados (PBDE) y hexabromociclododecano (HBCD) pertenecen al grupo de retardantes de llama bromados. Estos químicos se están produciendo en grandes cantidades. Muchas legislaciones nacionales requieren el uso de retardantes de llama en muchos materiales, como los sistemas eléctricos y electrónicos (TV, teléfonos celulares, computadoras), muebles y materiales de construcción. Si bien los PBDE y HBCD han sido prohibidos en la mayoría de los países, se siguen produciendo otros retardantes de llama bromados en volúmenes de crecimiento anual.
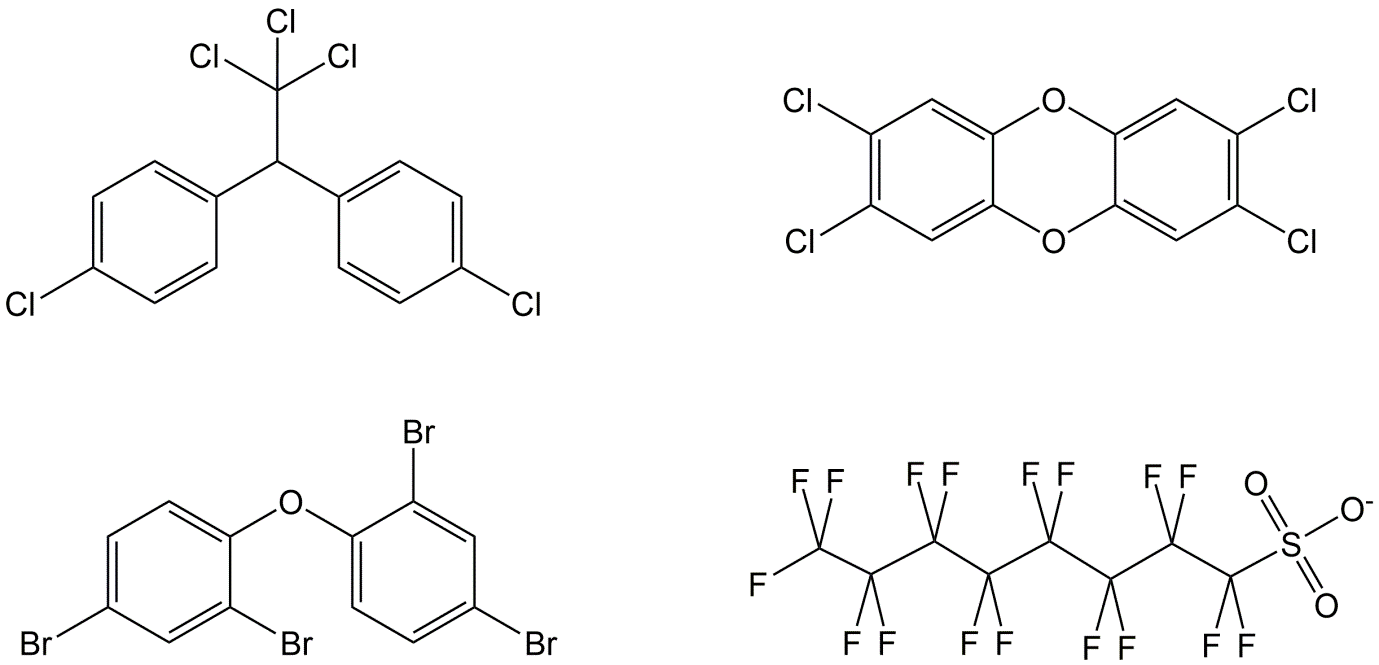
Las sustancias alquílicas perfluoradas (PFAS) tienen muchas aplicaciones. Ejemplos son la producción de teflón, el uso en espumas contra incendios, cera de esquí, como repelente de suciedad y agua en ropa de exterior y alfombras y muchos más. Son diferentes de la mayoría de los otros COP porque son tanto lipófilos como hidrófilos debido a un grupo polar presente en la mayoría de las moléculas. En la Figura 1 se dan ejemplos de estructuras de algunos COP.
Persistencia y bioacumulación
El enlace carbono-halógeno es tan fuerte que es poco probable que ocurra cualquier tipo de degradación o solo ocurrirá a largo plazo y en menor medida. Debido al tamaño del átomo de halógeno, la fuerza del enlace halógeno-carbono disminuye de C-F a C-Cl, C-Br y C-I. Además, estos químicos halogenados son lipófilos y, por lo tanto, migran fácilmente a lípidos, como en organismos vivos. Debido a que el pescado es un objetivo primario, los COP ingresan a la cadena alimentaria de esta manera y se puede producir biomagnificación (De Boer et al., 1998). Los altos niveles de COP se encuentran, en consecuencia, en mamíferos marinos (focas, ballenas, osos polares) y también en humanos (Meironyte, 1999). Las mujeres pueden transferir una parte de su carga de POP nuevamente a sus hijos, las cantidades más altas a sus primogénitos.
Transporte de largo alcance
Los químicos que migran significativamente a través del aire con una vida media en el aire mayor a dos días califican para el criterio POP del transporte de largo alcance. De hecho, muchos productos químicos son transportados por aire, a menudo en diferentes etapas. Los químicos se emiten desde una pila o se evaporan del suelo en áreas relativamente cálidas y viajan en la atmósfera hacia áreas más frías, condensándose nuevamente cuando baja la temperatura. Este proceso, repetido en 'lúpulo', puede llevarlos miles de kilómetros en cuestión de días. Esto se denomina “efecto saltamontes” (Gouin et al., 2004). Se traduce en zonas de clima más frío, en particular países alrededor del Polo Norte, recibiendo cantidades relativamente altas de COP.
Efectos adversos sobre el medio ambiente y la salud
Hay muy pocas dudas sobre la toxicidad de los COP. Por supuesto, la dosis siempre está determinando si un compuesto está causando un efecto en el medio ambiente o en humanos. Los COP, sin embargo, son muy tóxicos a dosis muy bajas. El desastre de Seveso mostró la alta toxicidad de las dioxinas para los humanos. Los bifenilos polibromados (PBB) causaron una alta mortalidad en el ganado cuando fueron alimentados inadvertidamente con estos químicos (Fries y Kimbrough, 2008). La evidencia de toxicidad suele provenir de estudios de laboratorio con animales (in vivo) y más recientemente de estudios in vitro. Estos estudios son particularmente importantes para la evaluación de la toxicidad crónica. Muchos COP son cancerígenos o actúan como disruptores endocrinos.
Análisis
El análisis de COP en matrices ambientales o humanas es relativamente complicado y costoso. Los compuestos necesitan ser aislados de la matriz por extracción. Posteriormente, los extractos necesitan ser limpiados de compuestos interferentes como grasa de organismos o azufre en caso de muestras de sedimentos o suelo. Finalmente, debido a la sensibilidad y selectividad requeridas, para su análisis se necesita instrumentación costosa como la cromatografía de gases o líquidos combinada con espectrometría de masas (Muir y Sverko, 2006). ONU Medio Ambiente está invirtiendo en grandes programas de desarrollo de capacidades para formar laboratorios en países en desarrollo en este tipo de análisis. De acuerdo con el Convenio de Estocolmo, los países gestionarán las existencias y desechos que contengan COP de manera que proteja la salud humana y el medio ambiente. Los COP en los desechos no pueden ser reutilizados o reciclados. Se ha instalado un programa de monitoreo global para evaluar la efectividad de la Convención.
Futuro
Mucho se tiene que hacer para lograr los objetivos originales de eliminar la producción y el uso de COP y reducir gradualmente su propagación al medio ambiente. Un tratado global como el Convenio de Estocolmo con 182 países involucrados se encuentra en un desafío continuo con procedimientos y realidades políticas en los países, que obstaculizan el logro de objetivos simples percibidos como eliminar el uso de PCB en 2025. Los objetivos son, sin embargo, sumamente importantes, ya que los COP son una amenaza global para las generaciones actuales y futuras.
Referencias
De Boer, J., Wester, P.G., Klamer, J.C., Lewis, W.E., Boon, J.P. (1998). Retardantes de llama bromados en cachalotes y otros mamíferos marinos, ¿una nueva amenaza para la vida oceánica? Naturaleza 394, 28-29.
Fiedler, H., Kallenborn, R., de Boer, J., Sydnes, L.K. (2019). Programa de las Naciones Unidas para el Medio Ambiente (PNUMA): El Convenio de Estocolmo - Una herramienta para la regulación mundial de contaminantes orgánicos persistentes (COP). Chem. Pasante. 41, 4-11.
Fries, G.F., Kimbrough, R.D. (2008). El episodio de PBB en Michigan: Una valoración general. CRC Crítico Rev. Toxicol. 16, 105-156.
Gouin, T., Mackay, D., Jones, K.C., Harner, T., Meijer, S.N. (2004). Evidencia del efecto “saltamontes” y fraccionamiento durante el transporte atmosférico a largo alcance de contaminantes orgánicos. El medio ambiente. Contaminar. 128, 139-148.
Karasek, F.W., Dickson, L.C. (1987). Estudios modelo de formación de dibenzo-p-dioxinas policloradas durante la incineración de basura municipal. Ciencia 237, 754-756.
Meironyte, D., Noren, K., Bergman, Å. (1999). Análisis de éteres de difenilo polibromados en leche humana sueca. Un estudio de tendencias relacionadas con el tiempo, 1972-1997. J. Toxicol. El medio ambiente. Salud Parte A 58, 329-341.
Mocarelli, P., Needham, L.L., Marocchi, A., Patterson Jr., D.G., Brambilla, P., Gerthoux, P.M. (1991). Concentraciones séricas de 2,3,7,8‐tetraclorodibenzo‐p‐dioxina y resultados de pruebas de residentes seleccionados de Seveso, Italia. J. Toxicol. El medio ambiente. Salud 32, 357-366.
Muir, D.C.G., Sverko, E. (2006). Métodos analíticos para PCB y plaguicidas organoclorados en monitoreo y vigilancia ambiental: una valoración crítica. Anal. Bioanal. Chem. 386, 769-789.
Van den Berg H. (2009). Situación global del DDT y sus alternativas para su uso en el control de vectores para prevenir enfermedades. El medio ambiente. Perspectiva de la salud. 117:1656-63.
¿Qué criterios utiliza el Convenio de Estocolmo para definir los productos químicos como COP?
¿Cuáles son los objetivos del Convenio de Estocolmo sobre COP?
¿Cómo se pueden formar las dioxinas?
¿Por qué es costoso el análisis de COP en matrices ambientales y humanas?
2.2.5. Sustancias químicas orgánicas móviles persistentes (PMOC)
Autores: Pim de Voogt
Críticos: John Parsons, Hans Peter Arp
Objetivos de Inclinación:
Deberías ser capaz de:
- definir la persistencia de una sustancia
- definir un coeficiente de partición
- entender la relación entre K OW, D OW, K D y movilidad
- comprender la relación entre la movilidad y persistencia de una sustancia por un lado y su potencial de exposición humana por el otro
Palabras clave: Movilidad, persistencia, PMT
Introducción
Los ecosistemas y los humanos están protegidos contra la exposición a sustancias peligrosas de varias maneras. Estos incluyen el tratamiento de nuestras aguas residuales para evitar que las sustancias entren en las aguas superficiales receptoras, y la purificación de las aguas fuente destinadas a la producción de agua potable.
Actualmente, la mayor parte del agua potable producida en Europa no es tratada o tratada por tecnologías convencionales. Estos últimos eliminan sustancias por degradación (física, microbiológica) o por sorción. Sin embargo, los químicos que son difíciles de descomponer y que pueden pasar a través de capas de suelo, cuencas de captación de agua y riberas de ríos y cruzar barreras naturales y tecnológicas eventualmente pueden llegar al agua del grifo. Por lo general, estos químicos son persistentes y móviles.
Polaridad
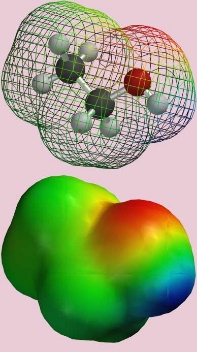
Cuando los electrones en una molécula se dividen de manera desigual sobre su superficie, esto da como resultado una distribución asimétrica de carga, con regiones positivas y negativas. Dichas moléculas tienen dipolos eléctricos (ver Figura 1) y son polares, en contraste con las moléculas donde la carga se distribuye uniformemente dando como resultado que la molécula sea neutra o apolar. La forma última de polaridad es cuando una carga permanente está presente en un compuesto. Tales químicos se llaman ionogénicos. Distinguimos entre cationes (que tienen una carga positiva permanente, por ejemplo bases protonadas y aminas cuaternarias) y aniones (iones cargados negativamente, por ejemplo, ácidos disociados y organosulfatos). Las cargas iónicas en las moléculas pueden ser dependientes del pH (por ejemplo, ácidos y bases). La mayoría, y en particular los pequeños, los químicos polares e iónicos son solubles en agua, es decir, tienen una fuerte afinidad por el agua (a menudo denominados hidrófilos). Debido a que el agua es uno de los líquidos más polares posibles (una fuerte carga negativa sobre el oxígeno y dos fuertes cargas positivas en cada hidrógeno), esto significa que para moléculas orgánicas muy polares la solvatación por el agua es más favorable energéticamente que la sorción a partículas sólidas.
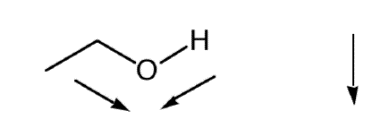
Los químicos no polares son inherentemente poco solubles en agua y, por lo tanto, tienden a escapar del compartimento de agua, lo que resulta en su evaporación, o sorción a sedimentos y suelos, o absorción y acumulación en organismos. Por lo tanto, es relativamente fácil eliminarlos del agua durante el tratamiento del agua. En contraste, los químicos orgánicos móviles, especialmente aquellos que no se descomponen fácilmente, representan una amenaza más grave para la calidad del agua (potable) porque son mucho más difíciles de eliminar. Cabe señalar que la movilidad y polaridad se puede considerar como un gradiente, más que una categoría distinta, siendo el agua la molécula más polar, una cera alifática grande siendo la molécula más no polar, y todas las demás moléculas orgánicas cayendo en algún lugar del espectro entre ellas.
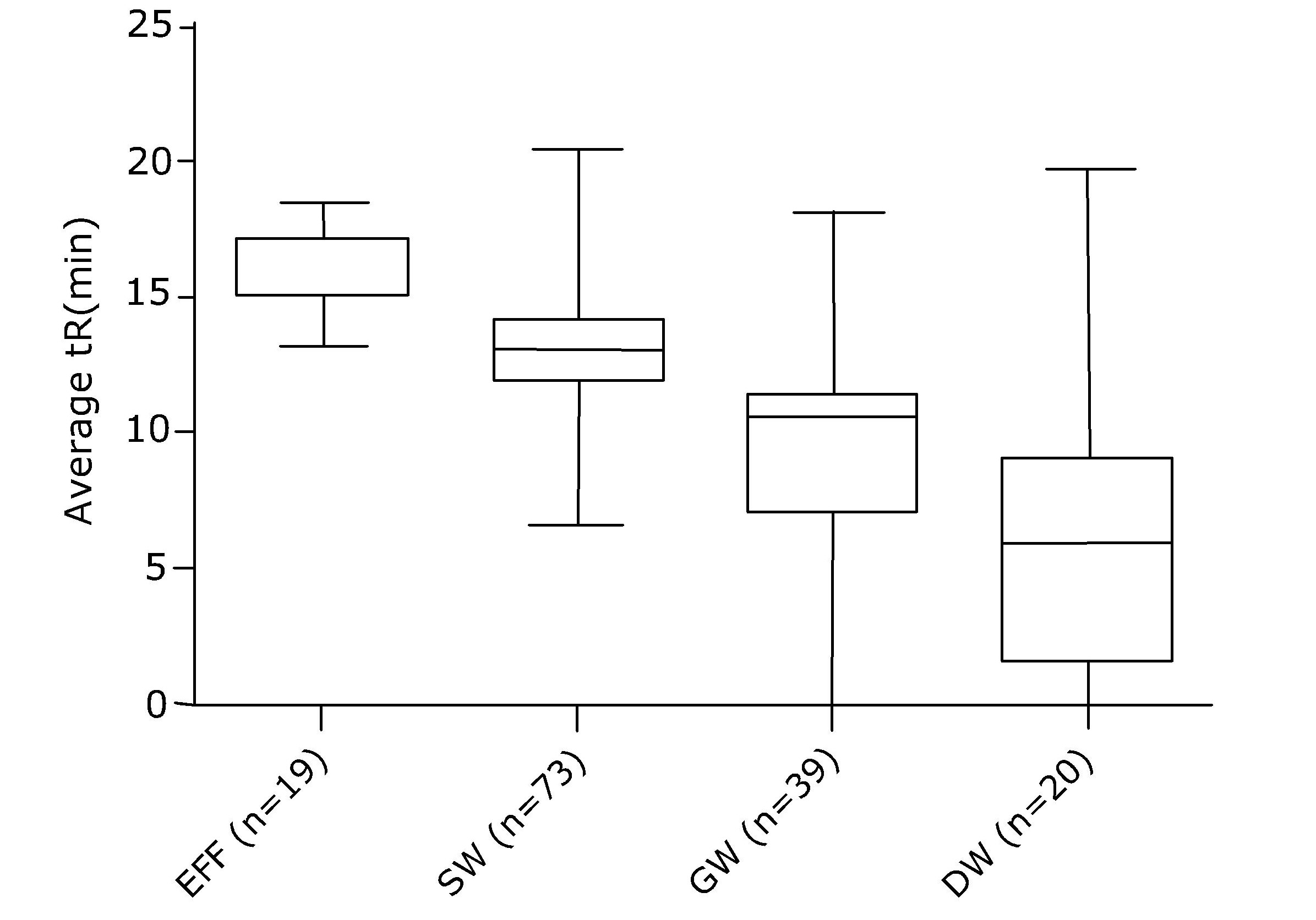
En un estudio reciente se analizaron contaminantes en muestras de agua holandesas que cubren el viaje del efluente de la EDAR a las aguas superficiales a las aguas subterráneas y luego al agua potable. Mientras que el nivel de concentración de contaminantes orgánicos totales disminuyó en aproximadamente 2 órdenes de magnitud desde los efluentes de la EDAR hasta el agua subterránea utilizada para la producción de agua potable, los contaminantes hidrófilos (utilizando el tiempo de retención cromatográfica como indicador de hidrofilicidad) en los efluentes de la EDAR permanecieron en el agua a lo largo de su paso a las aguas subterráneas y al agua potable (ver Figura 2).
Movilidad y persistencia
La movilidad de los químicos en los ecosistemas acuáticos está determinada por su distribución entre el agua y las partículas sólidas. Cuanto más afinidad tenga la sustancia por la fase sólida, menos móvil será. El coeficiente de distribución se conoce como K D, el cual expresa la relación entre las concentraciones en la fase sólida (suelo, sedimento, partículas suspendidas), C S, y la fase disuelta en equilibrio, C W, es decir, K D = C S /C W. Para los productos químicos neutros no polares la distribución está determinada casi en su totalidad por la cantidad de carbono orgánico en la fase sólida, f OC, y por lo tanto su distribución suele ser expresada por K OC, el K D normalizado por carbono orgánico (es decir, K OC = K D/ f OC). Desafortunadamente, hay relativamente pocos datos confiables de K D o K OC disponibles, en particular para productos químicos polares. En cambio, K OW se usa a menudo como proxy para K OC. El coeficiente de reparto n-octanol/agua: K OW, es el coeficiente de distribución de equilibrio de un químico entre n-octanol y agua, K OW = C octanol /C agua. Su valor logarítmico a menudo se usa como un proxy para expresar la polaridad de un compuesto: un log K OW alto significa que el compuesto favorece estar en la fase de octanol en lugar de en agua, lo que suele ser el caso de un compuesto no polar. Para los químicos ionizables necesitamos dar cuenta de la dependencia del pH de K OW: a pH bajo un ácido orgánico se protonará (esto a su vez depende de su valor pK a) y por lo tanto menos polar. D OW es el K OW dependiente del pH. Se puede suponer que los iones, ya sean catiónicos o aniónicos, ya no se disolverán en octanol sino que se retendrán en el agua, ya que los iones tienen una afinidad mucho mayor por el agua que por el octanol.
Contabilizando esto, para los ácidos orgánicos, la dependencia del pH del D OW se puede expresar como:

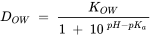
Por lo tanto, a medida que el pH aumente por encima del pKa, cuanto menor sea el D OW obtendrá en el caso de los ácidos orgánicos. En el caso de la base, lo contrario es cierto; cuanto más baje el pH por debajo del pKa de una base orgánica, más cationes se forman y menor se vuelve el Dow.
Sin embargo, hay que tener en cuenta que la suposición de que el valor (log) K OW o D OW se correlaciona inversamente con la movilidad acuática de un compuesto es, ciertamente, muy simplista. El comportamiento de un soluto iónico obviamente también se determinará por interacciones i) con sitios distintos del carbono orgánico, por ejemplo, sitios ionizables o iónicos en el suelo y partículas de sedimentos, y ii) con otros iones en solución.
La persistencia de un compuesto se evalúa en pruebas experimentales mediante el monitoreo de la tasa de desaparición del compuesto del compartimento más relevante. Esto a menudo se hace usando protocolos de prueba estandarizados. En la legislación europea REACH de productos químicos, se han establecido criterios para calificar a los químicos como persistentes (P) y “muy persistentes" (vP) basados en los resultados de tales pruebas. En el Cuadro 1 se presentan los criterios P y vP utilizados. Desafortunadamente, los datos experimentales de buena calidad sobre vidas medias son raros y la obtención de dichos datos requiere pruebas costosas y costosas.
Actualmente no existe una definición certificada de movilidad de un compuesto (M). Se han propuesto varias propiedades posibles del compuesto para caracterizar la movilidad, incluyendo la solubilidad acuosa de un compuesto o su valor K OC. Si los valores K OC (experimentales) no están disponibles, los valores D OW se pueden usar como proxy.
Cuadro 1. Criterios P y vP idénticos al Anexo XIII del reglamento REACH (fuente: ECHA capítulo R.11. Versión 3.0, Junio 2017)
|
Persistente (P) en cualquiera de las siguientes situaciones |
Muy persistente (vP) en cualquiera de las siguientes situaciones |
|
|
Agua Dulce |
Vida media > 40 días |
Vida media > 60 días |
|
Agua marina |
Vida media > 60 días |
Vida media > 60 días |
|
Sedimento de agua dulce |
Vida media > 120 días |
Vida media > 180 días |
|
Sedimento marino |
Vida media > 180 días |
Vida media > 180 días |
|
Suelo |
Vida media > 120 días |
Vida media > 180 días |
Cuadro 2. Valores de corte propuestos por la Agencia Alemana del Medio Ambiente (UBA) para definir la movilidad de sustancias*
|
Móvil (M) si el compuesto es P o vP y cualquiera de las siguientes situaciones |
muy Móvil (mV) si el compuesto es P o vP y cualquiera de las siguientes situaciones |
|
|
Log experimental más bajo K OC (a pH 4-9) |
≤4.0 |
≤3.0 |
|
Log D OW (a pH 4-9) |
≤4.0 si no hay experimental Datos de Log K OC disponibles |
≤3.0 si no hay experimental Datos de Log K OC disponibles |
* señalar que los criterios propuestos pueden cambiar en el momento de la publicación
Regulación y brechas en el conocimiento
La mayoría de los productos químicos para los que existen directrices internacionales o que se identifican como contaminantes prioritarios en las regulaciones existentes (por ejemplo, la Directiva Marco del Agua de la UE y REACH), son no polares con valores log D OW mayormente superiores a dos (ver Figura 3b). El Ministerio de Medio Ambiente alemán (UBA) ha propuesto recientemente desarrollar una regulación para los productos químicos con propiedades P, M y tóxicas (T) (sustancias PMT) análogas a los criterios PBT existentes utilizados para la regulación de los productos químicos en la UE. UBA propuso utilizar valores de corte del OC K o D OW (si no se dispone de datos K OC) para definir Móvil (M) o muy móvil (mV) en conjunto con criterios de persistencia (ver Tabla 2). Obsérvese que los valores de K OC y D OW tienen que obtenerse a partir de pruebas en un rango de pH ambientalmente relevante (pH 4-9).
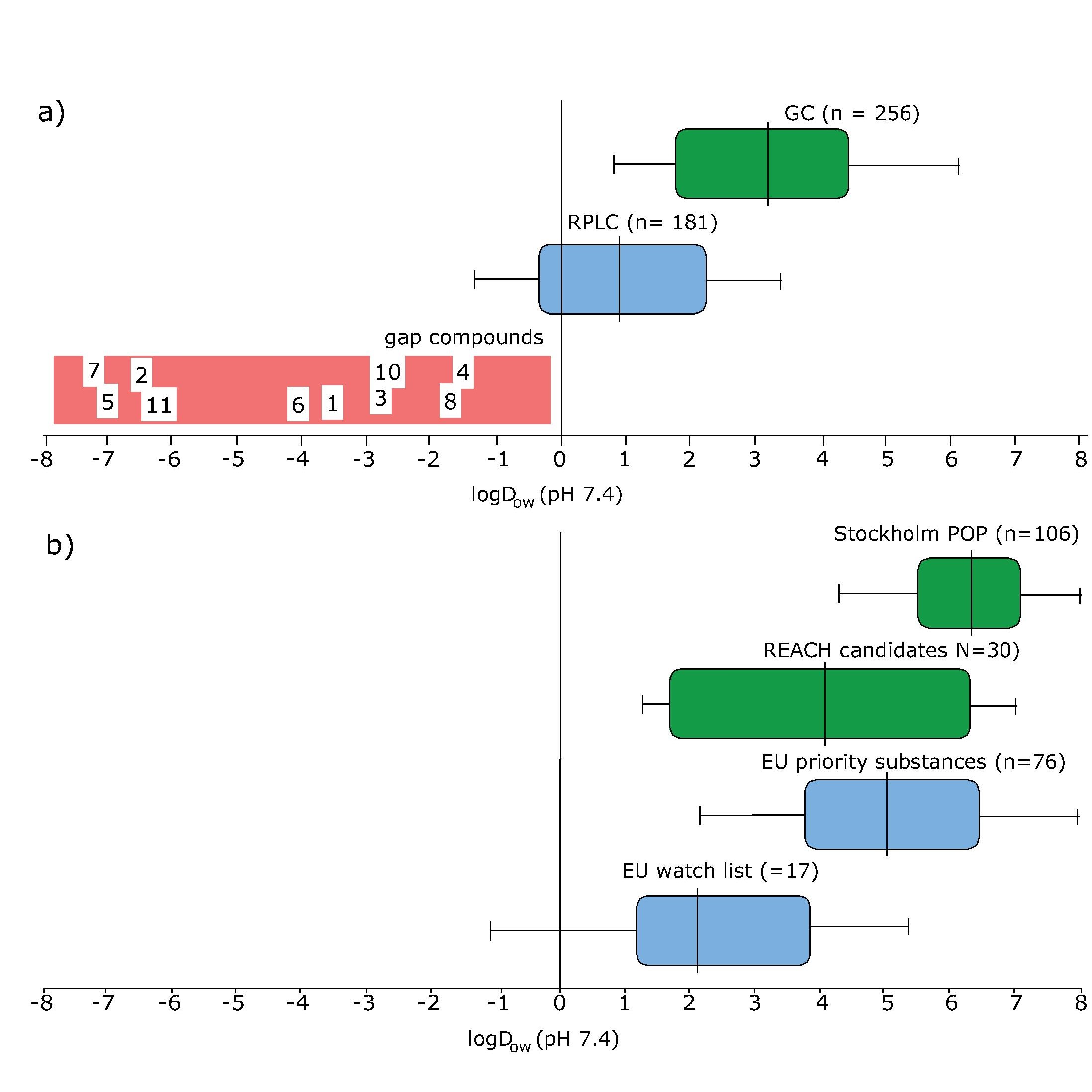
Cuando consideramos las técnicas analíticas actuales utilizadas para monitorear contaminantes en el ambiente, se puede ver fácilmente que el alcance de las técnicas más utilizadas (cromatografía de gases, GC y cromatografía líquida de fase inversa, RPLC) no se superponen con lo que se requiere para los productos químicos que tienen log D Valores de OW típicos de los químicos más móviles, teniendo un log Dow por debajo de cero (ver Figura 3a). En consecuencia, hay poca información disponible sobre la ocurrencia y el destino de estos químicos móviles en el medio ambiente. Sin embargo, se han identificado algunos ejemplos de químicos persistentes y móviles. Estos incluyen pesticidas altamente polares y sus productos de transformación, por ejemplo glifosato y ácido aminometilfosfónico (AMPA), carboxilatos y sulfonatos perfluorados de cadena corta, químicos de amonio cuaternario como diquat y paraquat y agentes complejantes como EDTA. Sin embargo, es probable que haya muchos más químicos que podrían clasificarse como PMOC y, por lo tanto, podemos concluir que existe una brecha en el conocimiento y regulación de los químicos orgánicos móviles persistentes.
Referencias
Arp, H.P.H., Brown, T.N., Berger, U., Hale, S.E. (2017). Ranking REACH registró químicos orgánicos neutros, ionizables e iónicos basados en su persistencia y movilidad acuática. Ciencia Ambiental: Impactos de Procesos 19, 939-955.
Reemtsma, T., Berger, U., Arp, H. P. H., Gallard, H., Knepper, T. P., Neumann, M., Benito Quintana, J., de Voogt, P. (2016). Cuidado con la brecha: productos químicos orgánicos persistentes y móviles - contaminantes del agua que se deslizan. Ciencia y Tecnología Ambiental 50, 10308-10315.
Sjerps, R.M.A., Vughs, D., van Leerdam, J.A., ter Laak, T.L., van Wezel, A.P. (2016). Priorización basada en datos de productos químicos para varios tipos de agua mediante detección de sospechosos LC-HRMS. Investigación del Agua 93, 254-264.
¿Cuál es la razón por la que los PMOC pueden terminar en el agua potable a pesar de la aplicación de procesos de remoción?
Explicar por qué la hidrofilicidad promedio de los compuestos presentes en el agua potable es mayor que la de las aguas superficiales o aguas residuales a partir de las cuales se ha producido.
2.2.6. Químicos orgánicos ionogénicos
Autores: Steven Droge
Crítico: John Parsons, Satoshi Endo
Objetivos de Inclinación:
Deberías ser capaz de:
- entender que las IOC están abundantemente presentes en muchos tipos de clases químicas, pero todas comparten características comunes como la disociación de un protón de un resto polar (ácidos para formar aniones) y la asociación de un protón sobre un resto polar (bases para formar cationes).
- calcular la fracción de especies neutrales/iónicas para cada producto químico a un pK a y pH dados.
- hacer algunas predicciones aproximadas sobre los valores de pK a a partir de la estructura molecular del COI.
Palabras clave: pK a, constante de disociación, especiación, fármacos, surfactantes, solubilidad
Introducción
Los químicos orgánicos ionogénicos (IOC) son ampliamente utilizados en la industria y la vida diaria, pero también abundantemente presentes como químicos de preocupación emergente. Para fines de evaluación de riesgos ambientales, las IOC pueden definirse como ácidos orgánicos, bases y químicos zwitteriónicos que bajo condiciones de pH ambientales comunes existen en gran parte como especies cargadas (iónicas), con solo una fracción modesta de especies neutras. Se podría argumentar que el rango de pH ambientalmente relevante se encuentra entre 4 (arroyos ácidos, incluso menores en arroyos contaminados de regiones volcánicas o sistemas de drenaje de minas) a 9 (efluentes de tratamiento de aguas residuales). El comportamiento ambiental de los contaminantes COI de interés es diferente de los químicos neutros de preocupación, ya que el pH acuoso controla la fracción neutra de los IOC disueltos y la forma iónica es altamente soluble e interactúa en parte a través de interacciones electrostáticas con susbtrados ambientales. Tenga en cuenta que la fracción mayor de un COI también puede ser neutra en un determinado sistema ambiental, y en ese caso suele ser la forma neutra la que domina el comportamiento del químico.
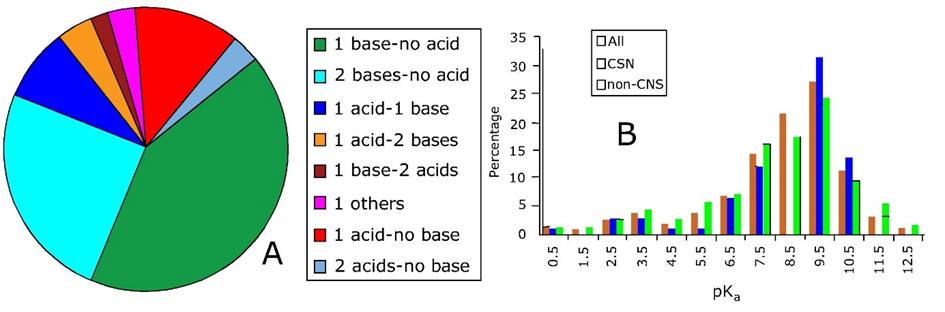
Los COI son comunes en muchos tipos diferentes de clases de contaminantes. Un análisis de subconjuntos aleatorios de todos los productos químicos industriales (pre) registrados en la UE indicó que grandes fracciones de la lista total de >100,000 químicos son IOC (51% neutros; 27% ácidos; 14% bases; 8% zwitteriones/anfóteros). En otra fuente, se ha estimado que > 60% de todos los medicamentos recetados (Sección 2.3.3) son IOC (Manallack, 2007), e incluso fracciones mayores para drogas ilícitas (Sección 2.3.4) (Figura 1). Ejemplos bien conocidos son betabloqueantes básicos (por ejemplo, propranolol), antidepresivos básicos (por ejemplo, fluoxetina y sertralina), fármacos antiinflamatorios no esteroideos ácidos (AINE como diclofenaco) y opioides básicos (por ejemplo, morfina, cocaína, heroína) y medicamentos básicos de diseño (por ejemplo, MDMA). La mayoría de los tensioactivos y productos químicos polifluorados (por ejemplo, PFOS y GenX) son IOC (Sección 2.3.8), así como una amplia variedad de pesticidas importantes (por ejemplo, glifosato zwitteriónico) (Sección 2.3.1) y toxinas (naturales) (Sección 2.1) (por ejemplo, multiiónico basado en péptidos toxinas cianobacterianas).
Comportamiento ambiental de las IOC
La liberación al ambiente es específica para cada uno de estos tipos de IOC con un uso diferente, pero en muchos casos ocurre a través de sistemas de tratamiento de aguas residuales. Si la sorción a lodos de aguas residuales es muy fuerte, la aplicación de lodos en sistemas terrestres (agrícolas) es una entrada clave en muchos países. Sin embargo, muchos IOC son bastante hidrofílicos y estarán presentes principalmente en efluentes de aguas residuales liberadas a los sistemas acuáticos. Como son hidrofílicos, se consideran bastante móviles, lo que permite un transporte rápido a través de, por ejemplo, penachos de agua subterránea, acuíferos del suelo y etapas de filtración (agua potable). La distinción entre (en su mayoría) sustancias químicas neutras e IOC es importante porque la forma molecular iónica generalmente se comporta de manera muy diferente a la correspondiente forma molecular neutra. Por ejemplo, en muchos aspectos las moléculas iónicas son no volátiles en comparación con las moléculas neutras correspondientes, mientras que las moléculas neutras son más hidrófobas que las moléculas iónicas correspondientes. Como resultado de su menor “hidrofobicidad”, las moléculas iónicas a menudo se unen con menor afinidad a los suelos y, por lo tanto, son más móviles en el ambiente. Las formas iónicas se bioacumulan en menor medida y, por lo tanto, pueden ser menos tóxicas que la forma neutra correspondiente (aunque no necesariamente). No obstante, existen diversas excepciones importantes para estas reglas. Por ejemplo, los minerales arcillosos absorben las COI catiónicas con bastante fuerza a través de mecanismos de intercambio iónico. Ciertas proteínas (por ejemplo, la albúmina de proteína de suero sanguíneo) se unen fuertemente a productos químicos aniónicos debido a subdominios catiónicos en bolsas específicas (enzimáticas), lo que permite un transporte efectivo a través de nuestros sistemas y sobre las membranas
Calcular y predecir la constante de disociación (pK
El parámetro químico crítico que describe la capacidad de ionizar es la constante de disociación ácida (pK a). El pK a define a qué pH 50% del COI está en forma neutra o iónica liberando un H + de los ácidos de la molécula neutra (AH al anión A -), o aceptando un H + sobre la base de la molécula neutra (B al catión BH +). El equilibrio entre ácido neutro y forma disociada puede definirse así como:
[HA] ↔ [H +] + [A -] (eq.1)
donde la especiación de equilibrio del químico se define como:
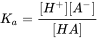 (eq.2)
(eq.2)
que da el pK a como:

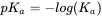 (eq.3)
(eq.3)
y en función del pH, la relación entre el ácido y el anión se define como:
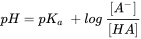 para ácidos y
para ácidos y 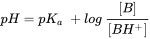 bases (eq.4)
bases (eq.4)
Aunque el término pK b también se usa para denotar la constante de asociación de bases, es convencional consideramos [BH +] como ácido y usamos 'pK a 'y otras relaciones para bases también. La fracción de especies neutras (f N) para IOC simples (un sitio ácido o básico) se puede calcular fácilmente con una derivatización de la ecuación de Henderson-Hasselbalch:
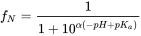 (eq.5)
(eq.5)
en el que α = 1 para las bases y -1 para los ácidos.
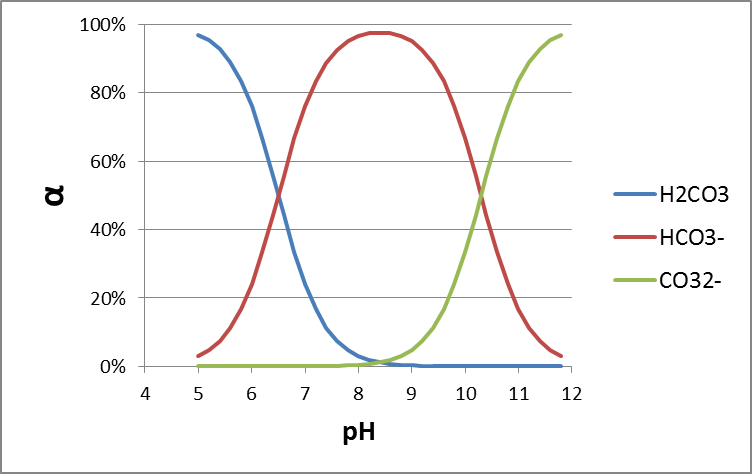
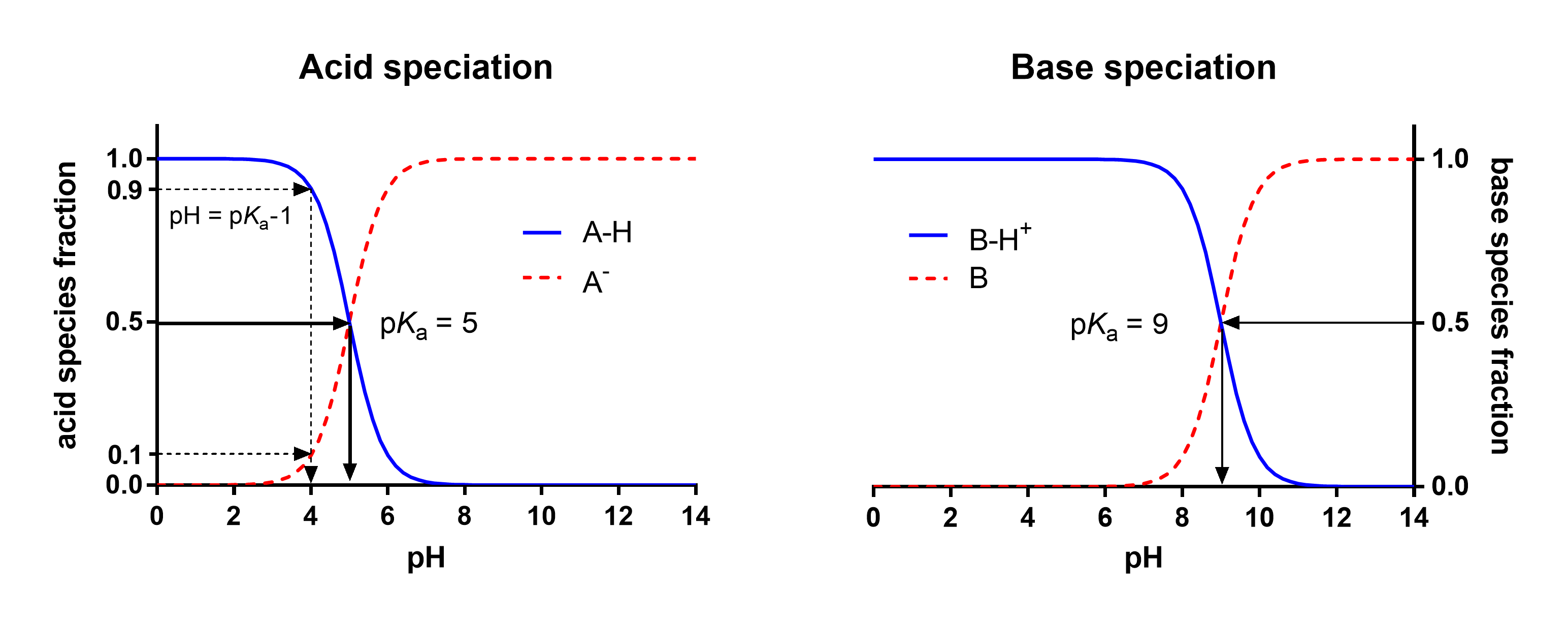
en el que α = 1 para las bases y -1 para los ácidos. Usando la ecuación 5, la Figura 2 presenta un perfil de especiación típico para un ácido (mostrado con pKa 5, entonces quizás un ácido carboxílico) y una base (mostrada con pKa 9, entonces quizás un fármaco betabloqueante). Siguiendo la curva de la ecuación 5, es interesante ver algunas reglas simples: si el pH es 1 unidad menor que el pKa, la fracción de especies desprotonadas está presente en 10%. Si el pH es 2 unidades menor que el pKa, la fracción de especies desminadas está presente en 1%, 3 unidades más bajas darían 0.1%, etc. a partir de esto, es fácil hacer una buena estimación para la protonación de un fármaco básico fuerte como MDMA (pKa reportado 9.9-10.4) en sangre (pH 7.4): con un máximo de 3 unidades de pH menor, hasta 99. El 9% de la MDMA estará en la forma protonada, y sólo 0.1% neutral. Para los estudios de modelado toxicológico, por ejemplo, en términos de permeación a través de la membrana de barrera hematoencefálica, esto es altamente relevante.
|
Cajas 1-3. Aprendizaje extendido: calcular la constante de disociación para químicos multipróticos: ver final de este módulo |
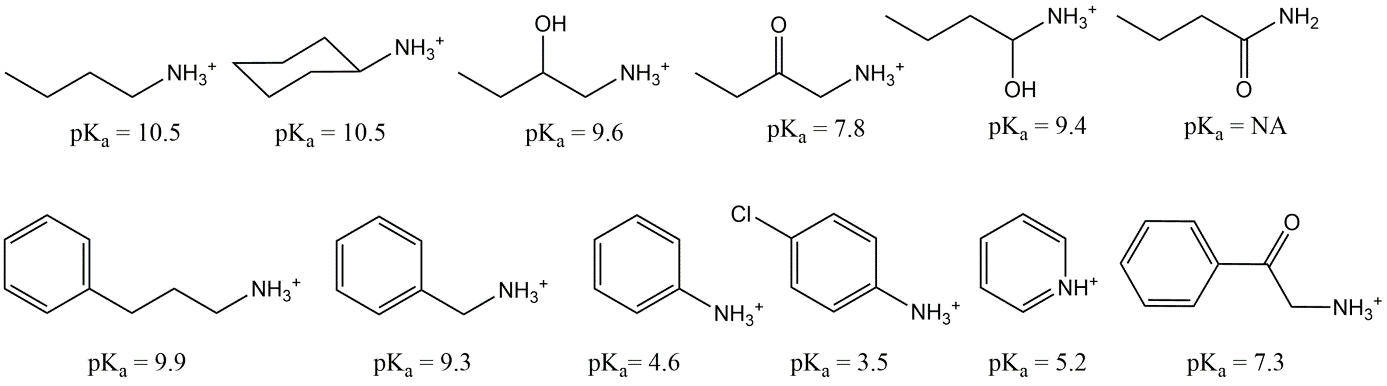
IOC ácidos:
Por ejemplo, el analgésico (o fármaco antiinflamatorio no esteroideo, o AINE) diclofenaco es un ácido carboxílico con un pK a de 4.1. Esto significa que a pH 4.1, el 50% del diclofenaco disuelto se encuentra en la forma disociada (aniónica) (así, (1 - f N) de la ecuación 5). A pH 5.1 (1 unidad mayor que el pK a) esto es aproximadamente 90% (90.91% para ser más precisos, pero simplemente recordar 90% ayuda), a pH 6.1 (2 unidades más alto que el pK a) esto es 99%. Este incremento escalonado de 50 -90-99% con cada unidad de pH funciona para todos los ácidos, y para las bases al revés. Prueba por ti mismo que a pH fisiológico de 7.4 (por ejemplo en sangre) se calcula que el diclofenaco es 99.95% aniónico.
Muchos ácidos carboxílicos tienen un pK a en el rango de 4-5, pero los grupos moleculares vecinos pueden afectar al pK a. Los átomos particularmente electronegativos tales como cloro, flúor u oxígeno pueden disminuir el pK a, ya que reducen las fuerzas que mantienen el protón disociante al átomo de oxígeno. Por ejemplo, el ácido tricloroacético (CCl 3 -COOH) tiene un pK a de 0.77, mientras que el ácido acético (CH 3 -COOH) tiene un pK a de 4.75. Por la misma razón, los ácidos carboxílicos perfluorados tienen un pK a ácido fuertemente reducido en comparación con los ácidos carboxílicos no perfluorados análogos.
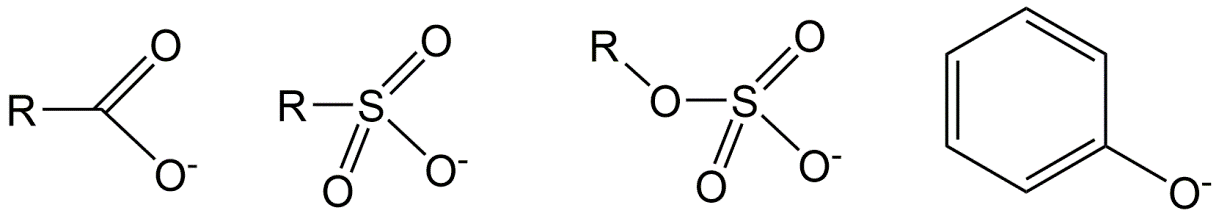
Los ácidos sulfato (ver figura 3) son ácidos muy fuertes, con un pK a <0. Estos ácidos casi siempre ocurren en su forma pura como una sal, por ejemplo el ingrediente jabonoso común dodecilsulfato de sodio (“SDS” o “SLS”, Na.C 12 H 25 -SO 4). Otros detergentes comunes son los sulfonatos, como el alquilbencenosulfonato lineal (“LAS”, C 10-14 - (bencil-SO 3)), donde el resto aniónico SO 3 está unido a un anillo de benceno, el cual puede posicionarse a diferentes átomos de carbono de una cadena alquílica larga. Incluso en el rango de pH ambiental más bajo de aproximadamente 4, estos productos químicos jabonosos están completamente en forma aniónica. Tales ácidos muy fuertes, pero también muchos ácidos más débiles, a menudo se venden en forma pura como sales con sodio, potasio o amonio, lo que hace que tengan diferentes nombres y números CAS (por ejemplo, Na.C 12 H 25 -SO 4 o K.C 12 H 25 -SO 4) que la forma neutra.
Muchos fenoles tienen un pK a > 8, y por lo tanto son en su mayoría neutros bajo pH ambiental. Los grupos aceptores de electrones en el anillo aromático del grupo fenol, como Cl, Br e I, pueden disminuir la constante de disociación. Por ejemplo, el pesticida a base de dinitrofenol dinoseb tiene un pK a de 4.6, y por lo tanto es mayoritariamente aniónico en el ambiente acuático. Tenga en cuenta que un grupo hidroxilo (-OH) no conectado a un anillo aromático, como -OH de alcoholes, puede en la mayoría de los casos para la evaluación del riesgo ser considerado permanentemente neutro.
Para ayudar a interpretar las diferencias en pK a entre moléculas, a veces ayuda recordar que en soluciones más ácidas, simplemente hay concentraciones mayores de H +, de manera logarítmica en la escala de pH. A pH 3, la concentración de protones H + en solución es de 1 mM, mientras que a pH 9 la concentración de H + es de 1 nM (6 unidades de pH equivale a 10 concentraciones 6 veces menores). La afinidad (“K a “) de H + para asociarse con un grupo molecular cargado negativamente, es tan baja para los ácidos fuertes que incluso a concentraciones muy altas de H + disuelto (pH bajo) solo se forman muy pocos enlaces AH (fracción ácida neutra). Es decir, para los químicos con un K a bajo, incluso a pH bajo la fracción neutra sigue siendo baja. Para ácidos débiles como los fenoles, ya a concentraciones muy bajas de H + disuelto (pH alto) se forman muchos enlaces AH (fracción ácida neutra). Entonces se puede razonar que la afinidad de los grupos ácidos comunes para aferrarse a un protón está en el orden:
SO 4 < SO 3 < CO 2 < amida (C (=O) NH) < fenol < hidroxilo
IOC básicos:
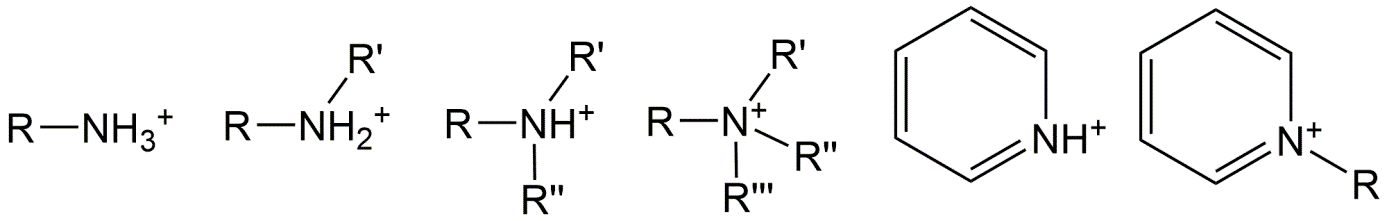
Para las bases, es mayormente un átomo de nitrógeno que puede aceptar un protón para formar un catión orgánico, debido al par de electrones solitario en nitrógeno. Los átomos de nitrógeno neutro tienen oportunidades para 3 enlaces. Un grupo amina primaria tiene el átomo de nitrógeno que se une a solo 1 átomo de carbono (representado aquí como parte de un fragmento molecular R), y dos enlaces adicionales con átomos de hidrógeno. El par de electrones restante acepta fácilmente otro protón para formar una molécula catiónica [R-NH 3 +]. Las aminas secundarias neutras tienen un enlace a hidrógeno y dos enlaces a átomos de carbono y pueden aceptar un protón para formar [R-NH 2 + -R'], mientras que las aminas terciarias neutras no tienen enlaces a hidrógeno sino solo a átomos de carbono y pueden formar [R-NH + - (R') (R”)]. Por supuesto, cada grupo R puede ser el mismo (por ejemplo, una unidad de metilo).
Muchos productos químicos básicos tienen funcionalidades complejas que pueden influir en el pK a del resto nitrógeno. Sin embargo, como se muestra en los ejemplos de la figura 5, siempre que haya al menos dos átomos de carbono entre la amina y el fragmento molecular polar (por ejemplo OH, pero mucho más fuerte para =O), el pK a de los grupos nitrogenados básicos en los tres tipos de bases (aminas primarias, secundarias y terciarias) es alto, a menudo por encima de 9 (concentración disuelta de H + <10 -9). Entonces, incluso a concentraciones muy bajas de H +, a los protones disueltos les gusta asociarse a tales grupos amina. Como resultado, las aminas como la mayoría de los betabloqueantes y los fármacos a base de anfetaminas son predominantemente moléculas cargadas positivamente (aminas catiónicas orgánicas) en el rango de pH ambiental común de 4-9, así como en el pH de la mayoría de los tejidos bióticos que son útiles para evaluaciones toxicológicas. Tan pronto como un grupo polar con oxígeno (por ejemplo, cetonas o grupos hidroxilo) se conecta al segundo carbono lejos del nitrógeno (por ejemplo, R-CH (OH) -CH 2-NH 2) el pK a disminuye considerablemente. También los átomos de nitrógeno como parte de un anillo aromático, o conectados a un anillo aromático, tienen pK a mucho más bajos: los protones tienen una afinidad bastante baja para unirse a estos N-átomos y solo comienzan a hacerlo si la concentración de protones se vuelve relativamente alta (la solución se vuelve más ácida).
Relevancia de la contabilización de las interacciones
La mayoría de los contaminantes clásicos, como el DDT, los PCB y las dioxinas, son químicos hidrófobos neutros. Por otro lado, la mayoría de los metales son casi siempre especies catiónicas (e.g. Cd 2+). En consecuencia, su distribución ambiental y exposición biológica están influenciadas por procesos bastante distintos. Obviamente, los IOC predominantemente cargados se comportan algo entre estos dos extremos. Los grupos cargados positivos o negativos provocan un fuerte efecto de interacciones electrostáticas entre el COI y sustratos ambientales (sorción o unión ligando/receptor). Mientras que también los metales se especian en diferentes formas, la diferencia de pH entre los compartimentos ambientales puede influir fuertemente en el destino químico de los IOC y el efecto si el grupo ionizable es relativamente débil. Una diferencia importante con los metales es que la parte molecular no iónica aún influye en la hidrofobicidad del COI incluso en estado cargado para varios procesos.
Como se discutirá en otros capítulos relativos a los procesos químicos (ver Capítulo 3), es necesario tener en cuenta para las IOC que muchos sustratos ambientales (DOC, materia orgánica del suelo, minerales arcillosos) están en su mayoría cargados negativamente en el rango común de pH ambiental, pero también que las proteínas involucrados en los efectos de distribución de absorción biótica son ricos en péptidos ionogénicos que forman parte de bolsas de unión y centros reactivos.
Referencias
Manallack, D.T. (2007). La distribución de pKa de fármacos: aplicación al descubrimiento de fármacos. Perspectivas en Química Médica 1, 25-38.
|
Caja 1. Aprendizaje extendido: calcular la constante de disociación para químicos multipróticos: Varios ácidos inorgánicos comunes son multipróticos: tienen múltiples protones que pueden disociarse. Múltiples especies pueden ocurrir a un cierto pH, como para el ácido fosfórico (H 3 PO 4, H 2 PO 4 -, HPO 4 2-, HPO 4 2-) y ácido carbónico (H 2 CO 3, HCO 3, HCO 3 -, CO 3 2-). Es importante darse cuenta de que en realidad hay dos microespecies de HCO 3 -, porque dos grupos hidroxilo pueden disociarse: HO-C (=O) -OH Un ácido poliprotc H n A puede sufrir n disociaciones para formar n +1 especies. Cada disociación tiene un pK a. Pero, ¿cómo calcular la fracción de cada especie de químicos multipróticos? La carga de un ácido poliprótico puede describirse como H n-j A j-. Se puede definir una variable útil, v, para cada ácido poliprótico general:
para cada reacción de disociación: H n-j+1 A -j+1 ↔ H + + H n-j A j- la constante de disociación Kj es:
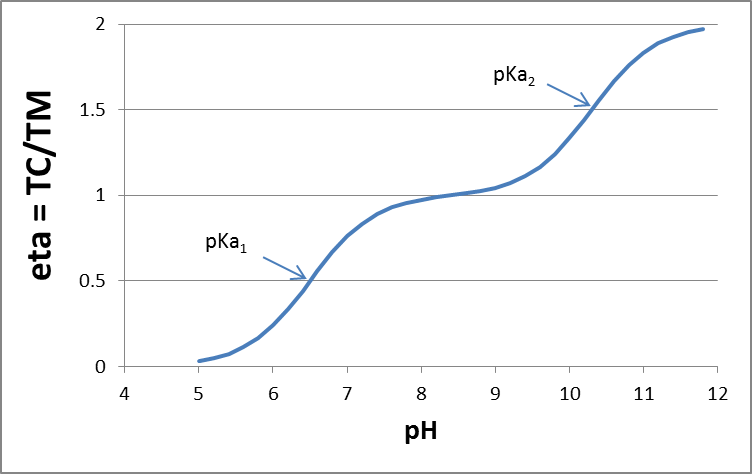
El grado de disociación del ácido (η) es igual a la relación entre la carga total (TC) y el ácido molar total (TM). Para un ácido diprótico, una gráfica de η en función del pH proporciona la curva de disociación:
que puede ser una curva ajustada a los datos experimentales. El grado de protólisis para la j ésima especie, α j, puede calcularse a partir de la relación de [H n-j A j-] /TM 
Puede configurar dicho cálculo en MS Excel, con cálculos de α 0, α 1, α 2, en un rango de diferentes valores de pH (concentraciones [H +]), para un determinado K 1 y K 2, y graficar la especiación contra pH. Más detalles son descritos por King et al. (1990) J. Chem. Educ. 67 (11), p. 932; DOI: 10.1021/ed067p932 |
|
Recuadro 2. Ejemplo 1 para productos químicos multipróticos: ácido carbónico Probemos primero el ácido carbónico (bicarbonato, o H 2 CO 3) como ejemplo. H 2 CO 3 es el producto del dióxido de carbono disuelto en agua. En agua pura/agua de mar la constante de equilibrio de hidratación K h = [H 2 CO 3]/[CO 2] ≈ 1.7×10 −3/≈ 1.2×10 −3 respectivamente, indicando que solo 0.1% del CO 2 disuelto se equilibra a H 2 CO 3. La concentración disuelta de CO 2 depende de los niveles atmosféricos de CO 2 según el coeficiente de distribución aire-agua (Constante de Henry k H = pCo 2/[CO 2] = 29.76 atm/ (mol/L)). Debido a la relevancia del CO 2 en, por ejemplo, la acidificación oceánica y el intercambio de gases en nuestros pulmones, es interesante ver cómo el H 2 CO 3 se especia dependiendo del pH. Al igual que en la fórmula H n A, n= 2 para H 2 CO 3.
Con pK 1 * =6.5 (en equilibrio con CO 2 atmosférico) y pK 2 =10.33, K 1 =10-6.5 y K 2 =10-10.3. A pH 7, [H +] =10 -7, así a pH 7 con estas constantes de disociación
o de una serie de cálculos Excel a pH diferente:
puede copiar/pegar las siguientes celdas en la celda A1 de una nueva hoja de Excel y ampliar el rango de pH:
|
|
Caja 3. Ejemplo 2 para productos químicos multipróticos: Zwitteriones Muchos tampones de pH orgánicos son químicos zwitteriónicos, que contienen tanto un grupo ácido como uno básico. Norman Good y sus colegas describieron un conjunto de 20 de tales tampones para la investigación bioquímica y biológica (ver por ejemplo www.interchim.fr/ft/0/062000.pdf, o www.applichem.com/fileadmin/broschueren/biobuffer.pdf). Ejemplos son MES, MOPS, HEPPS (Figura A). Estos búferes se seleccionan para:
los químicos zwitteriónicos con grupos sulfato son en realidad siempre tienen el grupo sulfato cargado, haciéndolo altamente soluble e impermeable a las membranas celulares, mientras que el grupo amina protonata entre pH6-10, dependiendo de los grupos funcionales vecinos. La especiación de los grupos amina en MES y MOPS simplemente sigue el cálculo de pKa único de las ecuaciones 1-5. En HEPPS, cualquiera de las dos aminas está protonada, la segunda pKa es 3, por lo que las moléculas doblemente cargadas solo ocurren a pH mucho más bajo, pero aún pueden usarse como tampón. 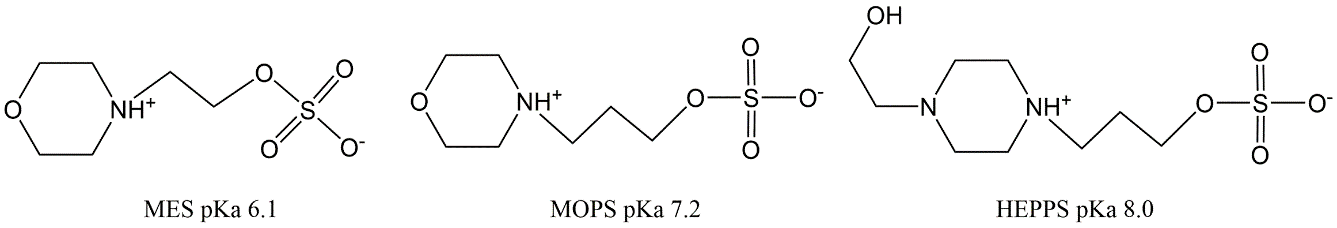 Un químico zwitteriónico con dos valores aparentes de pKa relativamente cercanos es el ácido p-amino-benzoico. Si los químicos no tienen un grupo ionizable, sino N grupos ionizables esa especiación en un rango de pH relevante, entonces la cantidad de especies posibles es de 2 N. Por lo que el zwitterión p-aminoácido ácido benzoico tiene 4 especies, cada una con un pKa separado (pH donde ambas especies están presentes en concentraciones iguales).
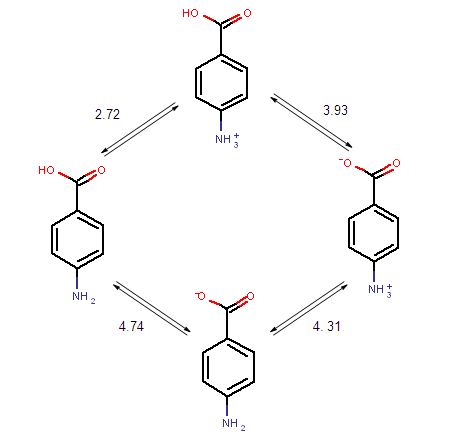
Formulemos el grupo bencilo en ácido p-amino benzoico como X, la base amina neutra como B y el ácido carboxílico neutro como AH, para que la especie completamente neutra sea BXAH. Comparado con el ácido carboxílico, ahora tenemos bajo las condiciones más ácidas (BHXAH) +, como Sin embargo, esto no nos informa sobre la relación entre la forma zwitteriónica y la forma completamente neutra. Para ello se requieren las constantes de especiación de las 4 microespecies. [BH+XAH] ↔ [BXAH] + [H+] para el cual se calcula que el pk1 es 2.72 K 1 =10^-2,72 = [BXAH] * [H+]/[BH+XAH] [BH+XAH] *10^-2.72 = [BXAH] * [H+] que se reorganiza a [BXAH] = 10^-2.72 * [BH+XAH]/[H+] [BH+XAH] ↔ [BH+XA-] + [H+] para el que se calcula que el pk2 es 3.93 K 2 =10^-3.93 = [BH+XA-] * [H+]/[BH+XAH] [BH+XAH] *10^-3.93 = [BH+XA-] * [H+] que se reorganiza a [BH+XA-] =10^-3.93* [BH+XAH]/[H+] [BXAH] ↔ [BXA-] + [H+] para el cual se calcula que el pk3 es 4.74 K 3 = 10^-4,74 = ([BXA-] * [H+])/[BXAH] [BXAH] *10^-4,74 = [BXA-] * [H+]) [BH+XA-] ↔ [BXA-] + [H+] para el cual se calcula que el pk4 es 4.31 K 4 =10^-4,31 = [BXA-] * [H+]/[BH+XA-] [BH+XA-] *10^-4,31 = [BXA-] * [H+] Entonces la relación entre la forma zwitteriónica [BH+XA-] y la forma neutra [BXAH] es igual a: [BH+XA-]/[BXAH] = 10^-Pk2/10^-Pk1 [BH+XA-]/[BXAH] = 10^-3.93/10^-2.72 = 0.06: así que solo 6% zwitteriónico vs 94% especies neutras. La macro pK1 y pK2 se calculan entonces como: K1 = ([BXAH] * [H+] + [BH+XA-] * [H+])/[BH+AXH] K1 = [BXAH] * [H+]/[BH+XAH] + [BH+XA-] * [H+]/[BH+XAH] K1 = 10^-PK1 + 10^- pK2 K1 = 10^-2.72 + 10^-3.93 =10^-2.69 K1=10^-2.69 K2 = ([BXA-]) * [H+]/([BH+XA-] + [BXAH]) 1/K2 = [BH+XA-]/([BXA-]) * [H+] + [BXAH]/([BXA-]) * [H+] 1/K2 = 1/10^-PK3 + 1/10^-Pk4 1/K2 = 1/10^-4,31 + 1/10^-4,74 = 1/10^-4.87 K2 =10^-4.87 |
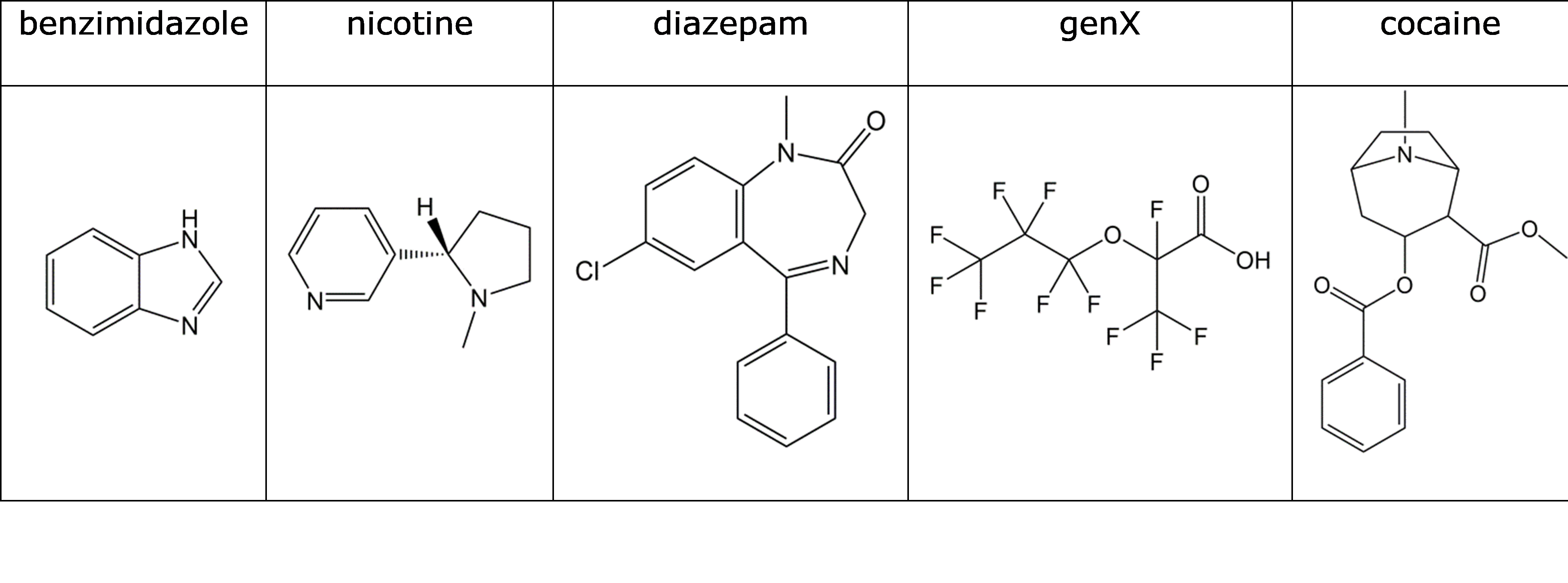
Calcular la fracción neutra a pH 7.4 para la droga ilícita GHB (aplicar la ecuación HH de eq 5):
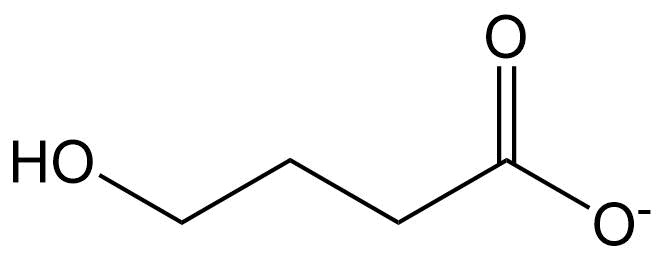
Conecte los productos químicos a sus valores apropiados de pK a:
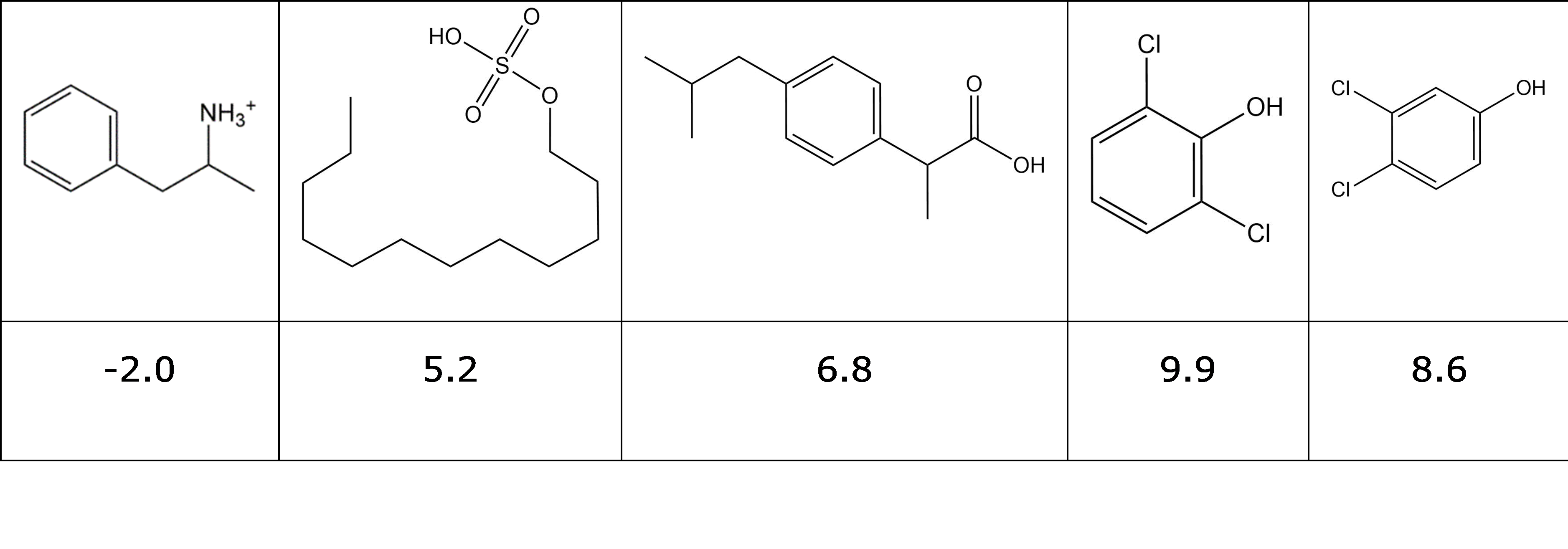
Decidir/buscar si estos productos químicos son predominantemente neutrales/aniónicos/catiónicos en el medio ambiente:
2.2.7. Mixturas Complexas/UVCBS
En preparación
2.2.8. Plásticos
(borrador)
Autor: Ansje Löhr
Crítico: John Parsons
Objetivos de Inclinación:
Deberías ser capaz de:
- indican la relevancia del plástico para la sociedad
- describir las principales características de los (micro) plásticos
- describir los principales efectos ecológicos de los (micro) plásticos
Palabras clave: Tipos de plásticos, fuentes de plásticos, microplásticos primarios y secundarios, degradación plástica, efectos de plásticos
Introducción
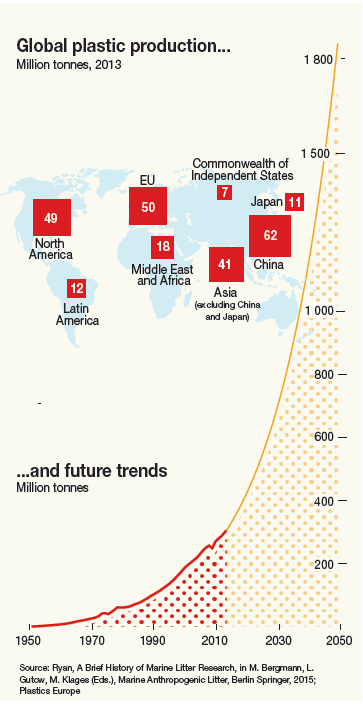
Desde su introducción en la década de 1950, la cantidad de plásticos en el medio ambiente ha aumentado drásticamente (Figura 1). Un estudio reciente de Jambeck et al. (2015) estimó que 192 países costeros generaron 275 millones de toneladas métricas de desechos plásticos en 2010 de los cuales alrededor de 8 millones de toneladas de desechos plásticos terrestres terminan en el océano cada año. Por ONU Medio Ambiente la contaminación plástica es vista como una de las mayores amenazas ambientales. Si la gestión de residuos no cambia rápidamente, para 2050 se habrán acumulado otros 33 mil millones de toneladas de plástico alrededor del planeta. Los (micro) plásticos son ampliamente reconocidos como un problema grave en el océano, sin embargo, la contaminación plástica también se ve en los sistemas terrestres y de agua dulce.
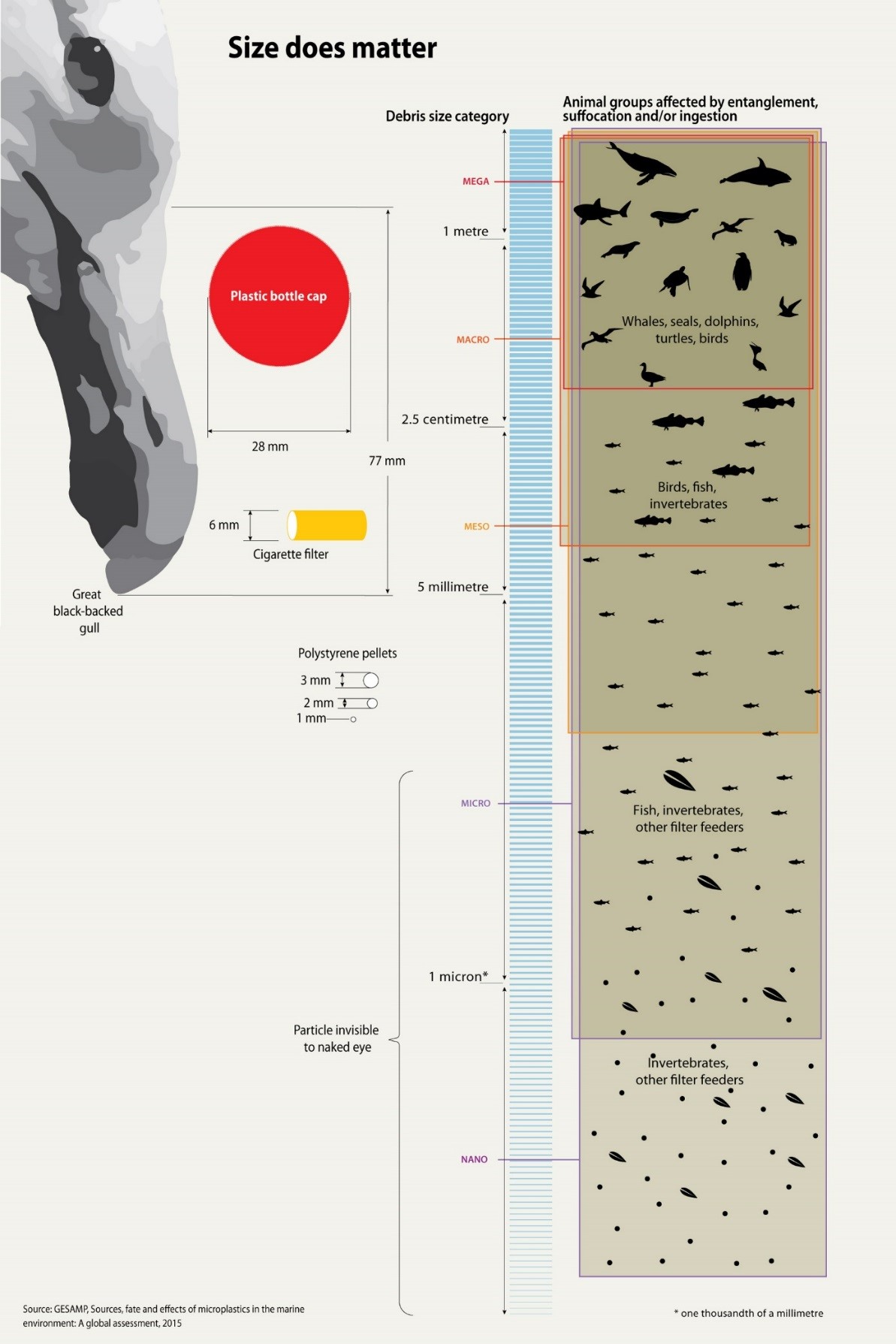
Clasificación por tamaño y morfología
Los plásticos se dividen comúnmente en macroplásticos y microplásticos; estas últimas partículas de plástico tienen <5 mm de diámetro (incluidos los nanoplásticos). Existen varias formas de clasificar los microplásticos, pero a menudo se utilizan los siguientes dos tipos: microplásticos primarios y microplásticos secundarios. Los microplásticos primarios se han hecho intencionalmente, como pellets o microperlas, los microplásticos secundarios son partes fragmentadas de objetos más grandes. Los microplásticos muestran una gran variedad en características como tamaño, composición, peso, forma y color. Estas características influyen en el comportamiento en el ambiente, como por ejemplo, la dispersión en agua y la captación por los organismos (Figura 2). Las partículas de baja densidad flotan en el agua y por lo tanto son más propensas a la advección que las partículas con un
mayor densidad. De igual manera, las esferas son más propensas a ser absorbidas por organismos que por fibras. Las características también afectan la absorción de contaminantes, adsorción de microbios y toxicidad potencial.
Clasificación por química
Plástico es el término utilizado para definir una subcategoría de la clase más grande de materiales llamados polímeros, generalmente sintetizados a partir de combustibles fósiles, aunque la biomasa y los desechos plásticos también pueden ser utilizados como materia prima. Los polímeros son moléculas muy grandes que tienen una arquitectura molecular característica de cadena larga. Existen muchos tipos diferentes de plásticos pero el mercado está dominado por 6 clases de polímeros: polietileno (PE, alta y baja densidad), polipropileno (PP), cloruro de polivinilo (PVC), poliestireno (PS, incluyendo EPS expandido), poliuretano (PUR) y tereftalato de polietileno (PET) (figura 3). Para hacer materiales flexibles, transparentes, duraderos, menos inflamables y de larga duración, se utilizan aditivos para polímeros como retardantes de llama (por ejemplo, éteres de difenilo polibromados) y plastificantes (por ejemplo, ftalatos). Algunas de estas sustancias son conocidas por ser tóxicas para los organismos marinos y para los humanos.

Biopolímeros/bioplásticos
Hay mucha discusión sobre los bioplásticos como plásticos degradables que estos aún pueden persistir durante mucho tiempo bajo condiciones marinas. Por favor vea este video del dr. Peter Kershaw.
Degradación plástica
La degradación de los plásticos se produce tan pronto como el plástico pierde su integridad y propiedades originales. Hay una fase de ruptura más rápida (degradación en micropartículas) y una fase de mineralización mucho más lenta (las cadenas de polímeros se degradan a dióxido de carbono). La tasa de degradación de los plásticos está determinada por su tipo de polímero, composición aditiva y factores ambientales. Muchos polímeros de uso común son extremadamente resistentes a la biodegradación. Aunque los plásticos se degradan en ambientes naturales, se argumenta que ningún polímero puede ser biodegradado de manera eficiente en un vertedero. Los plásticos en ambientes acuáticos pueden estar sujetos a degradación in situ, por ejemplo, por fotodegradación o fragmentación mecánica, pero en general son muy duraderos. En consecuencia, los plásticos que están presentes en nuestros océanos se degradarán a un ritmo muy lento, (Figura 4). Por lo que la mayoría de los plásticos producidos hoy en día persistirán en el medio ambiente durante décadas y probablemente durante siglos, si no milenios.

Plásticos en el medio ambiente
- Fuentes y vías:
Los plásticos se encuentran en ambientes terrestres, de agua dulce, estuarinos, costeros y marinos, e incluso en zonas muy remotas del mundo y de las profundidades marinas. Las fuentes y vías de los desechos marinos son diversas y no se conocen completamente las cantidades y rutas exactas. Pero hay un aumento en el interés por determinar las cantidades y tipos exactos de basura plástica y vías en el medio ambiente y la mayor parte del plástico en nuestros océanos proviene de fuentes terrestres (Figura 5) pero también de fuentes marinas. La mayoría de PE y PP se utilizan en productos de empaque (de un solo uso) que tienen una vida útil corta y terminan pronto como desechos.
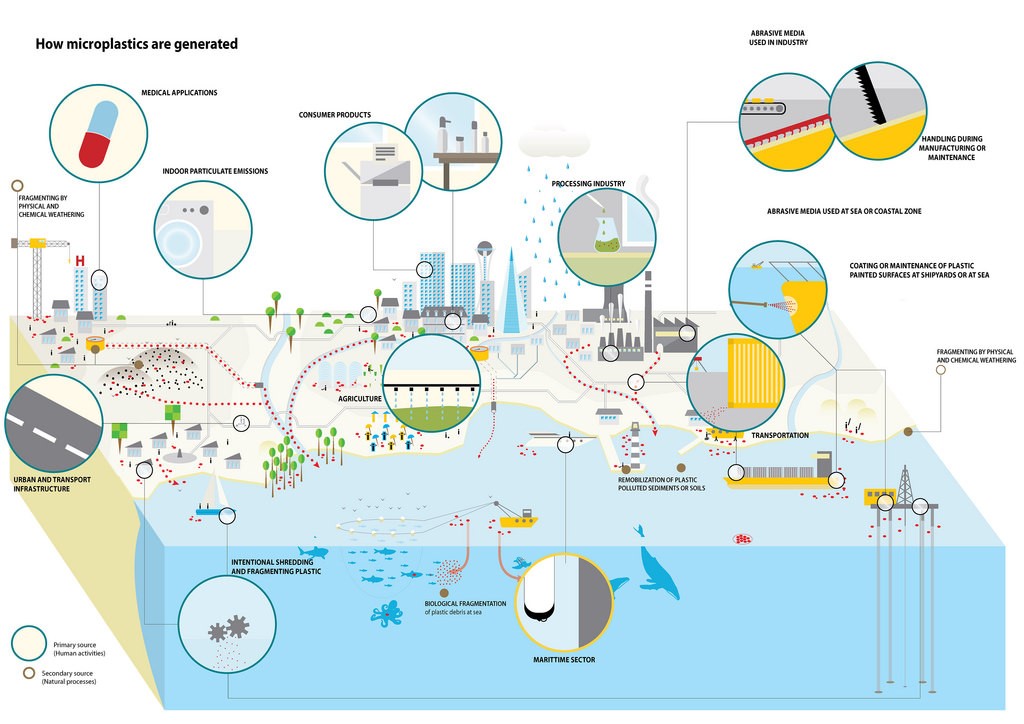
Los microplásticos primarios en ambientes terrestres provienen principalmente del uso de lodos de aguas residuales que contienen microplásticos de cuidado personal o productos domésticos. En suelos agrícolas, la aplicación de lodos de aguas residuales de las plantas de tratamiento de aguas residuales municipales a tierras agrícolas es probablemente un insumo importante, con base en estimaciones recientes de emisiones de MP en países industrializados. La contaminación plástica en los sistemas terrestres también está vinculada al uso de plásticos agrícolas, como los politúneles y los mantillo plásticos. Los microplásticos secundarios provienen de fuentes variables y diversas, por ejemplo, de residuos mal gestionados, ya sea accidental o intencionalmente.
- Efectos:
A medida que los plásticos se han generalizado y ubicuo en el medio ambiente, están presentes en una diversidad de hábitats y pueden impactar organismos en diferentes niveles de organización biológica, posiblemente conduciendo a efectos de población, comunidad y ecosistema. El enredo es uno de los impactos físicos más evidentes y dramáticos de los macroplásticos, ya que a menudo conduce a lesiones agudas y crónicas o la muerte. En particular, los taxones superiores (mamíferos, reptiles, aves y peces) se ven afectados, y puede ser crítico para el éxito de varias especies en peligro de extinción. Debido a características de tamaño similares a los alimentos, los plásticos son ingeridos tanto intencionalmente como involuntariamente por una amplia gama de especies, como invertebrados, peces, aves y mamíferos. La ingestión de los plásticos no nutricionales puede causar daños y/u obstrucción del tracto digestivo y puede conducir a una disminución del forraje debido a falsas sensaciones de saciedad, lo que resulta en una reducción de las reservas de energía.
Los microplásticos y en particular las nanopartículas que son lo suficientemente pequeñas como para ser absorbidas y translocadas a tejidos, células y fluidos corporales pueden causar toxicidad celular y cambios patológicos debido a la toxicidad de las partículas. Además, también hay riesgos químicos involucrados ya que los plásticos pueden ser una fuente de productos químicos peligrosos. Estos químicos pueden ser parte del propio plástico (es decir, monómeros y aditivos) y/o químicos que son absorbidos del ambiente hacia la matriz o como plomo, cadmio, mercurio, contaminantes orgánicos persistentes (COP) como PAHs, PCB y dioxinas. Sin embargo, como este proceso depende de los gradientes de fugacidad, existe mucha incertidumbre sobre la medida en que la transferencia de contaminantes ocurre en el ambiente. En realidad, al tomar en cuenta todas las vías de exposición, la transferencia de (micro) plásticos parece ser una vía menor.
Mira el video sobre la investigación de Inneke Hantoro.
Finalmente, los plásticos marinos pueden actuar como hábitats flotantes para especies invasoras, incluyendo floraciones de algas dañinas y patógenos, lo que lleva a extenderse más allá de su rango de dispersión natural y crear el riesgo de alterar los ecosistemas de hábitats sensibles.
2.2.9. Nanomateriales
Autor: Martina Vijver
Críticos: Kees van Gestel, Frank van Belleghem, Melanie Kah
Objetivos de Inclinación:
Deberías ser capaz de:
- explicar las diferencias entre nanomateriales y químicos solubles.
- describir características nano-específicas y explicar la diferencia entre nanomateriales y partículas de mayor tamaño, así como en qué se diferencian de las moléculas.
Palabras clave: Nanomateriales, tecnologías emergentes, coloides, nanoescala, reactividad superficial
Introducción
La ingeniería a nanoescala (es decir, 10-9 m) trae la promesa de un desarrollo tecnológico radical. Debido a sus propiedades únicas, los nanomateriales de ingeniería (ENM) han ganado interés de la industria y han entrado en el mercado global. Los potenciales atribuidos a la nanotecnología se encuentran entre todos: materiales más fuertes, portadores de energía más eficientes, materiales más limpios y compactos que permiten productos pequeños pero complejos. Actualmente, los nanomateriales se utilizan en numerosos productos, aunque faltan números exactos. En 2014, se estimó que el mercado contenía más de 13,000 productos a base de nano (Garner y Keller, 2014). Existe una amplia variedad de productos que contienen nanomateriales, que van desde protectores solares y pintura, hasta textiles, medicamentos, electrónica que cubren muchos sectores (Figura 1).
Nanomateriales:
La Comisión Europea adoptó en 2011 una nueva definición de 'nanomaterial' que dice “un material natural, incidental o manufacturado que contenga partículas, en estado no unido o como aglomerado o como agregado y donde, para el 50% o más de las partículas en el tamaño numérico distribución, una o más dimensiones externas está en el rango de tamaño 1 nm-100 nm'.
Los nanomateriales ocurren naturalmente, piense en minúsculo polvo fino pequeño, coloides en la columna de agua, cenizas volcánicas, negro de humo y coloides conocidos como rocío oceánico. En las pinturas se utilizan las características de los coloides para obtener los colores de pigmento. A partir del año 2000, se observó un crecimiento exponencial en su síntesis debido a las tecnologías avanzadas y técnicas de imagen necesarias para trabajar a nanoescala. Las nanotecnologías de primera generación (antes de 2005) generalmente se refieren a la nanotecnología ya en el mercado, ya sea como nanomateriales individuales, o como nanopartículas incorporadas a otros materiales, como películas o compuestos. La ingeniería de superficies ha abierto las puertas al desarrollo de ENM de segunda y tercera generación. Las nanotecnologías de segunda generación (2005-2010) se caracterizan por elementos a nanoescala que sirven como estructura funcional, como la electrónica con nanocables individuales. A partir de 2010 ha habido más investigación y desarrollo de nanotecnologías de tercera generación, las cuales se caracterizan por su arquitectura multi-escala (es decir, involucrando macro, meso, micro y nano-escalas juntas) y tridimensionalidad, para aplicaciones como biosensores o administración de fármacos tecnologías modeladas en plantillas biológicas. Las técnicas de autoensamblaje de abajo hacia arriba han sido ampliamente desarrolladas a escala industrial, para crear, manipular e integrar nanofases en nanomateriales más complejos con características tecnológicas nuevas o mejoradas. Después de 2015, se anticipa que la cuarta generación de ENM utilizará la 'fabricación molecular': logrando multifuncionalidad y control de la función a nivel molecular. Hoy en día, prácticamente cualquier material se puede hacer en la nanoescala.
El tamaño sí importa
Los materiales a nanoescala tienen áreas de superficie mucho más grandes que los objetos más grandes con masas similares. Un simple experimento de pensamiento muestra por qué las nanopartículas tienen áreas de superficie fenomenalmente altas.
Un cubo sólido de un material de 1 cm en un lado tiene 6 cm 2 de área de superficie, aproximadamente igual a un lado de media barra de goma. Cuando el 1 cm 3 se llena con cubos del tamaño de un micrómetro -un billón (10 12) de ellos, cada uno con una superficie de 6 micrómetros cuadrados- la superficie total asciende a 6 m 2. . A medida que aumenta el área superficial por masa de un material, una mayor proporción del material entra en contacto con los materiales circundantes (Figura 2). Las partículas pequeñas también dan que hay una alta proporción de átomos superficiales, alta energía superficial, confinamiento espacial e imperfecciones reducidas (Figura 2). Se traduce en el hecho de que los ENM están teniendo una reactividad ampliada. en comparación con los materiales “a granel” más grandes. Por ejemplo, las ENM tienen la potencia de transferir medicación concentrada a través de las membranas celulares de los tejidos diana. Mediante la ingeniería de nanomateriales, estas propiedades pueden aprovecharse para hacer nuevos productos o procesos valiosos.
Los ENM a menudo están diseñados para lograr un propósito particular, aprovechando el hecho de que los materiales a nanoescala tienen propiedades diferentes a sus contrapartes a mayor escala.
ENM y procesos ambientales
Las ENM se describen como una población de partículas y se cuantifican por la distribución del tamaño de partícula (PSD). Sin embargo, a menudo se reporta un solo valor (por ejemplo, promedio ± desviación estándar) y no el PSD completo. Cuando las partículas se suspenden en un medio de exposición, la distribución de tamaño de las NP está cambiando con el tiempo. Después de ser emitidas a ambientes acuáticos, las NP están sujetas a una serie de procesos ambientales. Estos procesos incluyen disolución y agregación (ver Figura 3) y posterior sedimentación. Se sabe que el comportamiento y destino de las NP son altamente dependientes de la química del agua. En particular, parámetros ambientales como pH, concentración y tipo de sales (especialmente cationes divalentes) y materia orgánica natural (NOM) pueden influir fuertemente en el comportamiento de las NP en el ambiente. Por ejemplo, el pH puede afectar la agregación y disolución de las NP metálicas al influir en el potencial superficial de las NP (von der Kammer et al., 2010). Los cationes divalentes Ca 2+ y Mg 2+ son capaces de comprimir eficientemente la doble capa eléctrica de NP y, en consecuencia, potenciar la homo-agregación y heteroagregación de NP (ver Figura 2) y los cationes estarán relacionados con el puente de las interacciones electrostáticas. En aguas superficiales, los procesos de agregación suelen conducir a la sedimentación y a veces a agregados flotantes (dependiendo de la densidad).
El recubrimiento de ENM cambiará la dinámica de estos procesos. Como resultado de estas características nano-específicas, los ENM forman una suspensión que es diferente de los químicos que se disuelven y forman una solución. Estas ENM en suspensión siguen entonces diferentes destinos y comportamientos ambientales en comparación con las soluciones. Por esta razón, la forma en que se debe expresar la dosis de ENPs es altamente debatida dentro de la comunidad de nano-seguridad. Si esto es sobre una base de masa, como es el caso de las moléculas de productos químicos convencionales (por ejemplo, mg/L), o es el número de partículas la métrica de dosis preferida, como en la ciencia coloidal (por ejemplo, número de partículas/L, o relación relativa superficie-volumen) o expresión de dosimetría multimixta. Cómo expresar la dosis para nanomateriales es una búsqueda aún debatida dentro de la comunidad científica (Verscoor et al., 2019).
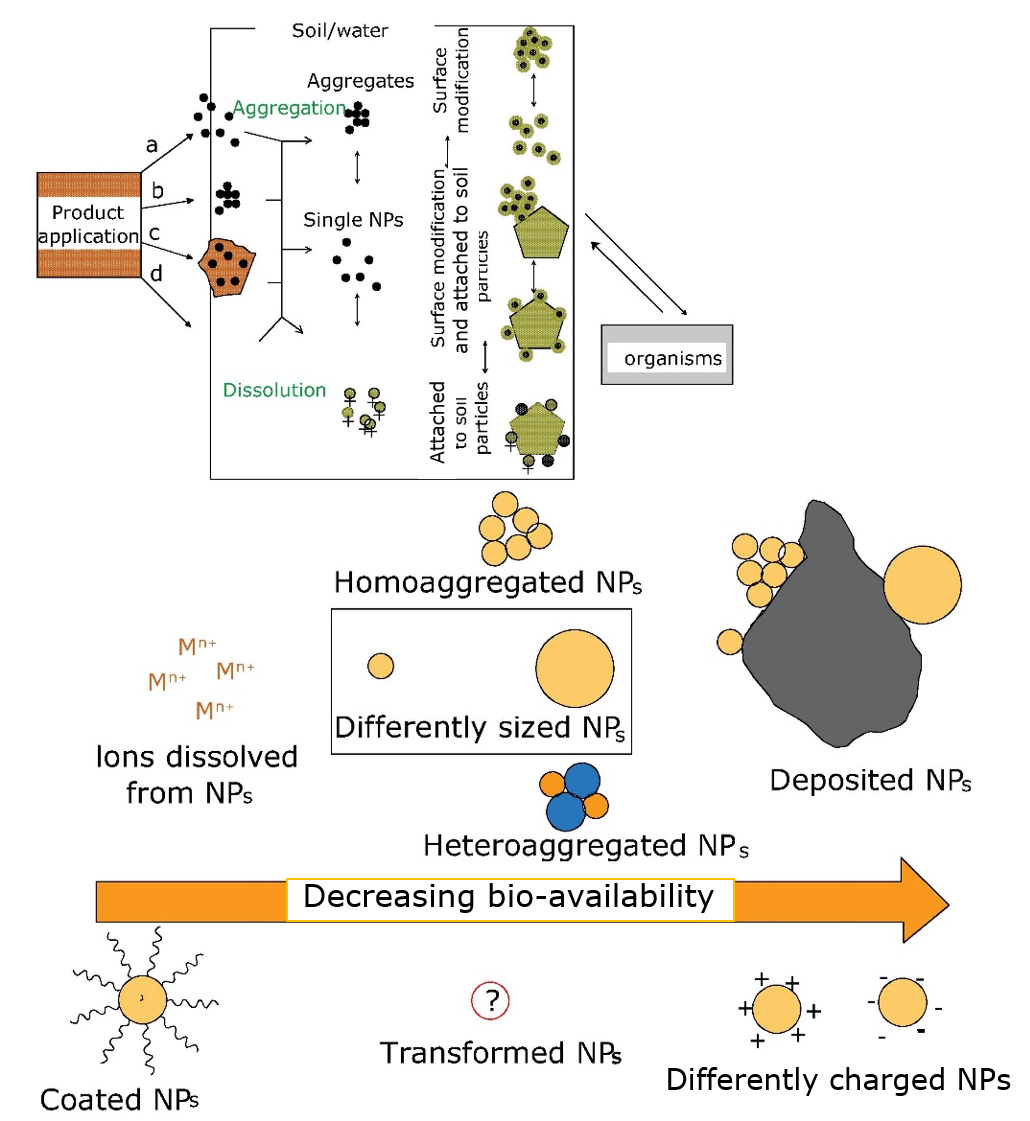
Clasificación de NM
Aunque aprendimos del texto anterior que cambiar la forma de un nanomaterial puede producir un material con nuevas propiedades (es decir, un nuevo nanomaterial); a menudo un grupo de materiales desarrollados lleva el nombre del principal componente químico de los ENM (por ejemplo, NanoTiO 2) que está disponible en diferentes (nano) formas. A continuación se han presentado enfoques para las ENM grupales:
- Clasificación por dimensionalidad/forma/ morfología:
La clasificación basada en la forma se relaciona con la definición de nanomateriales, y ha sido sinopsizada en la terminología ISO.
- Clasificación por composición/química:
Este enfoque agrupa los nanomateriales en función de sus propiedades químicas.
- Clasificación por complejidad/funcionalidad:
Los nanomateriales que están en uso rutinario en los productos actualmente probablemente sean desplazados por nanomateriales diseñados para tener múltiples funcionalidades, los llamados nanomateriales de 2a-4ª generación.
- Clasificación por biointerfaz:
Una propuesta se relaciona con la hipótesis de que los nanomateriales adquieren una identidad biológica al entrar en contacto con biofluidos y entidades vivientes. Los enfoques de biología de sistemas ayudarán a identificar los impactos clave y las redes de interacción de nanopartículas.
Referencias
Garner, K.L., Keller, A.A. (2014). Patrones emergentes para nanomateriales diseñados en el ambiente: una revisión de estudios de destino y toxicidad. Revista de Investigación en Nanopartículas 16:2503.
Nowack, B., Bucheli, T.D. (2007). Ocurrencia, comportamiento y efectos de nanopartículas en el ambiente. Contaminación Ambiental 150, 5-22.
Verscoor, A.J., Harper, S., Delmaar, C.J.E., Park, M.V.D.Z., Sips, A.J.A.M., Vijver, M.G., Peijnenburg, W.J.G.M. (2019). Selección sistemática de una métrica de dosis para nanopartículas a base de metal. NanoImpact 13, 70-75.
Von der Kammer, F., Ottofuelling, S., Hofmann, T. (2010). Evaluación del comportamiento fisicoquímico de nanopartículas de dióxido de titanio en ambientes acuáticos mediante pruebas de parámetros multidimensionales. Contaminación Ambiental 158, 3472-3481.
¿Qué nos dio (como humanidad) la capacidad de sintetizar virtualmente cada material a nanoescala?
Explique la afirmación 'el tamaño sí importa' para la reactividad, use dentro de su explicación la relación entre el tamaño de partícula y el área de superficie.
Dé un ejemplo de una propiedad nano-específica -que no es el tamaño- que potencia la reactividad de un material.