4.4: Aumento del realismo ecológico en las pruebas de toxicidad
- Page ID
- 70462
4.4. Aumento del realismo ecológico en las pruebas de toxicidad
Autor: Michiel Kraak
Revisor: Kees van Gestel
Objetivos de aprendizaje:
Deberías ser capaz de
- argumentan la necesidad de aumentar el realismo ecológico en las pruebas de toxicidad de una sola especie.
- enumerar los pasos consecutivos para aumentar el realismo ecológico en las pruebas de toxicidad de una sola especie.
Palabras clave: ensayos de toxicidad monoespecie, toxicidad de mezcla, multiestrés, toxicidad crónica, efectos multigeneracionales, realismo ecológico.
Introducción
La gran mayoría de las pruebas de toxicidad de una sola especie reportadas en la literatura se refieren a exposiciones agudas o a corto plazo a sustancias químicas individuales, en las que la mortalidad suele ser el único punto final. Esto contrasta con la situación real en sitios contaminados, donde los organismos pueden estar expuestos a niveles relativamente bajos de mezclas de contaminantes en condiciones subóptimas durante toda su vida útil. Por lo tanto, existe una necesidad urgente de aumentar el realismo ecológico en las pruebas de toxicidad de una sola especie abordando criterios de valoración subletales, toxicidad de mezclas, efectos multiestrés, toxicidad crónica y efectos multigeneracionales.
Aumento del realismo ecológico en ensayos de toxicidad de una sola especie
La mortalidad es un parámetro crudo que representa la respuesta de los organos
s ms a concentraciones relativamente altas y por lo tanto a menudo ambientalmente irrelevantes para el medio ambiente. A concentraciones de tóxicos mucho más bajas y ambientalmente más relevantes, los organismos pueden sufrir una amplia variedad de efectos subletales. Por lo tanto, el primer paso para ganar realismo ecológico en las pruebas de toxicidad de una sola especie es abordar los criterios de valoración subletales en lugar de, o además de la mortalidad (Figura 1). Sin embargo, dado el corto tiempo de exposición en las pruebas de toxicidad aguda, es difícil evaluar otros criterios de valoración además de la mortalidad. La fotosíntesis de las plantas y el comportamiento de los animales son criterios de valoración elegantes, sensibles y de rápida respuesta que se pueden incorporar en pruebas de toxicidad a corto plazo para potenciar su realismo ecológico (ver sección Puntos finales).Dado que los organismos suelen estar expuestos a niveles relativamente bajos de contaminantes durante toda su vida útil, el siguiente paso para aumentar el realismo ecológico en las pruebas de toxicidad de una sola especie es aumentar el tiempo de exposición realizando experimentos crónicos (Figura 1) (ver sección Toxicidad crónica). Además, en las pruebas de toxicidad crónica se puede evaluar una amplia variedad de criterios de valoración subletales además de la mortalidad, siendo los más comunes el crecimiento y la reproducción (ver sección Puntos finales). Dada la duración relativamente corta del ciclo de vida de muchos invertebrados y organismos unicelulares como bacterias y algas, sería relevante prolongar aún más el tiempo de exposición, exponiendo los organismos de prueba durante toda su vida, así desde la fase óvulo o juvenil hasta la edad adulta incluyendo su desempeño reproductivo, o por varias generaciones, evaluando efectos multigeneracionales (Figura 1) (ver sección Efectos multigeneracionales).
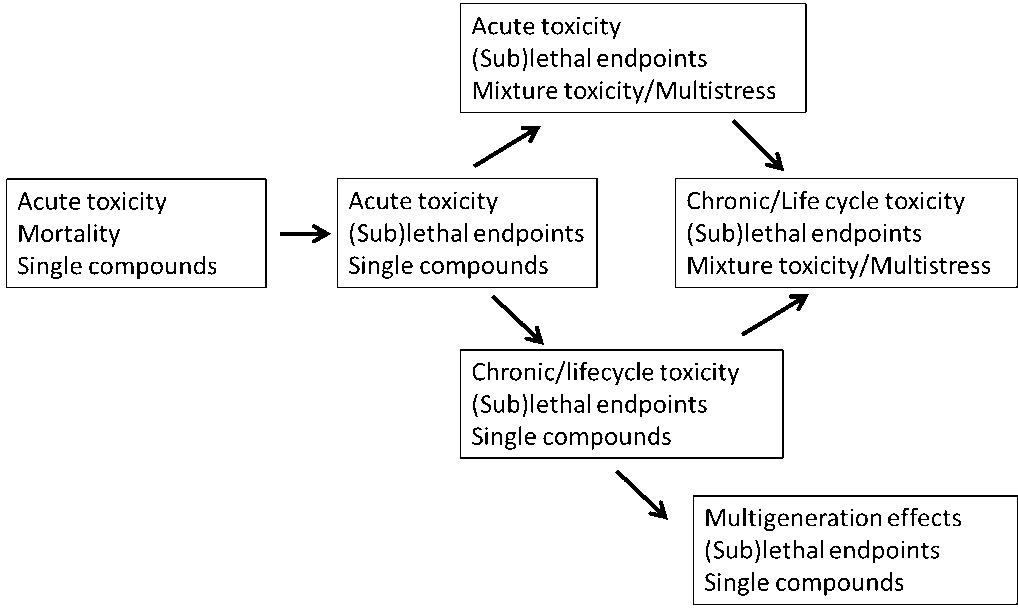
En ambientes contaminados, los organismos generalmente están expuestos a una amplia variedad de tóxicos en condiciones variables y subóptimas. Para obtener aún más realismo ecológico, se deben considerar escenarios de toxicidad de mezclas y multiestrés (figura 1) (ver secciones Toxicidad de mezcla y Multiestrés). La mayor relevancia ecológica de las pruebas de toxicidad de laboratorio se puede lograr abordando los temas mencionados en conjunto en un tipo de experimento, pruebas de toxicidad de mezclas crónicas que evalúan criterios de valoración subletales. Sin embargo, aún hoy en día tales estudios siguen siendo escasos.
Otra forma de aumentar el realismo ecológico de las pruebas de toxicidad es avanzar hacia sistemas de prueba multiespecies que permitan evaluar los impactos de los químicos y otros factores estresantes en las interacciones de especies dentro de las comunidades (ver capítulo 5 sobre Ecotoxicología de poblaciones, comunidades y ecosistemas).
Argumentan la necesidad de incrementar el realismo ecológico en las pruebas de toxicidad de especies individuales
Enumerar los pasos consecutivos para aumentar el realismo ecológico en pruebas de toxicidad de una sola especie.
4.4.1. Toxicidad de mezcla
Autores: Michiel Kraak & Kees van Gestel
Revisor: Thomas Backhaus
Objetivos de aprendizaje:
Deberías ser capaz de
· explicar los conceptos involucrados en las pruebas de toxicidad de mezclas, incluyendo la adición de concentración y la adición de respuesta.
· diseñar experimentos de toxicidad de mezclas y comprender cómo se evalúa la toxicidad de mezclas tóxicas (equitóxicas).
· interpretar los resultados de los experimentos de toxicidad de mezclas y comprender el significado de Adición de Concentración, Adición de Respuesta, así como antagonismo y sinergia como desviaciones de Adición de Concentración y Adición de Respuesta.
Palabras clave: Toxicidad de mezcla, suma de TU, equitoxicidad, adición de concentración, adición de respuesta, acción independiente
Introducción
En ambientes contaminados, los organismos generalmente están expuestos a mezclas complejas de tóxicos. De ahí que exista una urgente necesidad de evaluar sus efectos tóxicos en las articulaciones. En teoría, hay cuatro clases de efectos conjuntos de compuestos en una mezcla como se representa en la Figura 1.
|
Cuatro clases de efectos articulares |
Sin interacción (aditivo) |
Interacción (no aditivo) |
|
Acción similar |
Acción similar simple/ Adición de concentración |
Acción similar compleja |
|
Acción disímiles |
Acción independiente/ Adición de respuesta |
Acción dependiente |
Figura 1. Las cuatro clases de efectos conjuntos de compuestos en una mezcla, según lo propuesto por Hewlett y Plackett (1959).
Acción similar simple y adición de concentración
El caso más simple se refiere a compuestos que comparten el mismo modo de acción y no interactúan (Figura 1 panel superior izquierdo: acción similar simple). Esto se aplica a compuestos que actúan sobre la misma vía biológica, afectando estrictamente a la misma diana molecular. De ahí que la única diferencia sea la potencia relativa de los compuestos. En este caso se toma como punto de partida la Adición de Concentración, siguiendo el enfoque de Unidad Tóxica (TU). Este enfoque expresa la potencia tóxica de un químico como TU, que se calcula para cada compuesto en la mezcla como:
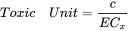
con c = la concentración del compuesto en la mezcla, y EC x = la concentración del compuesto donde el punto final medido se ve afectado por X% en comparación con el testigo no expuesto. A continuación, se calcula la potencia tóxica de la mezcla como la suma de las TU de los compuestos individuales:
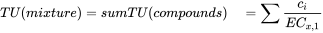
Imagínese que el EC 50 del compuesto A es 300 μg.L -1 y el del compuesto B 60 μg.L -1. En una mezcla de A+B se agregan 30 μg.L -1 A y 30 μg.L -1 B. Estas concentraciones representan 30/300 = 0.1 TU de A y 30/60 = 0.5 TU de B. Por lo tanto, la mezcla consiste en 0.1 + 0.5 = 0.6 TU. Sin embargo, los dos compuestos en esta mezcla no están representados a igual fuerza tóxica, ya que esta mezcla específica está dominada por el compuesto B. Para componer mezclas en las que los compuestos están representados a igual fuerza tóxica, se aplica el concepto de equitoxicidad:
1 TU Equitóxica A+B = 0.5 TU A + 0.5 TU B
1 Equitóxico TU A+B = 150 μg.L -1 A + 30 μg.L -1 B
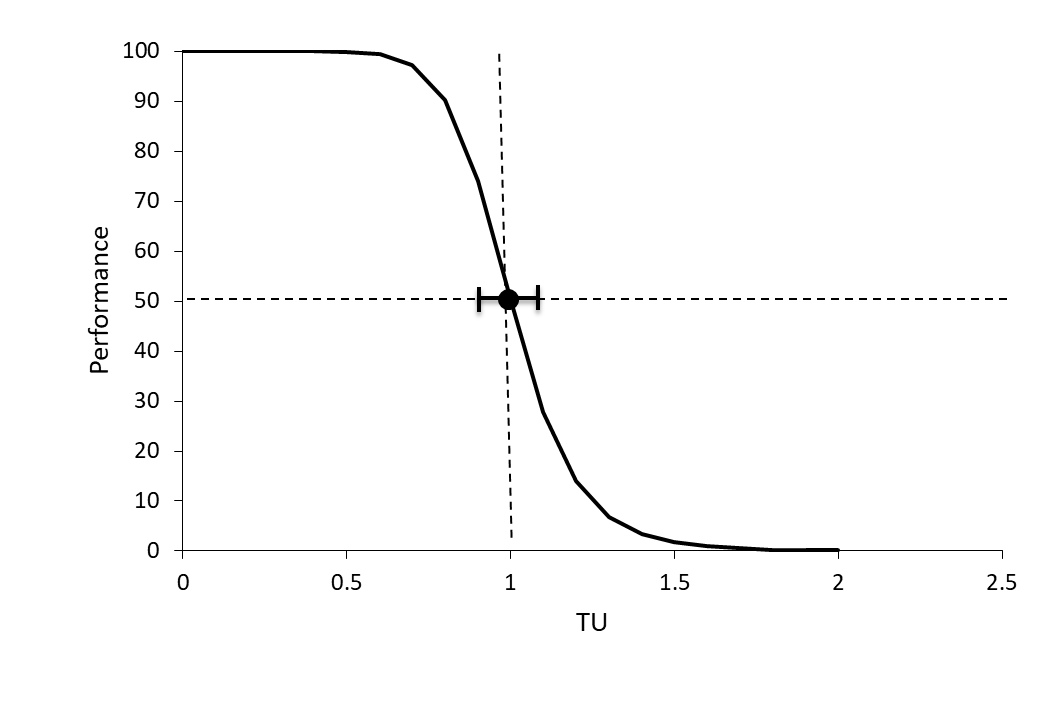
Al igual que en las relaciones tradicionales concentración-respuesta, se grafica la supervivencia o un punto final subletal frente a la concentración de la mezcla a partir de la cual se puede derivar el valor de EC 50 y los correspondientes límites de confianza del 95% (ver sección sobre relaciones concentración-respuesta). Si los límites de confianza superior e inferior del 95% del valor EC 50 de la mezcla incluyen 1 TU, el EC 50 de la mezcla no difiere de 1 TU y la toxicidad de los compuestos en la mezcla es efectivamente aditivo de concentración (Figura 2).
Un experimento atractivo para la imaginación fue realizado por Deneer et al. (1988), quienes probaron una mezcla de 50 compuestos narcóticos (ver sección Toxicodinámica e interacciones moleculares) y observaron una adición de concentración perfecta, incluso cuando los compuestos individuales estaban presentes en solo 0.25% (0. 0025 TU) de su EC 50. Esto demostró en particular que los compuestos narcóticos presentes en concentraciones muy por debajo de su nivel de no efecto aún contribuyen a la toxicidad conjunta de una mezcla (Deneer et al., 1988). Esto también se mostró para los metales (Kraak et al., 1999). Esto es alarmante, ya que aún hoy en día la legislación ambiental se basa todavía en un enfoque compuesto por compuesto. El estudio de Deneer et al. (1988) también demostró claramente los desafíos logísticos de las pruebas de toxicidad de mezclas. Dado que para componer mezclas equitóxicas se necesitan conocer los valores EC 50 de los compuestos individuales, probar una mezcla equitóxica de 50 compuestos requiere 51 pruebas de toxicidad: 50 compuestos individuales y 1 mezcla.
Acción independiente y adición de respuesta
Cuando los químicos tienen un modo de acción diferente, actúan sobre diferentes objetivos, pero aún así contribuyen al mismo punto final biológico, se espera que la mezcla se comporte de acuerdo con la adición de respuesta (también denominada Acción Independiente; Figura 1, panel inferior izquierdo). Tal situación ocurriría, por ejemplo, si un compuesto inhibe la fotosíntesis, y un segundo inhibe la replicación del ADN, pero ambos inhiben el crecimiento de una población de algas expuestas. Para calcular el efecto de una mezcla de compuestos con diferentes modos de acción, se aplica la Adición de Respuesta de la siguiente manera: La probabilidad de que un compuesto, a la concentración a la que está presente en la mezcla, ejerza un efecto tóxico (escalado de 0 a 1), difiera por compuesto y el efecto acumulativo del es el resultado de combinar estas probabilidades, de acuerdo con:
E (mezcla) = E (A) + E (B) - E (A) E (B)
Donde E (mezcla) es la fracción afectada por la mezcla, y E (A) y E (B) son las fracciones afectadas por los compuestos individuales A y B a las concentraciones a las que ocurren en la mezcla. De hecho, esta ecuación suma la fracción afectada por el compuesto A y la fracción afectada por el compuesto B a la concentración a la que están presentes en la mezcla, y luego corrige por el hecho de que la fracción ya afectada por el químico A no puede ser afectada de nuevo por el químico B (o viceversa). Esta última parte de la ecuación es necesaria para dar cuenta del hecho de que los químicos actúan de manera independiente entre sí. Esto se visualiza en la Figura 3.

La ecuación: E (mezcla) = E (A) + E (B) - E (A) E (B)
se puede reescribir como: 1-E (mezcla) = (1-E A) * (1-E B)
Esto significa que la probabilidad de no verse afectado por la mezcla (1-E (mezcla)) es producto de las probabilidades de no verse afectado por (las concentraciones específicas de) compuesto A y compuesto B. En la EC 50, tanto la fracción afectada como la no afectada son del 50%, de ahí que ( 1-E A) * (1-E B) = 0.5. Si ambos compuestos contribuyen igualmente al efecto de la mezcla, (1-E A) = (1-E B) y así (1-E A o B) 2 = 0.5, por lo que tanto (1-E A) como (1-E B) son iguales 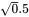 = 0.71. Dado que la probabilidad de no ser afectado es de 0.71 para el compuesto A y el compuesto B, la probabilidad de ser afectado es de 0.29. Así, en el EC 50 de una mezcla de dos compuestos que actúan de acuerdo con la Acción Independiente, ambos compuestos deben estar presentes a una concentración igual a su EC 29.
= 0.71. Dado que la probabilidad de no ser afectado es de 0.71 para el compuesto A y el compuesto B, la probabilidad de ser afectado es de 0.29. Así, en el EC 50 de una mezcla de dos compuestos que actúan de acuerdo con la Acción Independiente, ambos compuestos deben estar presentes a una concentración igual a su EC 29.
Interacciones entre los compuestos en una mezcla
Tanto la adición de concentración como la adición de respuesta asumen que los compuestos en una mezcla no interaccionan (ver Figura 1). Sin embargo, en realidad, tales interacciones pueden ocurrir en los cuatro pasos de la acción tóxica de una mezcla. El primer paso se refiere a las interacciones químicas y fisicoquímicas. Los compuestos en el ambiente pueden interactuar, afectando la biodisponibilidad de los demás. Por ejemplo, el exceso de Zn hace que Cd esté más disponible en la solución del suelo como resultado de la competencia por los mismos sitios de unión. El segundo paso implica interacciones fisiológicas durante la captación por un organismo, influyendo en la toxicocinética de los compuestos, por ejemplo por competencia por sitios de captación en la membrana celular. El tercer paso se refiere al procesamiento interno de los compuestos, por ejemplo, implicando efectos sobre la biotransformación o desintoxicación (toxicocinética) de cada uno. El cuarto paso se refiere a las interacciones en el sitio o sitios diana, es decir, la toxicodinámica durante el proceso de intoxicación real. Las respuestas típicas del organismo completo que se registran en muchas pruebas de ecotoxicidad integran los últimos tres tipos de interacciones, resultando en desviaciones de las predicciones de toxicidad de la adición de concentración y la adición de respuesta.
Desviaciones de adición de concentración
Si la EC 50 de la mezcla es superior a 1 TU y el límite de confianza inferior del 95% también está por encima de 1 TU, la toxicidad de los compuestos en la mezcla es menor que la concentración del aditivo, ya que se necesita más de la mezcla de lo previsto para causar un efecto del 50% (Figura 4, línea azul; antagonismo). Correspondientemente, si la EC 50 de la mezcla es inferior a 1 TU y el límite de confianza superior del 95% también está por debajo de 1 TU, la toxicidad de los compuestos en la mezcla es mayor que el aditivo de concentración (Figura 4, línea roja; sinergia).
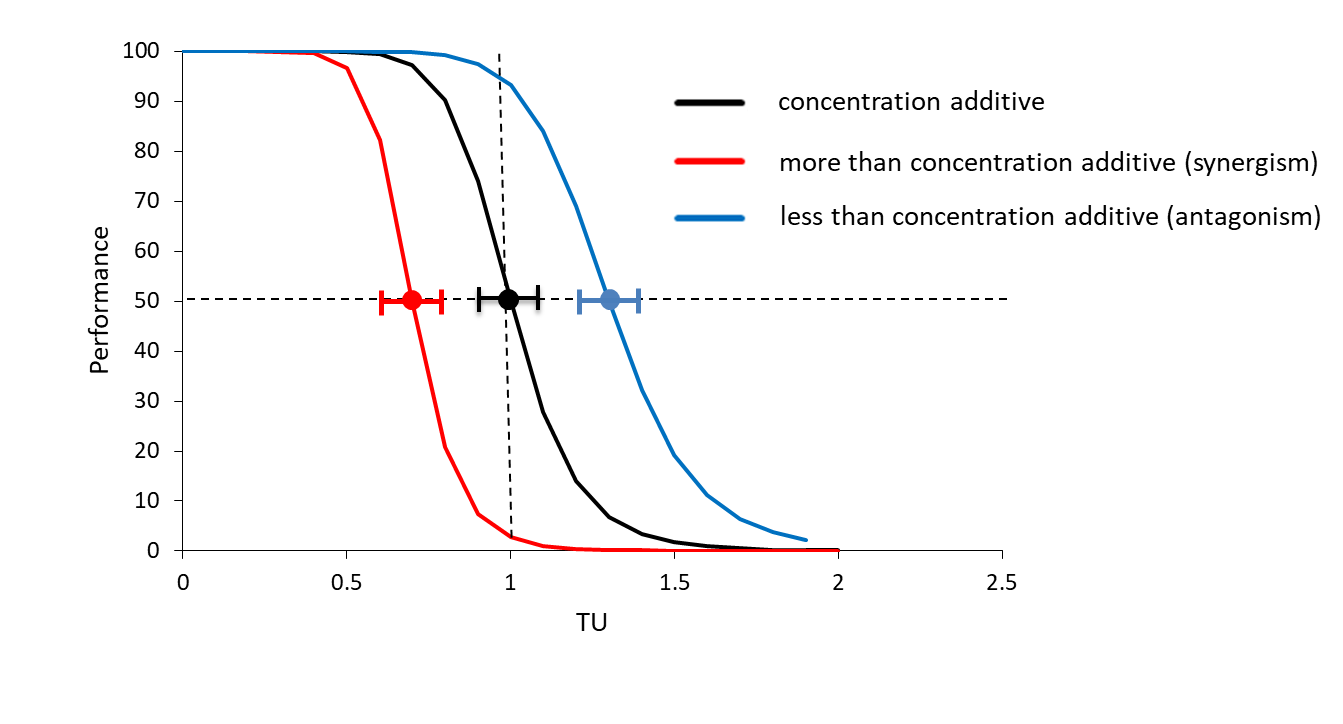
Cuando la toxicidad de una mezcla es más que un aditivo de concentración, los compuestos mejoran la toxicidad de los demás. Cuando la toxicidad de una mezcla es menor que el aditivo de concentración, los compuestos reducen la toxicidad de cada uno. Ambos tipos de desviación de la aditividad pueden tener dos razones distintas: 1. Los compuestos tienen el mismo modo de acción, pero sí interactúan (Figura 1, panel superior derecho: acción similar compleja). 2. Los compuestos tienen diferentes modos de acción (Acción Independiente/Adición de Respuesta; Figura 1, panel inferior izquierdo).
Superficies de concentración-respuesta e isóboles
Elaborando en la Figura 4, las relaciones concentración-respuesta para mezclas también se pueden presentar como figuras multidimensionales, con diferentes ejes para la concentración de cada uno de los químicos incluidos en la mezcla (Figura 5A). En el caso de una mezcla de dos productos químicos, dicha superficie dosis-respuesta se puede mostrar en un plano bidimensional usando isóboles. La Figura 5B muestra isóboles para una mezcla de dos productos químicos, bajo diferentes supuestos para interacciones según Adición de Concentración. Si la interacción entre los dos compuestos disminuye la toxicidad de la mezcla, esto se denomina antagonismo (Figura 5B, línea azul). Si la interacción entre los dos compuestos aumenta la toxicidad de la mezcla, esto se denomina sinergia (Figura 5B, línea roja). Así, tanto el antagonismo como el sinergismo son términos para describir las desviaciones de la adición de concentración debido a la interacción entre los compuestos. Sin embargo, el antagonismo en relación con la Adición de Concentración (menor que el aditivo de concentración; Figura 5B línea azul) puede ser causado simplemente por los compuestos que se comportan de acuerdo con la Adición de Respuesta, y no se comportan de manera antagonista
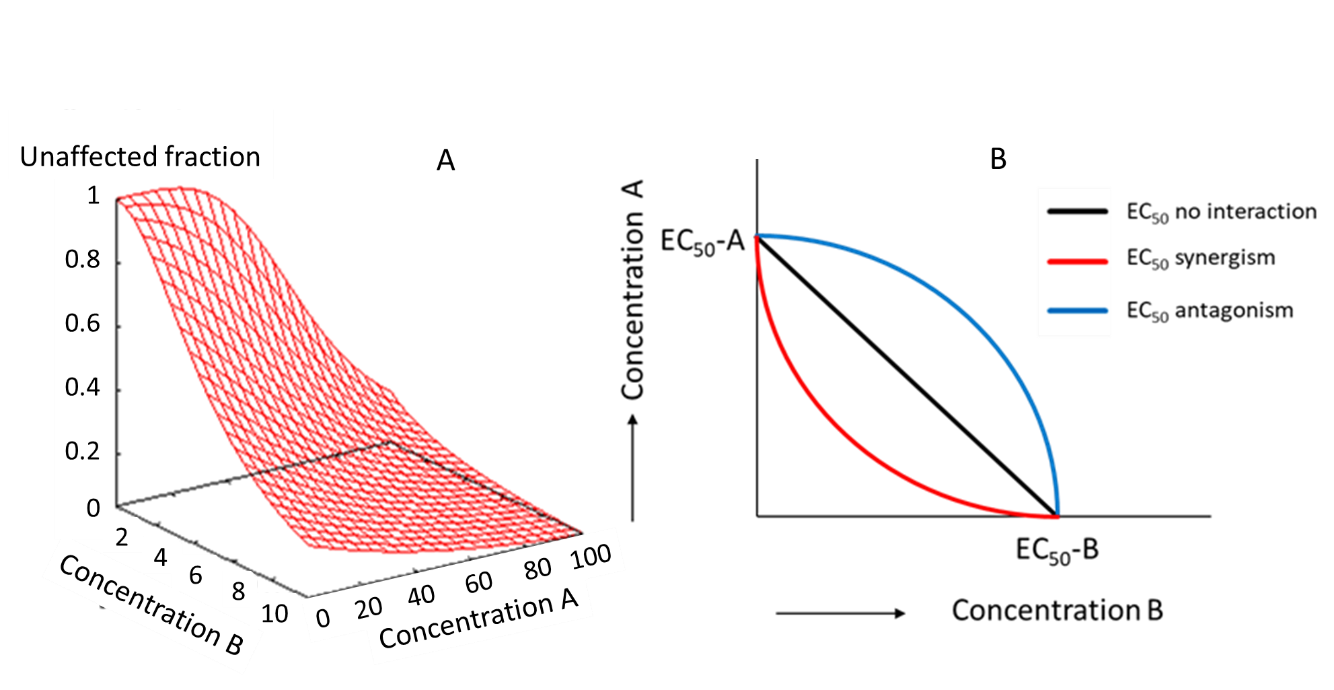
Sinergismo y antagonismo evaluados por ambos conceptos
El uso de los términos sinergismo y antagonismo puede ser problemático, ya que el antagonismo en relación con la Adición de Concentración (menor que aditivo de concentración; Figura 5B línea azul) puede ser causado simplemente por los compuestos que se comportan de acuerdo con la Adición de Respuesta, y no comportándose de manera antagónica. De igual manera, las desviaciones de la Adición de Respuesta también podrían significar que los químicos en la mezcla sí tienen el mismo modo de acción, por lo que actúan de manera aditiva de acuerdo con la Adición Por lo tanto, solo se puede concluir sobre sinergismo/antagonismo si las observaciones experimentales son superiores/menores que las predicciones de ambos conceptos.
Lectura adicional sugerida
Jinete, C.V., Simmons, J.E. (2018). Mezclas Químicas y Estresores Químicos y No Químicos Combinados: Exposición, Toxicidad, Análisis y Riesgo, Springer International Publishing AG. ISBN-13:978-3319562322.
Bopp, S.K., Kienzler, A., Van der Linden, S., Lamon, L., Paini, A., Parissis, N., Richarz, A.N., Triebe, J., Worth, A. (2016). Revisión de estudios de caso sobre la evaluación de riesgos humanos y ambientales de mezclas químicas. Informes Técnicos JRC EUR 27968 ES, Unión Europea, doi:10.2788/272583.
Referencias
Berenbaum, M.C. (1981). Criterios para analizar las interacciones entre agentes biológicamente activos. Avances en la Investigación del Cáncer 35, 269-335.
Deneer, J.W., Sinnige, T.L., Seinen, W., Hermens, J.L.M. (1988). Toxicidad aguda conjunta a Daphnia magna de químicos orgánicos industriales a bajas concentraciones. Toxicología Acuática 12, 33-38.
Hewlett, P.S., Plackett, R.L. (1959). Una teoría unificada para respuestas cuánticas a mezclas de drogas: acción no interactiva. Biometría 15, 691 610.
Kraak, M.H.S., Stuijfzand, S.C., Admiraal, W. (1999). Ecotoxicidad a corto plazo de una mezcla de cinco metales al mejillón cebra Dreissena polymorpha. Boletín de Contaminación Ambiental y Toxicología 63, 805-812.
Van Gestel, C.A.M., Jonker, M.J., Kammenga, J.E., Laskowski, R., Svendsen, C. (Eds.) (2011). Toxicidad de mezcla. Vinculación de enfoques desde la toxicología ecológica y humana. Prensa SETAC, Sociedad de Toxicología y Química Ambiental, Pensacola.
¿Cuál es la motivación para realizar experimentos de toxicidad de mezclas?
¿Cuándo esperas concentración-adición y cuándo no?
¿Cuáles son los tres posibles resultados de un experimento de toxicidad de mezcla aplicando adición de concentración?
Calcular la concentración del efecto a la que dos compuestos con diferentes modos de acción que no muestran interacción contribuyen igualmente a que una mezcla cause 60% de efecto.
Solo se puede concluir sobre sinergismo/antagonismo, si las observaciones experimentales son superiores/menores que las predicciones de ambos conceptos (adición de concentración y adición de respuesta). ¿Por qué?
4.4.2. Introducción multiestrés
Autor: Michiel Kraak
Revisor: Kees van Gestel
Objetivos de aprendizaje:
Deberías ser capaz de
· definir estrés y multiestrés.
· explicar la relevancia ecológica de los escenarios multiestrés.
Palabras clave: Estrés, multiestrés, interacciones químico-abióticas, interacciones químico-bióticas
Introducción
En ambientes contaminados, los organismos generalmente están expuestos a una amplia variedad de tóxicos en condiciones variables y subóptimas. Para ganar realismo ecológico, se deben considerar escenarios multiestrés, pero estos, sin embargo, están poco estudiados.
Definiciones
El estrés se define como un cambio ambiental que afecta la aptitud y el funcionamiento ecológico de las especies (es decir, crecimiento, reproducción, comportamiento), conduciendo finalmente a cambios en la estructura de la comunidad y el funcionamiento de los ecosistemas. El multiestrés se define posteriormente como una situación en la que un organismo está expuesto tanto a un tóxico como a condiciones ambientales estresantes. Esto incluye interacciones químico-abióticas, interacciones químico-bióticas, así como combinaciones de estas. Los estresores abióticos comunes son, por ejemplo, el pH, la sequía, la salinidad y sobre todo la temperatura, mientras que los estresores bióticos comunes incluyen la depredación, la competencia, la densidad poblacional y la escasez de alimentos. Los experimentos sobre tales factores estresantes suelen estudiar, por ejemplo, el efecto del aumento de la temperatura o la influencia de la disponibilidad de alimentos sobre la toxicidad de los compuestos.
La presente definición de multiestrés excluye así la toxicidad de la mezcla (ver sección Toxicidad de la mezcla) así como las situaciones en las que los organismos se enfrentan a varias variables ambientales subóptimas (a) bióticas conjuntamente sin estar expuestos a tóxicos. Los capítulos siguientes tratan sobre las interacciones químico-abiótica y químico-biótica y cuestiones prácticas relacionadas con la realización de experimentos multiestrés, respectivamente.
Dar las definiciones de estrés y multiestrés.
¿Cuál es la relevancia ecológica de probar escenarios multiestrés?
4.4.3. Multiestrés - biótico
Autores: Marjolein Van Ginneken y Lieven Bervoets
Revisores: Michiel Kraak y Martin Holmstrup
Objetivos de aprendizaje:
Deberías ser capaz de
- definir el estrés biótico y dar tres ejemplos.
- explicar cómo los factores estresantes bióticos pueden cambiar la toxicidad de los productos químicos
- explicar cómo los químicos pueden cambiar la forma en que los organismos reaccionan a los factores estresantes bióticos
Palabras clave: Multiestrés, interacciones químico-bióticas, interacciones estresantes, biodisponibilidad, comportamiento, compensación energética
Introducción
Generalmente, los organismos tienen que hacer frente a la presencia conjunta de estresores químicos y naturales. Tanto los estresores bióticos como los abióticos pueden afectar la biodisponibilidad y toxicocinética de los productos químicos. Adicionalmente, pueden influir en el comportamiento y fisiología de los organismos, lo que podría resultar en mayores o menores efectos tóxicos. Viceversa, los químicos pueden alterar la forma en que los organismos reaccionan a los factores estresantes naturales
Al estudiar los efectos de múltiples factores estresantes, podemos identificar posibles interacciones sinérgicas, aditivas o antagónicas, que son esenciales para evaluar adecuadamente el riesgo de los químicos en la naturaleza. Relyea (2003), por ejemplo, encontró que concentraciones aparentemente seguras de carbarilo pueden llegar a ser mortales para algunas especies de anfibios cuando se combinan con señales de depredadores. Esta sección se centra en el estrés biótico, el cual puede definirse como el estrés causado por organismos vivos e incluye depredación, competencia, densidad poblacional, disponibilidad de alimentos, patógenos y parasitismo. Describirá cómo actúan e interactúan los estresores bióticos y los químicos.
Tipos de factores estresantes bióticos
Los factores estresantes bióticos pueden tener efectos directos e indirectos sobre los organismos. Por ejemplo, los depredadores pueden cambiar las estructuras de la red alimentaria consumiendo a sus presas y alterando así la abundancia de presas y también pueden afectar indirectamente el crecimiento y desarrollo de las presas, induciendo mecanismos de defensa energéticamente costosos. También se pueden disminuir comportamientos como la actividad (forrajera) e incluso se pueden inducir cambios morfológicos. Por ejemplo, Daphnia pulex puede desarrollar espinas del cuello cuando están sujetas a depredación. De manera similar, los parásitos pueden alterar el comportamiento del huésped o inducir cambios morfológicos, por ejemplo, en la coloración, pero generalmente no matan a su huésped. Sin embargo, el parasitismo puede comprometer el sistema inmunológico y alterar el presupuesto energético del huésped.
La alta densidad poblacional es un factor estresante que puede afectar los presupuestos energéticos y la competencia intraespecífica e interespecífica por espacio, estatus o recursos. Al alterar la disponibilidad de recursos, los cambios en el crecimiento y el tamaño al vencimiento pueden ser el resultado. Adicionalmente, estos factores estresantes relacionados con la competencia pueden afectar el comportamiento, por ejemplo, al limitar el número de parejas de apareamiento adecuadas. También los patógenos (por ejemplo, virus, bacterias y hongos) pueden disminuir la aptitud y la fecundidad.
Debe tenerse en cuenta que los efectos de diferentes factores estresantes bióticos no pueden separarse estrictamente entre sí. Por ejemplo, los patógenos pueden propagarse más rápidamente cuando las densidades poblacionales son altas, mientras que la depredación, por otro lado, puede limitar la competencia.
Efectos de los estresores bióticos sobre la biodisponibilidad y toxicocinética
Los factores estresantes bióticos pueden alterar la biodisponibilidad de los productos químicos. Por ejemplo, en el ambiente acuático, el nivel de los alimentos puede determinar la disponibilidad de productos químicos para filtrar los alimentadores, ya que pueden adsorberse a la materia orgánica particulada, como las algas. Dado que la vía de exposición (a base de agua o vía alimentaria) puede influir en los procesos toxicocinéticos posteriores, esto también puede cambiar los efectos tóxicos de los productos químicos.
Efectos de los factores estresantes bióticos sobre el comportamiento
Se ha reportado que los estresores bióticos causan efectos conductuales en organismos que podrían cambiar los efectos tóxicos de los químicos. Estos efectos incluyen tasas de alimentación alteradas y actividades reducidas. La presencia de un depredador, por ejemplo, reduce la actividad de la presa (forrajeo) para evitar ser detectada por el depredador percibido y así disminuye la absorción química a través de los alimentos. Por otro lado, la condición de los organismos presa disminuirá debido al menor consumo de alimentos, lo que significa que hay menos energía disponible para otros procesos fisiológicos (ver más abajo).
Además de los factores estresantes bióticos, también los químicos pueden alterar los comportamientos esenciales mediante la reducción de la sensibilidad del receptor olfativo, la inhibición de la colinesterasa, las alteraciones en los niveles de neurotransmisores cerebrales y los niveles alterados de hormonas gonadales o tiroideas. Esto podría provocar efectos disruptivos en la comunicación, las tasas de alimentación y la reproducción. Una incapacidad para encontrar parejas de apareamiento, por ejemplo, podría empeorarse entonces por una baja densidad poblacional. Además, los químicos pueden alterar las relaciones depredador-presa, lo que podría resultar en cascadas tróficas. Se observarán fuertes efectos de arriba hacia abajo cuando un depredador o pastor es más sensible al contaminante que su presa. Alternativamente, se observan efectos de abajo hacia arriba cuando se incrementa la susceptibilidad de una especie presa a la depredación. Por ejemplo, la exposición a Cu de peces y crustáceos puede disminuir su respuesta a las señales olfativas, haciéndolos insensibles al estrés de los depredadores y aumentando el riesgo de ser detectados y consumidos (Van Ginneken et al., 2018). También pueden ocurrir efectos sobre la competencia entre especies, cuando una especie es más sensible que la otra. Así, tanto los estresores químicos como los bióticos pueden alterar el comportamiento y dar como resultado efectos interactivos que podrían cambiar toda la estructura y función del ecosistema (Fleeger et al., 2003).
Fisiología
Los factores estresantes bióticos pueden causar tasas elevadas de respiración de los organismos, en organismos acuáticos, lo que lleva a una mayor absorción de tóxicos a través de la difusión. Por otro lado, también pueden disminuir la respiración. Por ejemplo, los bajos niveles de alimentos disminuyen la actividad metabólica y por lo tanto la respiración. Adicionalmente, una tasa metabólica reducida podría disminuir la toxicidad de los químicos que se activan metabólicamente. También ciertos químicos, como los metales, pueden causar un mayor o menor consumo de oxígeno, lo que podría contrarrestar o reforzar los efectos de los estresores bióticos.
Además de afectar la respiración, tanto los estresores bióticos como los químicos pueden inducir daño fisiológico a los organismos. Por ejemplo, el estrés depredador y los pesticidas causan estrés oxidativo, lo que lleva a efectos sinérgicos en la inducción de enzimas antioxidantes como la catalasa y la superóxido dismutasa (Janssens y Stoks, 2013). Además, el organismo puede eliminar o desintoxicar las concentraciones internas de tóxicos, por ejemplo, por transformación a través de enzimas de oxidación de función mixta (MFO) o por secuestro, es decir, unión a metalotioneínas o almacenamiento en tejidos inertes como gránulos. Estos mecanismos defensivos para la desintoxicación y el control de daños son energéticamente costosos, lo que lleva a compensaciones energéticas. Esto significa que se puede utilizar menos energía para otros procesos como el crecimiento, la locomoción o la reproducción. La disponibilidad de alimentos y las reservas de lípidos pueden desempeñar un papel importante, ya que los organismos bien alimentados que están expuestos a tóxicos pueden pagar más fácilmente los costos de energía que los organismos privados de alimentos.
Efectos interactivos
Las posibles interacciones, es decir, antagonismo, sinergia o aditividad, entre los efectos de los estresores son difíciles de predecir y pueden diferir dependiendo de la combinación de factores estresantes, concentración química, el punto final y la especie. Para Ceriodaphnia dubia, Qin et al. (2011) demostraron que el estrés depredador influyó en los efectos tóxicos de varios pesticidas de manera diferente. Mientras que las señales de depredadores interactuaron antagónicamente con bifentrina y tiacloprid, actuaron sinérgicamente con el fipronil.
También hay que señalar que los efectos interactivos en la naturaleza pueden ser más débiles que cuando se observan en el laboratorio ya que los niveles de estrés fluctúan más rápidamente o los animales pueden alejarse de áreas con alto riesgo de depredadores o niveles de exposición química. Por otro lado, debido a que generalmente más de dos factores estresantes están presentes en los ecosistemas, que también podrían interactuar de manera aditiva o sinérgica, podrían ser aún más importantes en la naturaleza. Comprender las interacciones entre múltiples factores estresantes es por lo tanto esencial para estimar el impacto real de los químicos en la naturaleza.
Referencias
Fleeger, J.W., Carman, K.R., Nisbet, R.M. (2003). Efectos indirectos de contaminantes en ecosistemas acuáticos. Ciencia del Medio Ambiente Total 317, 207-233.
Janssens, L., Stoks, R. (2013). Efectos sinérgicos entre el estrés pesticida y las señales de depredadores: resultados contradictorios de la historia de vida y la fisiología en la damisela Enallagma cyathigerum. Toxicología Acuática 132, 92-99.
Qin, G., Presley, S.M., Anderson, T.A., Gao, W., Maul, J.D. (2011). Efectos de las señales de depredadores sobre la toxicidad de plaguicidas: hacia una comprensión del mecanismo de la interacción. Toxicología y Química Ambiental 30, 1926-1934.
Relyea, R.A. (2003). Señales de depredadores y pesticidas: una doble dosis de peligro para los anfibios. Aplicaciones Ecológicas 13, 1515-1521.
Van Ginneken, M., Blust, R., Bervoets, L. (2018). Efectos combinados de mezclas metálicas y estrés depredador sobre el isópodo de agua dulce Asellus aquaticus. Toxicología Acuática 200, 148-157.
Dar la definición de estrés biótico y dar 3 ejemplos.
¿Cómo pueden los estresores bióticos cambiar los efectos tóxicos de los productos químicos?
Dé un ejemplo de cómo los químicos pueden cambiar la forma en que los organismos reaccionan al estrés biótico?
4.4.4. Multiestrés - abiótico
Autor: Martina Vijver
Revisores: Kees van Gestel, Michiel Kraak, Martin Holmstrup
Objetivos de aprendizaje:
Deberías ser capaz de
- relacionar el estrés con el concepto de nicho ecológico
- enumerar los factores abióticos que pueden alterar los efectos tóxicos de los químicos en los organismos e indicar si estos factores abióticos disminuyen o aumentan los efectos tóxicos de los químicos en los organismos
Palabras clave: Estrés, concepto de nicho ecológico, multiestrés, interacciones químico-abióticas
Introducción: estrés relacionado con el concepto de nicho ecológico
El concepto de estrés puede definirse en diversos niveles de organización biológica, desde la bioquímica hasta la aptitud de las especies, conduciendo finalmente a cambios en la estructura comunitaria y el funcionamiento de los ecosistemas. Sin embargo, el estrés se estudia con mayor frecuencia en el contexto de organismos individuales. El concepto de estrés no es absoluto y sólo puede definirse con referencia al rango normal de funcionamiento ecológico. Este es el caso cuando los organismos se encuentran dentro de su rango de tolerancia (la llamada amplitud ecológica) o dentro de su nicho ecológico, lo que describe la coincidencia de una especie con condiciones ambientales específicas. Aplicar este concepto al estrés permite definirlo como una condición evocada en un organismo por uno o más factores ambientales que acercan al organismo o sobre los bordes de su nicho ecológico (Van Straalen, 2003), ver Figura 1.
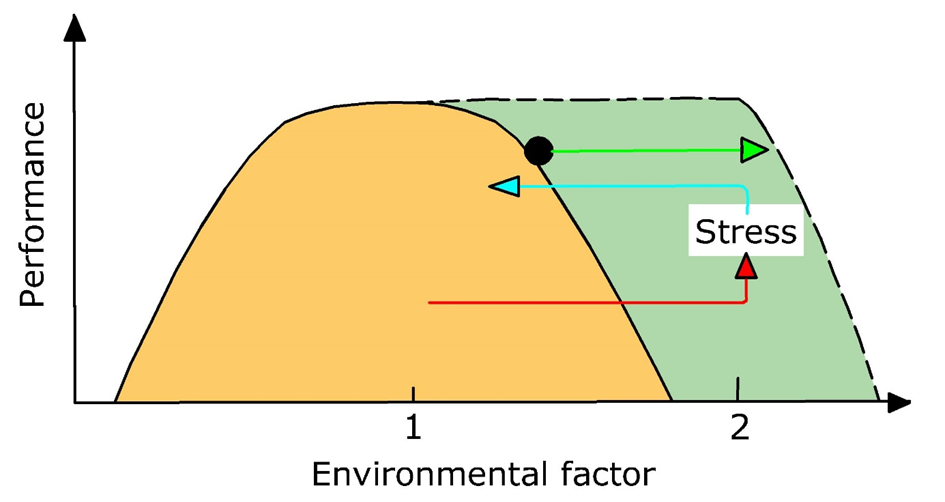
El multiestrés se define posteriormente como una situación en la que un organismo está expuesto tanto a un tóxico como a condiciones ambientales estresantes (ver sección Multiestrés - Introducción y definiciones). Esto incluye interacciones químico-abióticas, interacciones químico-bióticas (ver sección Interacciones multiestrés - químicas - bióticas) así como combinaciones de estas. En general, los organismos que viven en condiciones cercanas a sus límites de tolerancia ambiental parecen ser más vulnerables al estrés químico adicional. Lo contrario también sostiene: si los organismos están estresados debido a la exposición a niveles elevados de contaminantes, se reduce su capacidad para hacer frente a condiciones ambientales subóptimas.
Interacciones químico-abióticas
Temperatura. Uno de los factores ambientales predominantes que alteran los efectos tóxicos obviamente es la temperatura. Para los organismos poiquilotérmicos (de sangre fría), los aumentos de temperatura conducen a un aumento de la actividad, lo que puede afectar tanto la absorción como los efectos de los químicos. En una revisión de Heugens et al. (2001), se discutieron estudios que reportan el efecto químico sobre organismos acuáticos en combinación con factores abióticos como temperatura, estado nutricional y salinidad. Generalmente, los efectos tóxicos aumentaron con el aumento de la temperatura. Dependiendo del parámetro de efecto estudiado, las diferencias en los efectos tóxicos entre las temperaturas de laboratorio y de campo relevantes variaron de un factor de 2 a 130.
También las temperaturas de congelación pueden interferir con los efectos químicos como se demostró en otra revisión influyente de Holmstrup et al. (2010). Se menciona el daño de la membrana como explicación de la interacción sinérgica entre combinaciones de metales y temperaturas bajo cero.
Comida. La disponibilidad de alimentos puede tener un fuerte efecto sobre la sensibilidad de los organismos a los productos químicos (ver sección Interacciones multiestrés - químicas - bióticas). En general, la disminución de los niveles de alimentos o nutrientes incrementó la toxicidad, resultando en diferencias en la toxicidad entre las situaciones de laboratorio y de campo relevantes que van desde un factor de 1.2 a 10 (Heugens et al., 2001). Sin embargo, también se han reportado diferencias mucho mayores en los efectos tóxicos relacionados con los niveles de alimentos: Los experimentos realizados con dafnidos en jaulas que se colocaron en zanjas de mesocosmos al aire libre (ver secciones en estudios de Cosm y bioensayos in situ) mostraron diferencias asombrosas en la sensibilidad a el insecticida tiacloprid. En condiciones de concentraciones de nutrientes bajas a ambientales, la toxicidad observada, expresada como la concentración de efecto menor observada (LOEC) para el crecimiento y la reproducción, ocurrió a concentraciones de tiacloprid que fueron 2500 veces menores que los valores de LOEC derivados de laboratorio. Contrariamente al tratamiento de bajo nutrimento, dicha toxicidad alterada a menudo no se observó en condiciones enriquecidas con nutrientes (Barmentlo et al presentaron). La diferencia fue probablemente atribuible al aumento de la producción primaria que permitió la alimentación compensatoria y quizás también redujo la biodisponibilidad del insecticida. Se observaron resultados similares para criterios de valoración subletales medidos en la especie de mosca damisela Ischnura elegans, para lo cual la respuesta a la exposición a tiacloprid dependió fuertemente de la disponibilidad y calidad de los alimentos. Las damselfies que se alimentaban de recursos naturales fueron significativamente más afectadas que las que se ofrecieron alimentos artificiales de alta calidad (Barmentlo et al., presentaron).
Salinidad. La influencia de la salinidad sobre la toxicidad es menos clara (Heugens et al. 2001). Si la salinidad empuja al organismo hacia sus límites de nicho, empeorará los efectos tóxicos que está experimentando. En caso de que una salinidad específica encaje en el nicho ecológico del organismo, los procesos que afectan la exposición determinarán predominantemente el estrés que experimentará. Esto, por ejemplo, significa que la toxicidad del metal disminuye con el aumento de la salinidad, ya que se ve fuertemente afectada por la competencia de los iones (ver sección Especiación de metales). Sin embargo, el efecto tóxico inducido por los insecticidas organofosforados aumenta con el aumento de la salinidad. Para otros químicos, no se observó una relación clara entre toxicidad y salinidad. Un incremento de salinidad de agua dulce a agua marina disminuyó la toxicidad en un factor de 2.1 (Heugens et al. 2001). Sin embargo, como los cambios de salinidad menos extremos son más relevantes en condiciones de campo, el cambio en la toxicidad es probablemente mucho menor.
pH. Muchos organismos tienen un rango específico de especies de niveles de pH en los que funcionan de manera óptima. A valores de pH fuera del rango óptimo, los organismos pueden mostrar una reproducción y crecimiento reducidos, en casos extremos incluso una supervivencia reducida. En algunos casos, los efectos del pH pueden ser indirectos, ya que el pH también puede tener un impacto importante en la exposición de organismos a tóxicos. Este es especialmente el caso de los metales y los químicos ionizables: la especiación de metales, pero también la forma en que los químicos ionizables ocurren en el ambiente y por lo tanto su biodisponibilidad, es altamente dependiente del pH (ver secciones Especiación de metales y Químicos orgánicos ionogénicos). Un ejemplo de la interacción entre pH y efectos metálicos fue mostrado por Crommentuijn et al. (1997), quienes observaron una reproducción testigo reducida del colgajo de resorte Folsomia candida, pero también la menor toxicidad de cadmio a un suelo pH KCl 7.0 en comparación con pH KCl 3.1-5.7.
Sequía. En el suelo, el contenido de humedad (ver sección Suelo) es un factor importante, ya que la sequía suele limitar la idoneidad del suelo como hábitat para los organismos. Holmstrup et al. (2010), revisando la literatura, concluyeron que los químicos que interfieren con la tolerancia a la sequía de los organismos del suelo, por ejemplo, al afectar el funcionamiento de las membranas o la acumulación de azúcares, pueden exacerbar los efectos de la sequía. Las lombrices de tierra respiran a través de la piel y solo pueden sobrevivir en suelos húmedos, y los huevos de colémbolos solo pueden sobrevivir a una humedad relativa del aire cercana al 100%. Esto hace que estos organismos sean especialmente sensibles a la sequía, la cual puede ser potenciada por la exposición a productos químicos como metales, hidrocarburos aromáticos policíclicos o tensioactivos (Holmstrup et al., 2010).
Muchas condiciones abióticas diferentes, como los niveles de oxígeno, la luz, la turbidez y el contenido de materia orgánica, pueden empujar a los organismos hacia los límites de su nicho, pero no discutiremos todos los factores estresantes en este libro.
Multiestrés en la evaluación de riesgos ambientales
En la evaluación del riesgo ambiental, se toman en cuenta las diferencias entre los efectos inducidos por estrés determinados en el laboratorio en condiciones óptimas estandarizadas con un solo tóxico y los efectos inducidos por múltiples factores estresantes mediante la aplicación de un factor de incertidumbre. Sin embargo, la elección de los factores de incertidumbre se basa en poca evidencia ecológica. En 2001, Heugens ya argumentó a favor de obtener factores de incertidumbre que protejan suficientemente los sistemas naturales sin ser sobreprotectores. Van Straalen (2003) se hizo eco de esto y en la investigación actual todavía se plantea la cuestión de si se ha adquirido suficiente comprensión para hacer extrapolaciones precisas de laboratorio a campo. Sigue siendo un desafío predecir los efectos inducidos por tóxicos en las especies e incluso en las comunidades, teniendo en cuenta las condiciones ambientales variables y subóptimas, a pesar de que estas condiciones son aspectos comunes de los ecosistemas naturales (ver por ejemplo la sección de Ecoepidemiología).
Referencias
Barmentlo, S.H., Vriend, L.M, van Grunsven, R.H.A., Vijver, M.G. (presentada). Evidencia de que los neonicotinoides contribuyen al descenso de la mosca damisela.
Crommentuijn, T., Doornekamp, A., Van Gestel, C.A.M. (1997). Biodisponibilidad y efectos ecológicos del cadmio sobre Folsomia candida (Willem) en un sustrato de suelo artificial influenciado por el pH y la materia orgánica. Ecología Aplicada de Suelos 5, 261-271.
Heugens, E.H., Hendriks, A.J., Dekker, T., Van Straalen, N.M., Admiraal, W. (2001). Revisión de los efectos de múltiples factores estresantes sobre organismos acuáticos y análisis de factores de incertidumbre para su uso en la evaluación de riesgos. Críticas Críticas en Toxicología 31, 247-84.
Holmstrup, M., Bindesbøl, A.M., Oostingh, G.J., Duschl, A., Scheil, V., Köhler, H.R., Loureiro, S., Soares, A.M.V.M., Ferreira, A.L.G., Kienle, C., Gerhardt, A., Laskowski, R., Kramarz, P.E., Bayley, M., Svendsen, C., Spurgeon, D.J. (2010). Revisión Interacciones entre los efectos de los químicos ambientales y los estresores naturales: Una revisión. Ciencia del Medio Ambiente Total 408, 3746-3762.
Van Straalen, N.M. (2003). La ecotoxicología se convierte en ecología del estrés Ciencia y Tecnología Ambiental 37, 324A-330A.
1. Describir la definición de estrés basada en nichos usando la Figura 1.
a. Explicar qué le sucede a una especie cuando tiene que lidiar con un estrés temporal
b. Explicar qué le sucede a una especie si el estrés es a largo plazo y la especie es capaz de adaptarse a él
Mencionar diferentes factores abióticos e indicar cómo pueden afectar la sensibilidad de los organismos a los químicos.
4.4.5. Toxicidad crónica - Eco
Autor: Michiel Kraak
Revisores: Kees van Gestel y Lieven Bervoets
Objetivos de aprendizaje:
Deberías ser capaz de
- explicar los conceptos involucrados en las pruebas de toxicidad crónica, incluyendo la Relación Aguda a Crónica (ACR).
- diseñar experimentos de toxicidad crónica y resolver los desafíos involucrados en las pruebas de toxicidad crónica.
- interpretar los resultados de experimentos de toxicidad crónica y mencionar los tipos de efectos de tóxicos que no pueden determinarse en experimentos de toxicidad aguda.
Palabras clave: Toxicidad crónica, criterios de valoración subletales crónicos, relación aguda/crónica, modo de acción.
Introducción
La mayoría de las pruebas de toxicidad realizadas son experimentos a corto plazo de dosis altas, pruebas agudas en las que la mortalidad suele ser el único punto final Esto contrasta con la situación del campo, donde los organismos a menudo están expuestos a niveles relativamente bajos de contaminantes durante toda su vida útil. Cuanto más corto es el ciclo de vida del organismo, más realista se vuelve este escenario. De ahí que exista una necesidad urgente de realizar pruebas de toxicidad crónica. Sin embargo, debe darse cuenta de que los términos agudo y crónico tienen que ser considerados en relación con la duración del ciclo de vida del organismo. Una exposición a corto plazo de cuatro días es aguda para los peces, pero crónica para las algas, comprendiendo ya cuatro generaciones.
De las pruebas de toxicidad aguda a crónica
La razón del sesgo hacia las pruebas de toxicidad aguda es obviamente los mayores costos involucrados en las pruebas de toxicidad crónica, simplemente causados por la duración mucho más larga de la prueba. Sin embargo, las pruebas de toxicidad crónica también son desafiantes por varias otras razones. En primer lugar, durante la exposición prolongada se tiene que alimentar a los organismos. Aunque inevitable, especialmente en las pruebas de toxicidad acuática, esto definitivamente influirá en la partición y la biodisponibilidad del compuesto de prueba. Especialmente los compuestos lipófilos se unirán fuertemente a los alimentos, lo que hace que la absorción de tóxicos a través de los alimentos sea más importante que para los compuestos hidrofílicos, causando cambios específicos de compuestos en las vías de exposición. Para las pruebas de toxicidad acuática crónica, especialmente para las pruebas de sedimentos, puede ser difícil mantener concentraciones de oxígeno suficientemente altas a lo largo de todo el experimento (Figura 1).

Las elecciones obvias a tomar incluyen la duración de la exposición y los puntos finales de la prueba. Generalmente está dirigido a incluir al menos un evento reproductivo o la finalización de todo un ciclo de vida del organismo dentro de la duración de la prueba. Para garantizar esto, se establecen criterios de validez a los diferentes lineamientos de prueba, tales como:
- el número medio de crías vivas producidas por daphnid parental testigo que sobreviva hasta el final de la prueba debe ser superior a 60 (OCDE, 2012).
- El 85% de los mosquitos quironómidos control adultos del tratamiento testigo deben emerger entre 12 y 23 días después del inicio del experimento (OECD, 2010).
- el número medio de juveniles producidos por 10 colémbolos testigo debe ser de al menos 100 (OCDE, 2016a).
Toxicidad crónica
Generalmente la toxicidad aumenta al aumentar el tiempo de exposición, a menudo expresada como la relación aguda-crónica (ACR), la cual se define como la LC 50 de una prueba aguda dividida por la puerta NOEC de EC 10 de la prueba crónica. Alternativamente, como se muestra en la Figura 2, la LC aguda 50 puede dividirse por la LC crónica 50. Si los compuestos exhiben un fuerte efecto letal directo, el ACR será bajo, pero para los compuestos que poco a poco construyen cargas corporales letales (ver sección Concentraciones corporales críticas) puede ser muy alta. De ahí que exista una relación entre el modo de acción de un compuesto y el ACR. Sin embargo, si la toxicidad crónica tiene que extrapolarse a partir de los datos de toxicidad aguda y se desconoce el modo de acción del compuesto, generalmente se considera una ACR de 10. Sin embargo, debe darse cuenta de que este número se elige de manera bastante arbitraria, lo que potencialmente conduce a una subestimación así como a una sobreestimación de la ACR real.
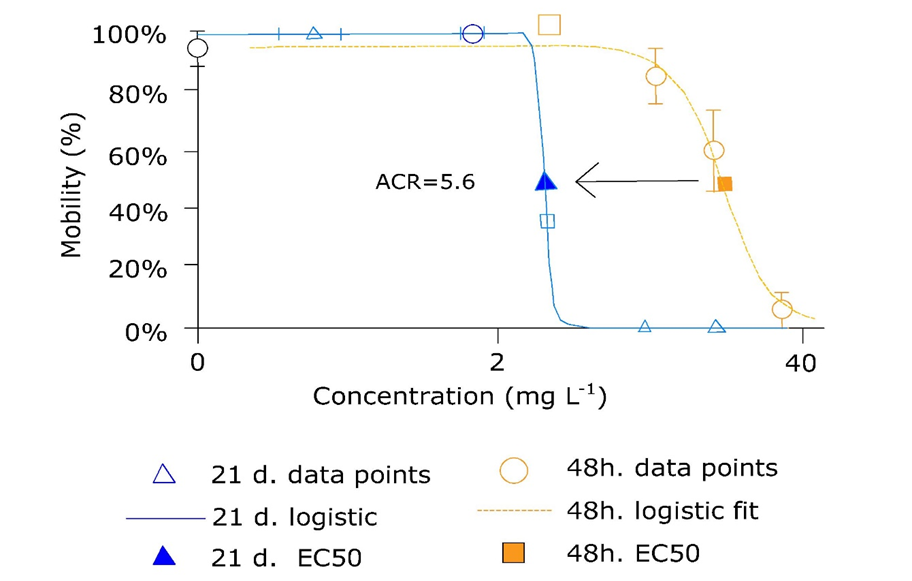
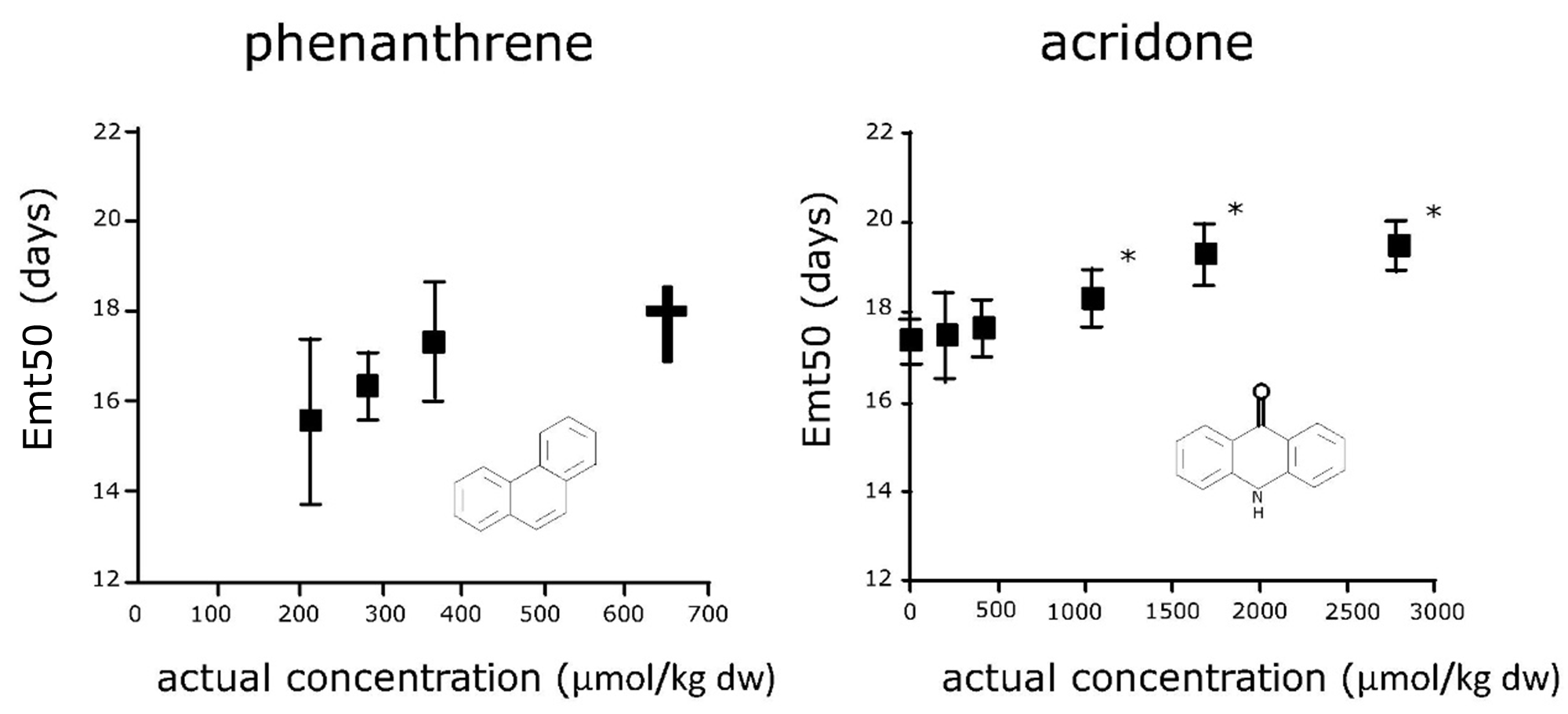
Dado que los eventos reproductivos y la finalización de los ciclos de vida están involucrados, las pruebas de toxicidad crónica permiten evaluar una serie de criterios de valoración subletales, incluyendo crecimiento y reproducción, así como criterios de valoración específicos de especies como la emergencia (tiempo) de quironómidos. En consecuencia, los compuestos con diferentes modos de acción pueden causar efectos subletales muy diversos en los organismos de prueba durante la exposición crónica (Figura 3). El compuesto aromático policíclico (PAC) fenantreno no afectó la finalización del ciclo de vida de los jejenes, pero por encima de una cierta concentración de exposición las larvas murieron y no se observó ninguna emergencia, sugiriendo un modo de acción inespecífico (narcosis). En contraste, la acridona PAC no causó mortalidad pero retrasó significativamente la emergencia del adulto en un amplio rango de concentraciones de prueba, sugiriendo un modo de acción específico que afectó los parámetros del ciclo de vida de los jejenes (Leon Paumen et al., 2008). Esto demuestra claramente que los efectos específicos sobre los parámetros del ciclo de vida de compuestos con diferentes modos de acción necesitan tiempo para expresarse.
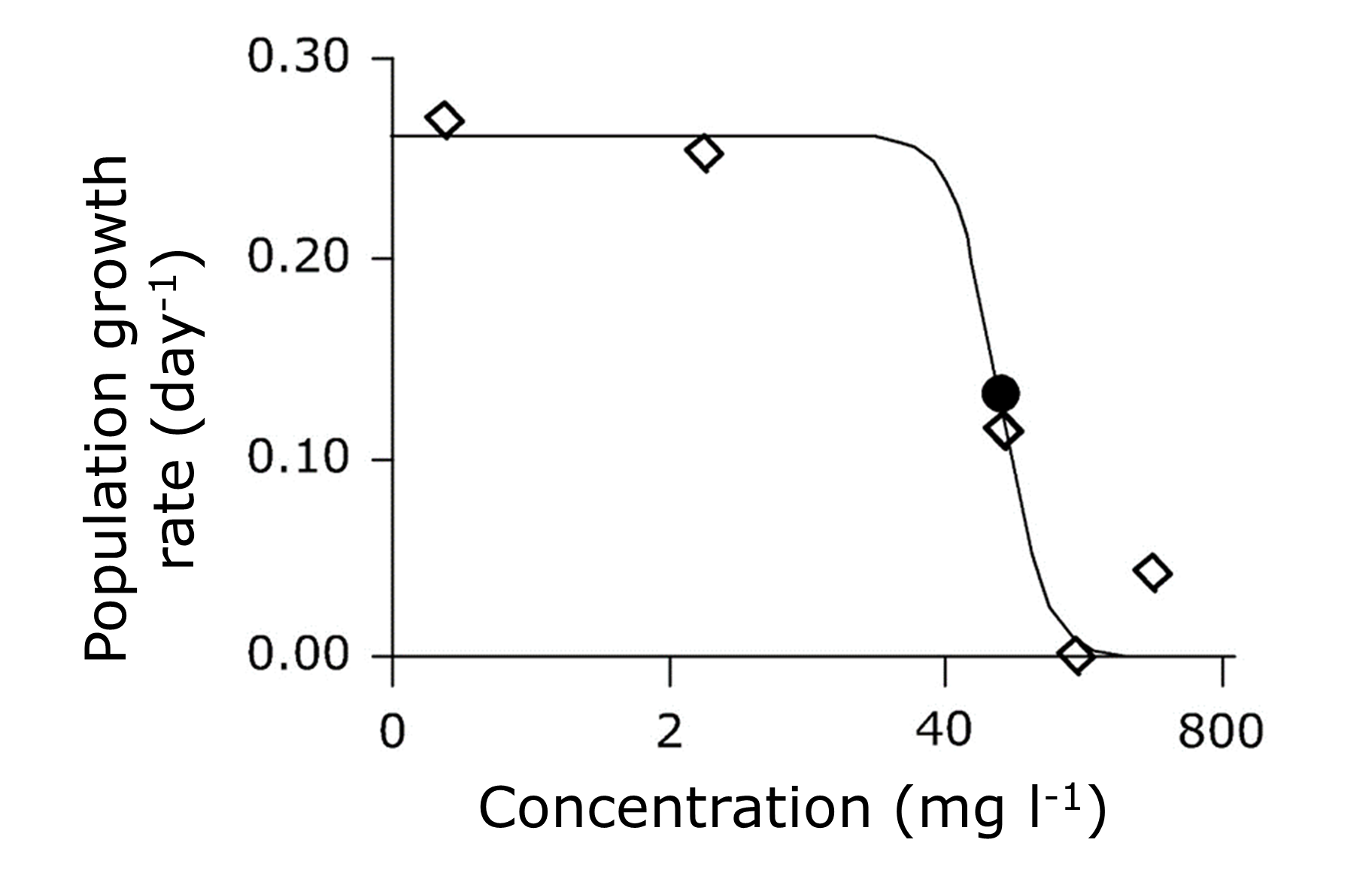
Las pruebas de toxicidad crónica son pruebas de una sola especie, pero si se evalúan los efectos de los tóxicos en todos los parámetros relevantes del ciclo de vida, estos pueden integrarse en los efectos sobre la tasa de crecimiento poblacional (r). Para la prueba de dafnidos de 21 días esto se logra mediante la integración de datos específicos por edad sobre la probabilidad de supervivencia y fecundidad. Las tasas de crecimiento poblacional calculadas a partir de los datos de toxicidad crónica obviamente no están relacionadas con las tasas de crecimiento poblacional natural en campo, pero sí permiten construir relaciones dosis-respuesta para los efectos de los tóxicos en r, el punto final final en las pruebas de toxicidad crónica (Figura 4; Waaijers et al., 2013).
Pruebas de toxicidad crónica en la práctica
Existen varios protocolos para pruebas estandarizadas de toxicidad crónica, aunque son menos numerosos que para las pruebas de toxicidad aguda. Para el agua, la prueba más común es la prueba de reproducción de Daphnia de 21 días (OECD, 2012), para sedimentos se encuentran disponibles pautas de prueba de 28 días para el mosquito Chironomus riparius (OECD, 2010) y para el gusano Lumbriculus variegatus (OECD, 2007). Para el suelo terrestre, el coléculo Folsomia candida (OECD, 2016a) y la lombriz Eisenia fetida (OCDE, 2016b) son las especies de prueba más comunes, pero también para los enquitraeidos se dispone de una guía de prueba de toxicidad para la reproducción (OCDE, 2016c). Para una descripción completa, consulte (https://www.oecd-ilibrary.org/environment/oecd-guidelines-for-the-testing-of-chemicals-section-2-effects-on-biotic-systems_20745761/datedesc#collectionsort).
Referencias
Leon Paumen, M., Borgman, E., Kraak, M.H.S., Van Gestel, C.A.M., Admiraal, W. (2008). Respuestas del ciclo de vida del jirón Chironomus riparius a la exposición a compuestos aromáticos policíclicos. Contaminación Ambiental 152, 225-232.
OECD (2007). Guía de la OCDE para Pruebas de Productos Químicos. Ensayo No. 225: Ensayo de Toxicidad de Sedimento-Agua Lumbriculus Usando Sedimento Apuntado Sección 2: Efectos en los Sistemas Bióticos; Organización para la Cooperación y el Desarrollo Económicos: París, 2007.
OECD (2010). Guía de la OCDE para Pruebas de Productos Químicos. Prueba No. 233: Prueba de Toxicidad del Ciclo de Vida del Chironómido de Sedimento-Agua Usando Agua con Apuntes o Sedimento Sección 2: Efectos en los Sistemas Bióticos; Organización para la Cooperación y el Desarrollo Económicos: París, 2010.
OECD (2012). Guía de la OCDE para Pruebas de Productos Químicos. Prueba No. 211. Prueba de Reproducción de Daphnia magna No. 211. Sección 2: Efectos en los Sistemas Bióticos; Organización para la Cooperación y el Desarrollo Económicos: París, 2012.
OCDE (2016a). Guía de la OCDE para Pruebas de Productos Químicos. Prueba No. 232. Prueba de Reproducción Colembolana en Suelo. Sección 2: Efectos en los sistemas bióticos; Organización para la Cooperación y el Desarrollo Económicos: París, 2016.
OCDE (2016b). Guía de la OCDE para Pruebas de Productos Químicos. Prueba No. 222. Prueba de reproducción de lombrices de tierra (Eisenia fetida/Eisenia andrei). Sección 2: Efectos en los sistemas bióticos; Organización para la Cooperación y el Desarrollo Económicos: París, 2016.
OCDE (2016c). Guía de la OCDE para Pruebas de Productos Químicos. Prueba No. 220: Prueba de Reproducción de Enquitraeides. Sección 2: Efectos en los sistemas bióticos; Organización para la Cooperación y el Desarrollo Económicos: París, 2016.
Waaijers, S.L., Blyenberg, T.E., Dits, A., Schoorl, M., Schütt, J., Kools, S.A.E., De Voogt, P., Admiraal, W., Parsons, J.R., Kraak, M.H.S. (2013). Respuestas del ciclo de vida de Daphnid a retardantes de llama de nueva generación. Ciencia y Tecnología Ambiental 47, 13798-13803.
En las pruebas de toxicidad aguda la LC50 se deriva después de un corto tiempo de exposición. Mencionar dos resultados de pruebas de toxicidad crónica que no se pueden determinar en las pruebas de toxicidad aguda.
¿Para qué modo de acción tóxica de los compuestos espera bajas relaciones agudas a crónicas (ACR) y para qué modo de acción química espera que el ACR sea alto?
4.4.6. Pruebas de toxicidad multigeneracional - Eco
Autor: Michiel Kraak
Revisores: Kees van Gestel, Miriam Leon Paumen
Objetivos de aprendizaje:
Deberías ser capaz de
· explicar cómo los efectos de los tóxicos pueden propagarse durante la exposición multigeneracional.
· describir los desafíos experimentales y las limitaciones de las pruebas de toxicidad multigeneracionales y poder diseñar pruebas multigeneracionales.
· explicar las implicaciones de las pruebas multigeneracionales para la evaluación de riesgos ecológicos.
Palabras clave: Exposición multigeneracional, extinción, adaptación, diseño de pruebas
Introducción
Generalmente se asume que las pruebas de toxicidad crónica del ciclo de vida son indicativas del riesgo real de que las poblaciones sufran de exposición a largo plazo. Sin embargo, en sitios contaminados, los organismos pueden estar expuestos durante múltiples generaciones y cuanto más corto sea el ciclo de vida del organismo, más realista se vuelve este escenario. Sin embargo, solo se realizan pocos estudios multigeneracionales, debido a las obvias limitaciones de tiempo y costo. Dado que las pruebas de toxicidad del ciclo de vida tanto acuáticas como terrestres suelen durar 28 días (ver sección Toxicidad crónica), las pruebas multigeneracionales tomarán aproximadamente un mes por generación. Además, el compuesto de prueba a menudo afecta el ciclo de vida de las especies de prueba de una manera dependiente de la dosis. En consecuencia, la población testigo, por ejemplo, ya podría estar en la generación 9, mientras que una población expuesta podría estar aún en la generación 8 debido al retraso relacionado con la exposición química en el crecimiento y/o desarrollo. Además de estos desafíos experimentales, los experimentos multigeneracionales son extremadamente propensos a errores, simplemente porque la probabilidad de que un experimento falle aumenta al aumentar el tiempo de exposición.
Consideraciones experimentales
Diseñar un experimento de toxicidad multigeneracional es un desafío. En primer lugar, está la elección de cuántas generaciones debe durar el experimento, que con mayor frecuencia, pero completamente arbitrariamente, se establece en aproximadamente 10. También deben elegirse las concentraciones de prueba, principalmente basadas en los valores EC 50 y EC 10 del ciclo de vida crónico (Leon Paumen et al. 2008). Sin embargo, no se puede anticipar si, y en qué medida, la toxicidad aumenta (o disminuye) durante la exposición multigeneracional. De ahí que probar solo una o dos concentraciones de exposición aumenta el riesgo de que los efectos observados no estén relacionados con la dosis, sino que se deban simplemente a la estocástica. Si las concentraciones de prueba elegidas son demasiado altas, muchos tratamientos pueden extinguirse después de pocas generaciones. En contraste, concentraciones de prueba demasiado bajas pueden no mostrar ningún efecto en absoluto. Este último fue observado por Marinkovic al. (2012), quienes tuvieron que aumentar las concentraciones de exposición durante el experimento (ver Figura en resumen gráfico de Marinkovic et al., 2012). Finalmente, dado que un único tratamiento experimental a menudo consiste en una población completa, la replicación del tratamiento también es un desafío.
Una vez que se ejecuta el experimento, hay que tomar decisiones sobre la transición de generación en generación. Si una réplica se mantiene en un solo frasco, recipiente o acuario, las generaciones pueden superponerse y las concentraciones de exposición pueden disminuir con el tiempo. Por lo tanto, la mayoría de las veces se inicia una nueva generación exponiendo crías de la generación parental expuesta anterior en una unidad experimental recién enriquecida.
Si el objetivo es determinar cómo se recupera una población cuando la concentración del tóxico disminuye con el tiempo, la exposición a un solo medio de adición también es una opción, lo que parece más aplicable a los suelos (Ernst et al., 2016; van Gestel et al., 2017). Para evaluar la recuperación después de varias generaciones de exposición (continua) a medios contaminados, las crías de generaciones anteriores expuestas pueden mantenerse bajo condiciones de control.
Se puede seleccionar una amplia variedad de criterios finales en experimentos multigeneracionales. En el caso de insectos acuáticos como el mosquitos no mordedor Chironomus riparius estos incluyen supervivencia, tiempo de desarrollo larval, emergencia, tiempo de emergencia, vida adulta y reproducción. Para los invertebrados terrestres se puede seleccionar la supervivencia, el crecimiento y la reproducción. Sólo un número muy limitado de estudios evaluaron criterios de valoración poblacionales reales como la tasa de crecimiento poblacional (Postma y Davids, 1995).
Persistir o perecer
Si los organismos están expuestos por múltiples generaciones los efectos tienden a empeorar, llevando finalmente a la extinción, primero de la población expuesta a la mayor concentración, seguido de poblaciones expuestas a concentraciones menores en generaciones posteriores (Leon Paumen et al. 2008). Sin embargo, no se puede excluir que la extinción se produzca debido a los tamaños de población relativamente pequeños en experimentos multigeneracionales, mientras que poblaciones más grandes pueden pasar un cuello de botella y recuperarse durante generaciones posteriores.
También se han reportado umbrales, como se muestra en la Figura 1 (Leon Paumen et al. 2008). Por debajo de ciertas concentraciones de exposición, las poblaciones expuestas funcionan igual de bien que los controles, generación tras generación. De ahí que estas concentraciones puedan considerarse como la 'concentración infinita sin efecto'. Una explicación mecanicista puede ser que la maquinaria metabólica del organismo es capaz de desintoxicar o excretar los tóxicos y que esto toma tan poca energía que no hay compensación alguna en cuanto al crecimiento y reproducción.
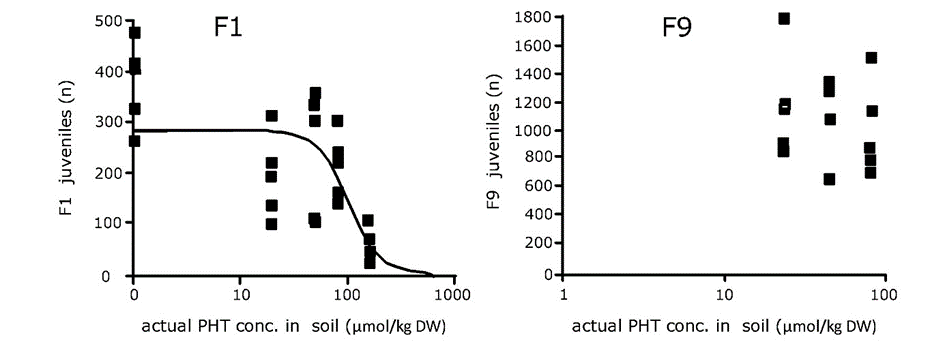
Se concluye que el empeoramiento de efectos frecuentemente reportado durante la exposición multigeneracional a tóxicos plantea preocupaciones sobre el uso de estudios de una sola generación en la evaluación de riesgos para abordar los efectos poblacionales a largo plazo de los tóxicos ambientales.
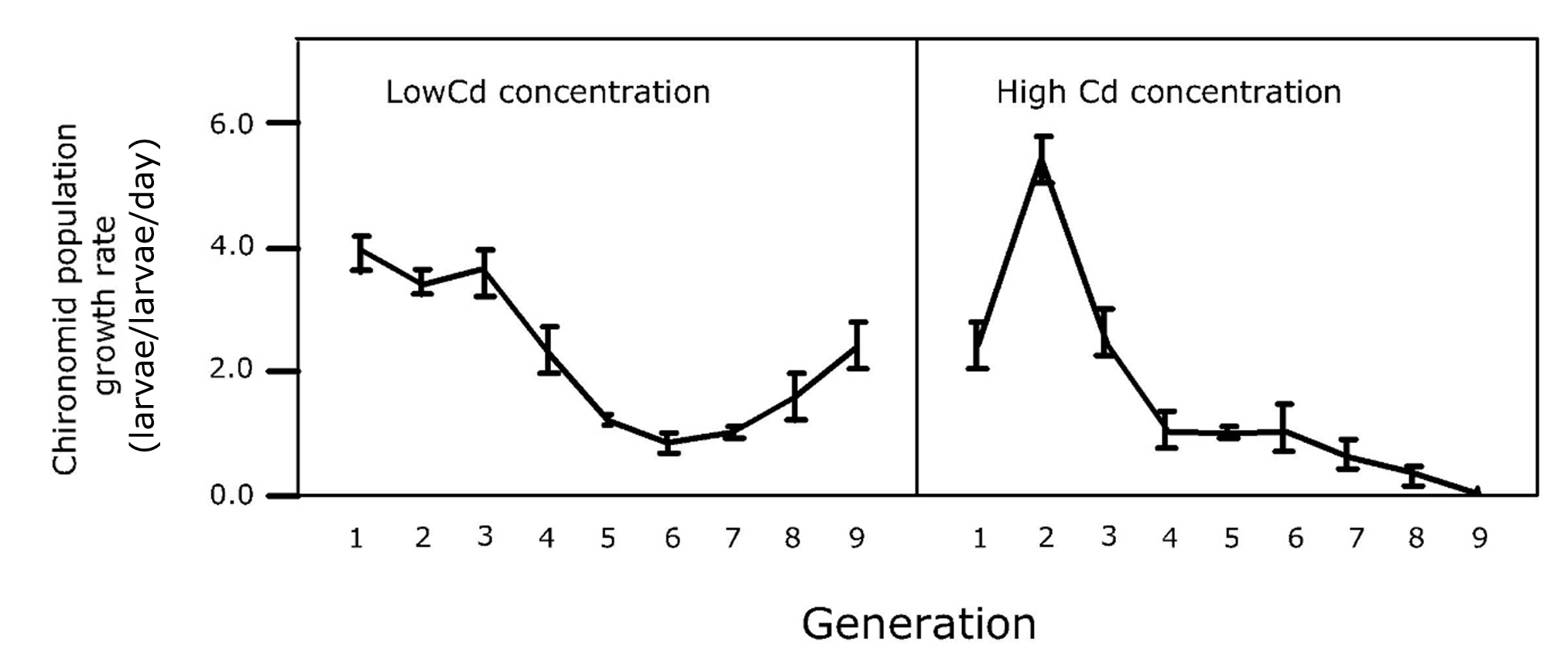
Si las poblaciones expuestas por múltiples generaciones no se extinguen y persisten, es posible que hayan desarrollado resistencia o adaptación (Figura 2). Por lo tanto, se pueden incluir pruebas de sensibilidad regulares en experimentos multigeneracionales, como se representa en la Figura 1. Sin embargo, aún se está debatiendo si esta menor sensibilidad se debe a la adaptación genética, epigenética o plasticidad fenotípica (Marinkovic et al., 2012).
Referencias
Ernst, G., Kabouw, P., Barth, M., Marx, M.T., Frommholz, U., Royer, S., Friedrich, S. (2016). Evaluar el potencial de recuperación intrínseca en un estudio de dos generaciones Collembola: posible implementación en un enfoque escalonado de evaluación del riesgo del suelo para productos fitosanitarios. Ecotoxicología 25, 1-14.
Leon Paumen, M., Steenbergen, E., Kraak, M.H.S., Van Straalen, N. M., Van Gestel, C.A.M. (2008). Exposición multigeneracional de folsomia candida colégora a fenantreno: de relaciones dosis-respuesta a concentraciones umbrales. Ciencia y Tecnología Ambiental 42, 6985-6990.
Marinkovic, M., De Bruijn, K., Asselman, M., Bogaert, M., Jonker, M.J., Kraak, M.H.S., Admiraal, W. (2012). Respuesta del jirón no mordedor Chironomus riparius a la exposición multigeneracional a tóxicos. Ciencia y Tecnología Ambiental 46, 12105−12111.
Postma. J.F., Davids, C. (1995). Inducción de tolerancia y cambios en el ciclo de vida en Chironomus riparius expuesto al cadmio (Diptera) durante generaciones consecutivas. Ecotoxicología y Seguridad Ambiental 30, 195-202.
Van Gestel, C.A.M., De Lima e Silva, C., Lam, T., Koekkoek, J.C. Lamoree, M.H., Verwei, R.A. (2017). Toxicidad multigeneracional de imidacloprid y tiacloprid a Folsomia candida. Ecotoxicología 26, 320-328.
¿Cuál es la motivación para realizar experimentos multigeneracionales?
¿Cuáles son los dos resultados alternativos de los experimentos de toxicidad multigeneracional?
¿Cuáles son las implicaciones de las pruebas multigeneracionales para la evaluación de riesgos ecológicos?
4.4.7. Ecotoxicología Tropical
Autores: Michiel Daam, Jörg Römbke
Revisor: Kees van Gestel, Michiel Kraak
Objetivos de aprendizaje:
Deberías ser capaz
· nombrar las características distintivas de los ecosistemas tropicales y templados
· explicar sus implicaciones para la evaluación del riesgo ambiental en estas regiones
· mencionar algunas de las principales necesidades de investigación en ecotoxicología tropical
Palabras clave: Evaluación del riesgo ambiental; plaguicidas; temperatura; destino contaminante; métodos de ensayo
Introducción
Los trópicos cubren el área del mundo (aproximadamente 40%) que se encuentra entre el Trópico de Cáncer, 23½° al norte del ecuador y el Trópico de Capricornio, 23½° al sur del ecuador. Se caracteriza por, en promedio, mayores temperaturas y niveles de luz solar que en las regiones templadas. Con base en patrones de precipitación, se pueden distinguir tres climas tropicales principales: selvas tropicales, monzones y sabanas. Debido a las diferencias intrínsecas entre las regiones tropicales y templadas, también es probable que se produzcan diferencias en los riesgos de los productos químicos. Estas diferencias se ejemplifican brevemente tomando como ejemplo los plaguicidas, abordando los siguientes temas: 1) Factores relacionados con el clima; 2) Sensibilidad de las especies; 3) Métodos de ensayo; 4) Prácticas agrícolas y legislación.
1. Factores relacionados con el clima
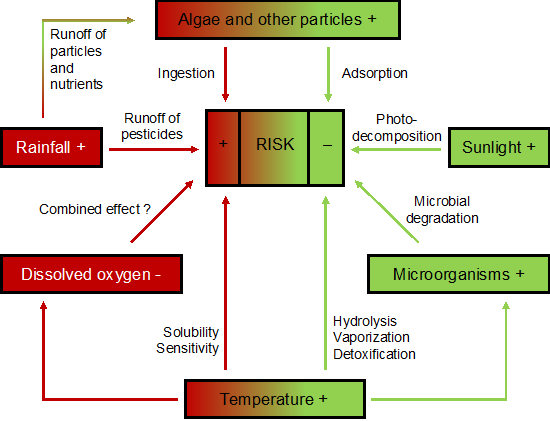
Tres factores climáticos básicos son esenciales para los riesgos de pesticidas al comparar agroecosistemas acuáticos templados y tropicales: lluvia, temperatura y luz solar. Por ejemplo, las altas temperaturas tropicales se han asociado con mayores actividades microbianas y, por lo tanto, una mayor degradación microbiana de pesticidas, resultando en menores niveles de exposición. Por otro lado, la toxicidad de los plaguicidas a la biota acuática puede ser mayor con el aumento de la temperatura. En cuanto a los ecosistemas terrestres, otros factores abióticos importantes a considerar son la humedad del suelo, el pH, el contenido de arcilla y carbono orgánico y la capacidad de intercambio iónico (es decir, la capacidad de un suelo para adsorber ciertos compuestos) (Daam et al., 2019). Aunque se pueden distinguir varias diferencias en los factores climáticos entre áreas tropicales y templadas, estos no conducen a un mayor o menor riesgo consistente de plaguicidas (por ejemplo, Figura 1).
2. Sensibilidades de las especies
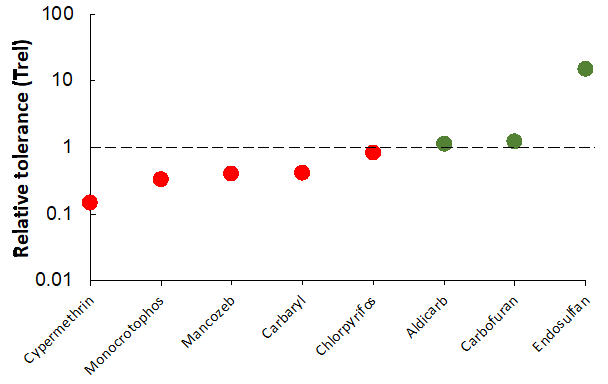
Las áreas tropicales albergan la mayor biodiversidad del mundo y generan casi el 60% de la producción primaria. Esta mayor riqueza de especies, en comparación con sus homólogos templados, dicta que no se puede ignorar la posible ocurrencia de especies más sensibles. Sin embargo, los estudios que compararon la sensibilidad de especies del mismo grupo taxonómico no demostraron una sensibilidad mayor o menor consistente de los organismos tropicales en comparación con los organismos templados (por ejemplo, Figura 2).
3) Métodos de prueba
Dadas las grandes diferencias en las condiciones ambientales entre las regiones tropicales y templadas, el uso de procedimientos de ensayo desarrollados en ambientes templados para evaluar los riesgos de plaguicidas en áreas tropicales a menudo ha sido disputado. Posteriormente, los métodos desarrollados en condiciones templadas necesitan adaptarse a las condiciones ambientales tropicales, por ejemplo, mediante el uso de sustratos de prueba tropicales y mediante pruebas a temperaturas más altas (Niva et al., 2016). Como se discutió anteriormente, no se espera que las especies tropicales y templadas del mismo grupo taxonómico demuestren diferencias consistentes en sensibilidad. Sin embargo, ciertos grupos taxonómicos pueden estar más representados y/o ecológicamente o económicamente más importantes en áreas tropicales, como los camarones de agua dulce (Daam y Rico, 2016) y las termitas (terrestres) (Daam et al., 2019). Posteriormente, el desarrollo de procedimientos de prueba para tales especies y la incorporación en los procedimientos de evaluación de riesgos parece imperativo.
4) Prácticas agrícolas y legislación
Es probable que las prácticas agrícolas en los países tropicales conduzcan a una mayor exposición a pesticidas y, por lo tanto, a mayores riesgos para los ecosistemas acuáticos y terrestres bajo condiciones tropicales. Algunas de las principales razones de esto incluyen i) aplicaciones innecesarias y uso excesivo; ii) uso de pesticidas más baratos pero más peligrosos, y iii) condiciones peligrosas de transporte y almacenamiento, todo ello a menudo resultado de la falta de capacitación de aplicadores de pesticidas en los trópicos (Daam y Van den Brink, 2010; Daam et al. , 2019). Por último, los países de las regiones tropicales generalmente no cuentan con leyes estrictas y regulaciones de evaluación de riesgos con respecto al registro y uso de pesticidas, lo que significa que los pesticidas prohibidos en las regiones templadas por razones ambientales suelen estar disponibles y utilizados en países tropicales como Brasil (e.g. Waichman et al. 2002).
Referencias y lecturas adicionales recomendadas
Daam, M.A., Van den Brink, P.J. (2010). Implicaciones de las diferencias entre ecosistemas de agua dulce templados y tropicales para la evaluación del riesgo ecológico de pesticidas. Ecotoxicología 19, 24-37.
Daam, M.A., Chelinho, S., Niemeyer, J., Owojori, O., de Silva, M., Sousa, J.P., van Gestel, C.A.M., Römbke, J. (2019). Evaluación del riesgo ambiental de plaguicidas en ecosistemas terrestres tropicales: estado actual y perspectivas futuras. Ecotoxicología y Seguridad Ambiental 181, 534-547.
Daam, M.A., Rico, A. (2016). Camarones de agua dulce como especie de prueba sensible para la evaluación de riesgos de plaguicidas en el trópico. Ciencia Ambiental e Investigación en Contaminación 25, 13235-13243.
Niemeyer, J.C., Moreira-Santos, M., Nogueira, M.A., Carvalho, G.M., Ribeiro, R., Da Silva, E.M., Sousa, J.P. (2010). Evaluación del riesgo ambiental de un área contaminada con metales en el Trópico. Nivel I: fase de cribado. Diario de Suelos y Sedimentos 10, 1557-1571.
Niva, C.C., Niemeyer, J.C., Rodrigues da Silva Júnior, F.M., Tenório Nunes, M.E., de Sousa, D.L., Silva Aragão, C.W., Sautter, K.D., Gaeta Espindola, E., Sousa, J.P., Römbke, J. (2016). La ecotoxicología de suelos en Brasil está tomando su curso. Ciencia Ambiental e Investigación en Contaminación 23, 363-378.
Waichman, A.V., Römbke, J., Ribeiro, M.O.A., Nina, N.C.S. (2002). Uso y destino de los plaguicidas en el Estado Amazónico, Brasil. Riesgo para la salud humana y el medio ambiente. Ciencia Ambiental e Investigación en Contaminación 9, 423-428.
¿Cuáles son los factores climáticos más importantes que afectan el destino y los efectos de los químicos al comparar regiones templadas y tropicales?
¿Se puede esperar que los organismos tropicales sean más sensibles a los químicos que los organismos templados? Por favor justifique su respuesta.
¿Deben adaptarse los métodos de prueba ecotoxicológicos para su uso en regiones tropicales? En caso afirmativo, sírvase proporcionar dos ejemplos de adaptaciones que deben hacerse.
Si se permite el uso de un químico en Europa, ¿recomendaría su uso en un país tropical sin pruebas adicionales? Por favor justifique su respuesta.


