4.5: Disponibilidad y biodisponibilidad
- Page ID
- 70475
3.6. Disponibilidad y biodisponibilidad
3.6.1. Definiciones
Autores: Martina Vijver
Crítico: Kees van Gestel, Ravi Naidu
Objetivos de Inclinación:
Deberías ser capaz de:
- entender que la biodisponibilidad consiste en tres procesos principales.
- entender que la biodisponibilidad es un concepto dinámico.
- entender por qué la biodisponibilidad es importante para explicar la absorción y los efectos, esenciales para una adecuada evaluación del riesgo de los químicos.
Palabras clave: Disponibilidad química, captación real y potencial, toxico-cinética, toxicodinámica.
Introducción:
Aunque muchos químicos ambientales, toxicólogos e ingenieros afirman conocer lo que significa biodisponibilidad, el término elude una definición consensuada. La biodisponibilidad puede definirse como aquella fracción de sustancia química presente en el ambiente que está o puede llegar a estar disponible para la absorción biológica mediante el paso a través de las membranas celulares.
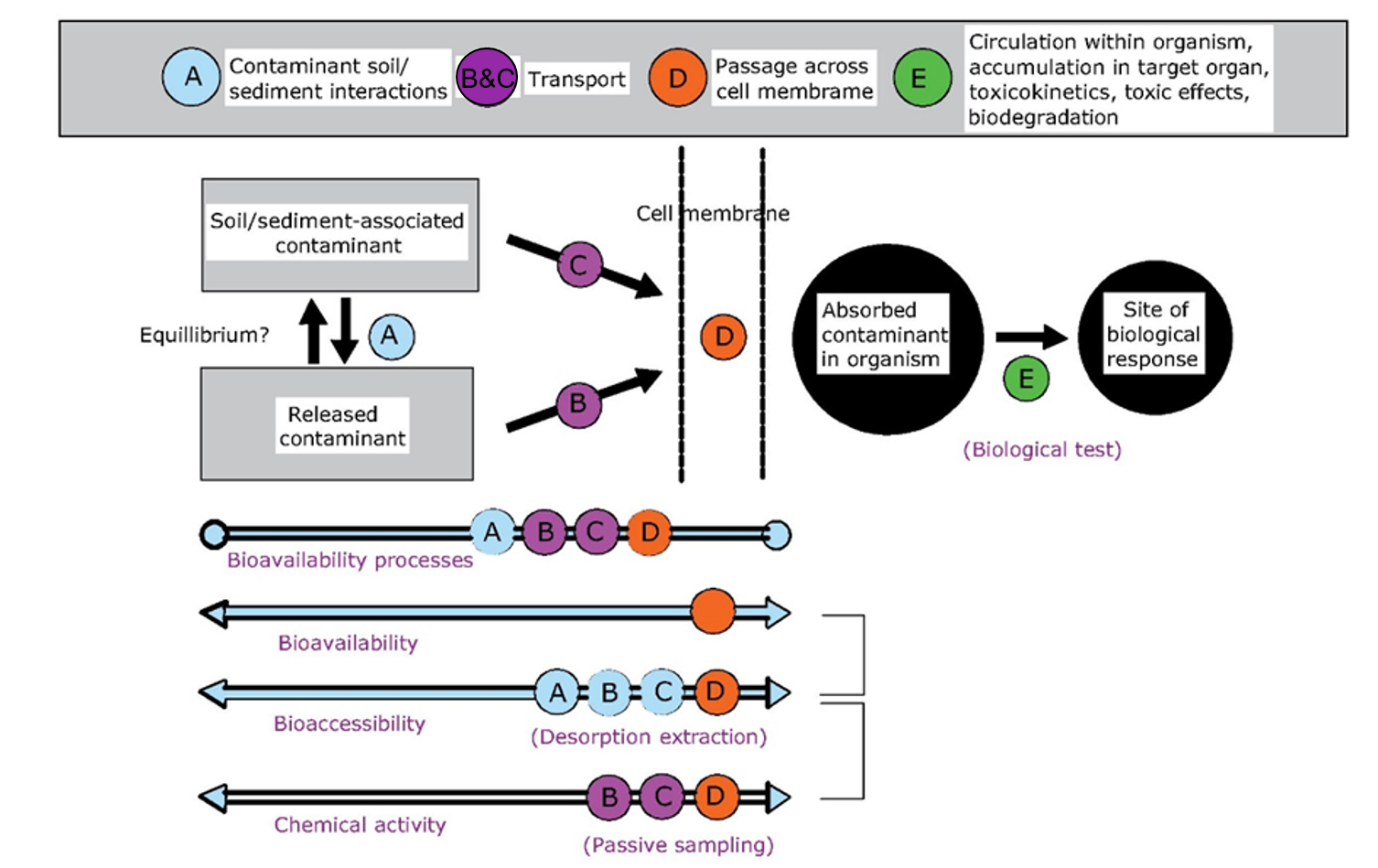
La biodisponibilidad generalmente se aborda desde un punto de vista orientado a procesos dentro de un marco toxicológico, el cual es aplicable a todo tipo de químicos (Figura 1).
El primer proceso es la disponibilidad química que puede definirse como la fracción de la concentración total de sustancias químicas presentes en un compartimento ambiental que contribuye a la exposición de un organismo. La concentración total en un compartimento ambiental no está necesariamente involucrada en la exposición, ya que una fracción menor o mayor del químico puede estar unida a componentes orgánicos o inorgánicos del ambiente. La materia orgánica y las partículas de arcilla, por ejemplo, son importantes en la unión de químicos (ver sección Suelo), mientras que también la presencia de cationes y pH son factores importantes que modifican la partición de los químicos entre diferentes fases ambientales (ver sección Especiación de metales).
El segundo proceso es la captación real o potencial, descrita como la toxicocinética de una sustancia que refleja el desarrollo con el tiempo de su concentración sobre y en el organismo (ver sección Bioconcentración y modelado cinético).
El tercer proceso describe la distribución interna de la sustancia que conduce a su interacción (s) en el sitio celular de activación de la toxicidad. Esto a veces se denomina toxico-disponibilidad y también incluye los procesos bioquímicos y fisiológicos resultantes de los efectos de la sustancia química en el sitio de acción.
Los detalles sobre el concepto de biodisponibilidad descrito anteriormente así como cómo las interacciones físico-químicas que influyen en cada proceso se describen en las secciones Especiación de metales y Bioconcentración y modelado cinético.
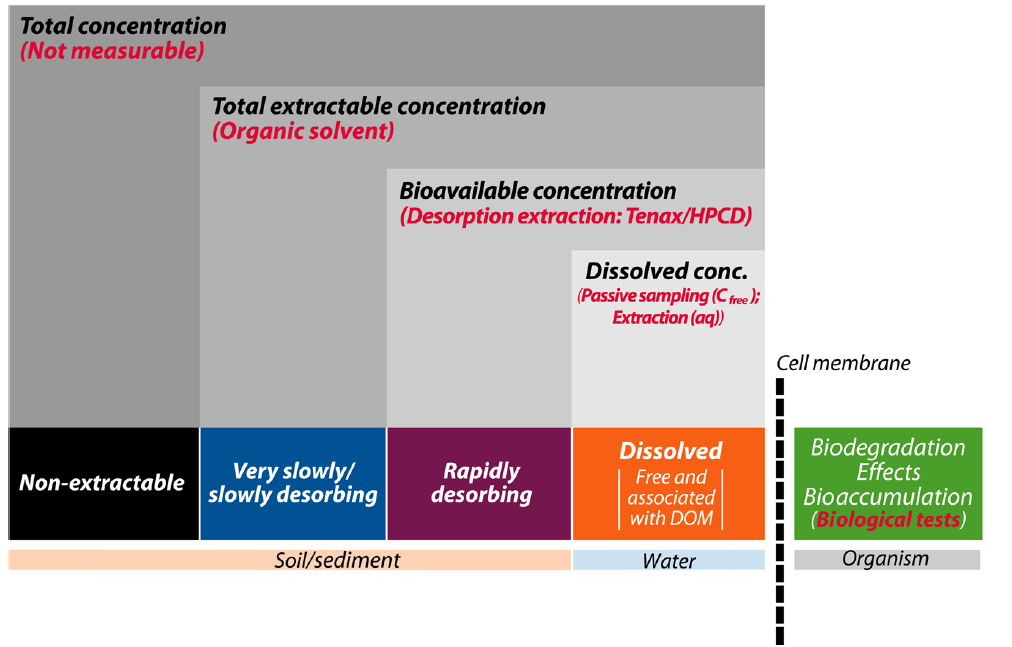
La cinética está involucrada en los tres procesos básicos. El plazo puede variar de muy breve (menos de segundos) a muy largo en el orden de cientos de años. La Figura 2 muestra que algunas fracciones de contaminantes están presentes en el suelo o sedimento, pero tal vez nunca contribuyan al transporte de sustancias químicas que podrían llegar al sitio interno durante la vida útil de un organismo. Las fracciones con diferente cinética de desorción pueden relacionarse con diferentes técnicas experimentales para determinar la métrica de biodisponibilidad relevante.
|
Recuadro 1: Ilustración de cómo la biodisponibilidad influye en nuestra aptitud humana La deficiencia de hierro ocurre cuando un cuerpo no tiene suficiente hierro para suplir sus necesidades. El hierro está presente en todas las células del cuerpo humano y tiene varias funciones vitales. Es un componente clave de la proteína hemoglobina, transportando oxígeno a los tejidos desde los pulmones. El hierro también juega un papel importante en las reacciones de oxidación/reducción, que son cruciales para el funcionamiento de las enzimas del citocromo P450 que son responsables de la biotransformación de productos químicos endógenos y xenobióticos. Por lo tanto, la deficiencia de hierro puede interferir con estas funciones vitales, lo que lleva a una falta de energía (sensación de cansancio) y eventualmente al mal funcionamiento de los músculos y el cerebro. En caso de deficiencia de hierro, el médico le recetará suplementos de Fe y alimentos ricos en hierro como carne roja y verduras de hoja verde como las espinacas. Aunque esto conducirá a una mayor ingesta de hierro (después de todo, la exposición es mayor), no necesariamente conduce a una mayor captación ya que aquí la biodisponibilidad se vuelve importante. Se aconseja evitar tomar leche o bebidas con cafeína junto con comer productos o suplementos ricos en hierro porque ambas bebidas evitarán la absorción de hierro en el tracto intestinal. Los iones calcio abundantes en la leche competirán con los iones de hierro por los mismos sitios de absorción, por lo que el exceso de calcio reducirá la absorción de hierro Los carbonatos y las moléculas de cafeína, pero también el fitato (polifosfato de inositol) presentes en los vegetales, unirán fuertemente al hierro, reduciendo también su disponibilidad para su absorción. |
Biodisponibilidad utilizada en la Evaluación de Riesgos
Para fines regulatorios, es necesario utilizar un enfoque sencillo para evaluar y priorizar los sitios contaminados en función de su riesgo para la salud humana y ambiental. El concepto de biodisponibilidad ofrece un concepto fundamentado científico para ser utilizado en la evaluación de riesgos. Ejemplos de contaminantes inorgánicos son los modelos derivados de segundo nivel como los Modelos de Ligando Biótico, mientras que para los químicos orgánicos se aplica el concepto de Partición en Equilibrio (E q P) (ver Recuadro 2 en la sección de Sorción).
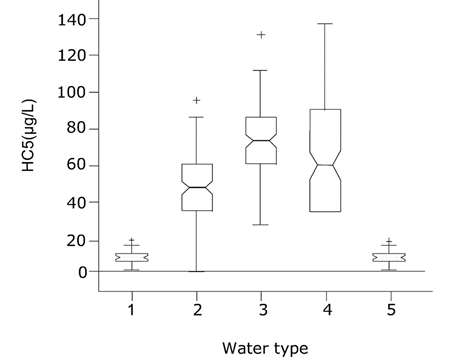
Se da un ejemplo cuantitativo para el cobre en diferentes tipos de agua en la Figura 3 y el Cuadro 1, en los que se contabiliza explícitamente la química del agua para permitir estimar la concentración de cobre disponible. El objetivo actual de calidad genérica holandesa para las aguas superficiales es de 1.5 µg/L de cobre disuelto total. Los límites de riesgo corregidos por biodisponibilidad (HC5) para diferentes tipos de agua, en la mayoría de los casos, superaron esta meta genérica de calidad.
Cuadro 1. Cobre ajustado a la biodisponibilidad 5% Concentración Peligrosa (HC5, potencialmente afectando < 5% de especies relevantes) para diferentes tipos de agua.
|
Descripción del tipo de agua |
No. |
DOC (mg/L) |
pH |
HC5 promedio (µg/L) |
|
Grandes ríos |
1 |
3.1 ± 0.9 |
7.7 ± 0.2 |
9.6 ± 2.9 |
|
Canales, lagos |
2 |
8.4 ± 4.4 |
8.1 ± 0.4 |
35.0 ± 17.9 |
|
Arroyos, arroyos |
3 |
18.2 ± 4.3 |
7.4 ± 0.1 |
73.6 ± 18.9 |
|
Zanjas |
4 |
27.5 ± 12.2 |
6.9 ± 0.8 |
64.1 ± 34.5 |
|
Manantiales arenosos |
5 |
2.2 ± 1.0 |
6.7 ± 0.1 |
7.2 ± 3.1 |
Cuando el valor de HC5 calculado es menor, esto significa que la biodisponibilidad del cobre es mayor y por lo tanto a la misma concentración total de cobre en agua el riesgo es mayor. Los HC5 corregidos por biodisponibilidad para Cu difieren significativamente entre los tipos de agua. Los valores más bajos de HC5 se encontraron para manantiales arenosos (agua tipo V) y ríos grandes (tipo de agua I), los cuales parecen ser cuerpos de agua sensibles. Estas diferencias pueden explicarse a partir de procesos de partición (disponibilidad química) y procesos de competencia (la etapa toxicocinética) en los que se basan los BLM. Los arroyos y arroyos (agua tipo III) tienen concentraciones totales de cobre bastante altas sin ningún efecto adverso, lo que puede atribuirse al efecto protector de concentraciones relativamente altas de carbono orgánico disuelto (DOC) y el pH neutro a básico causando una alta unión de Cu al DOC.
Para los gestores de riesgos, este enfoque de riesgo específico del tipo de agua puede ayudar a identificar la prioridad en las actividades de limpieza entre sitios que tienen concentraciones elevadas de cobre. Sigue siendo posible que, para situaciones ambientales extremas (por ejemplo, sequías extremas y bajas descargas de agua o caída extrema de lluvia y escorrentía alta), las combinaciones de los parámetros químicos del agua puedan dar como resultado valores calculados de HC5 que sean incluso más bajos que los valores promedio calculados. Por esta última razón (importante), el objetivo genérico de calidad es más estricto.
Referencias
Hamelink, J., Landrum, P.F., Bergman, H., Benson, W.H. (1994) Biodisponibilidad: interacciones físicas, químicas y biológicas, CRC Press.
Ortega-Calvo, J.J., Harmsen, J., Parsons, J.R., Semple, K.T., Aitken, M.D., Ajao, C., Eadsforth, C., Galay-Burgos, M., Naidu, R., Oliver, R., Peijnenburg, W.J.G.M., Römbke, J., Streck, G., Versonnen, B. (2015) De la ciencia de la biodisponibilidad a la regulación de los químicos orgánicos. Ciencia y Tecnología Ambiental 49, 10255−10264.
Vijver, M.G., de Koning, A., Peijnenburg, W.J.G.M. (2008) Incertidumbre de concentraciones de cobre peligrosas específicas de tipo de agua derivadas con modelos de ligando biótico. Toxicología y Química Ambiental 27, 2311-2319.
¿Cuáles son los tres procesos que definen la biodisponibilidad?
Explicar cómo cambia la absorción de metales cuando se encuentran altas concentraciones de materia orgánica disuelta en el medio de exposición.
Explicar por qué la biodisponibilidad es un concepto dinámico.
3.6.2. Evaluación de las concentraciones disponibles de productos químicos orgánicos
Autor: Jose Julio Ortega-Calvo
Críticos: John Parsons, Gerard Cornelissen
Objetivos de aprendizaje:
Deberías ser capaz de:
- definir el concepto de concentraciones libremente disueltas y fracciones de rápida desorción de químicos orgánicos en suelo y sedimentos, como indicadores de su biodisponibilidad
- entender cómo determinar las concentraciones biodisponibles con el uso de muestreo pasivo
- entender cómo determinar fracciones de desorción rápida con métodos de extracción por desorción.
Palabras clave: Biodisponibilidad, Concentración libremente disuelta, Desorción, Muestreo pasivo, Fregadero infinito
Introducción: Biodisponibilidad a través de la fase acuosa
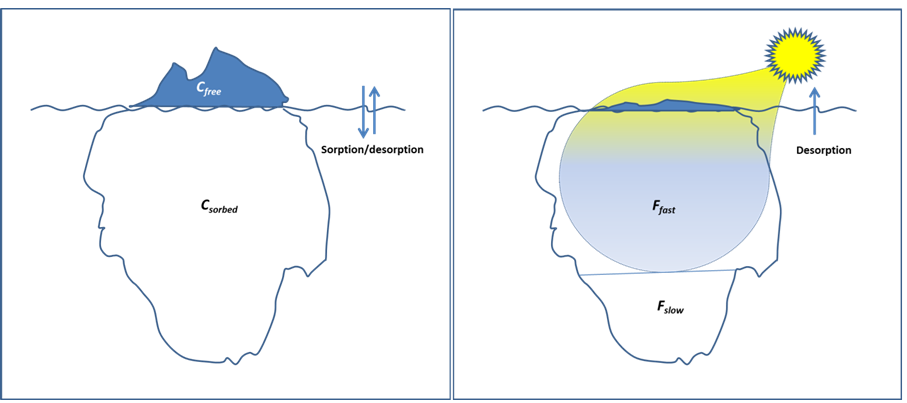
En muchos escenarios de exposición que involucran químicos orgánicos, que van desde una célula bacteriana hasta un pez, o desde un lecho de sedimentos hasta un perfil de suelo, los organismos experimentan la contaminación a través de la fase acuosa. Incluso cuando este no es el caso, por ejemplo cuando la captación es del sedimento consumido como alimento, la concentración acuosa puede ser un buen indicador de la concentración biodisponible, ya que finalmente se establecerá un equilibrio químico entre la fase sólida, la fase acuosa (posiblemente en el intestino), y el organismo. Así, tomar una muestra acuosa de un ambiente dado, y determinar la concentración de un determinado químico con el equipo analítico apropiado parece un enfoque sencillo para evaluar la biodisponibilidad. Sin embargo, especialmente para los químicos hidrófobos, que tienden a permanecer sorbidos a superficies sólidas (ver secciones sobre Propiedades químicas relevantes y Sorción de químicos orgánicos), la determinación de los químicos presentes en la fase acuosa, como una forma de evaluar la biodisponibilidad, ha representó un desafío significativo para la química orgánica ambiental. El intercambio de fases entre diferentes compartimentos a menudo conduce a concentraciones acuosas de equilibrio que son muy bajas, debido a que la mayoría de los químicos permanecen asociados a los sólidos, y después de una exposición sostenida, a la biota. Estas concentraciones de libre disolución (C libre) son muy útiles para determinar la biodisponibilidad, ya que representan la “punta del iceberg” bajo exposición en equilibrio, y son lo que los organismos “ven” (Figura 1, izquierda). De manera similar al equilibrio entre las fuerzas de gravedad y flotabilidad que conducen a la flotación del iceberg hasta cierto nivel, el C libre está determinado por el equilibrio entre sorción y desorción, y conectado a la concentración del químico sorbido (C sorbido) a través de un coeficiente de partición.
La absorción biológica también puede resultar en la rápida eliminación del químico de la fase acuosa, y así en una mayor desorción de los sólidos, por lo que nunca se logra el equilibrio, y las concentraciones acuosas reales son mucho más bajas que el equilibrio libre de C (o incluso cercanas a cero). En estas situaciones, la biodisponibilidad es impulsada por la cinética de desorción del químico. Por lo general, la desorción ocurre como un proceso bifásico, donde una fase de desorción rápida, que ocurre durante unas pocas horas o días, es seguida por una fase mucho más lenta, tardando meses o incluso años. Por lo tanto, para escenarios que involucran exposiciones rápidas, o para estudios sobre desorción/biodegradación acoplada, se puede usar la fracción de desorción rápida de los químicos (F rápido) para determinar la biodisponibilidad. Esta fracción a menudo se conoce como la fracción bioaccesible. Siguiendo la analogía del iceberg (Figura 1, derecha), F fast constituiría la fracción de iceberg superior que se derritió rápidamente por irradiación solar, con una superficie “visible” muy mínima (que representa el químico desorbido en la solución acuosa, que se elimina rápidamente por absorción biológica). La fracción de desorción lenta -o fusión-, F lenta, permanecería en el estado sorbido, dentro de un lapso de tiempo dado, teniendo pocas interacciones con la biota.
Determinar la biodisponibilidad con métodos de muestreo pasivo
C libre se puede determinar con un muestreador pasivo, en forma de fibras recubiertas de polímero o láminas (membranas) hechas de una variedad de polímeros, que establecen un equilibrio de sorción adicional con la fase acuosa en contacto con el suelo o sedimento (Jonker et al., 2018). Dependiendo de los analitos de interés, diferentes polímeros, como el polidimetilsiloxano (PDMS) o el polietileno (PE), se utilizan en muestreadores pasivos. El muestreador pasivo, enriquecido en el analito (de manera similar al iceberg flotante en la Figura 1, izquierda, donde C sorbido en este caso es la concentración en el muestreador pasivo), se puede utilizar de esta manera para determinar indirectamente la concentración de contaminante presente en la fase acuosa, incluso a concentraciones muy bajas, aunque la proporción de distribución apropiada entre el muestreador y el agua. En las estimaciones de biodisponibilidad, el muestreo pasivo está diseñado para condiciones de equilibrio y no depletivas. Esto significa que la cantidad de sustancia química muestreada no altera el equilibrio sólido-agua, es decir, es esencial que el C libre no se vea afectado significativamente por el muestreador. El logro del equilibrio es crítico, y puede llevar días o semanas.
C libre se puede calcular a partir de la concentración del contaminante en el polímero de muestra pasiva en equilibrio (C p), y el coeficiente de partición polímero-agua (K pw):
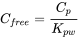
Los valores libres de C pueden ser la base de predicciones de bioacumulación que utilizan el enfoque de partición en equilibrio, ya sea directamente o a través de un factor de bioconcentración, y para la toxicidad de sedimentos junto con pruebas de toxicidad reales. Los métodos de muestreo pasivo son muy adecuados para sedimentos contaminados, y ya se han implementado en evaluaciones ambientales regulatorias basadas en la biodisponibilidad (Burkhard et al., 2017).
Determinar la biodisponibilidad con métodos de extracción por desorción
La determinación de F rápido se puede lograr con el uso de métodos que atrapan el químico desorbido una vez que aparece en la fase acuosa. Lejos de las condiciones de equilibrio, la desorción es conducida a su velocidad máxima al colocar un material en la fase acuosa que actúa como un sumidero infinito (comparable a la irradiación solar de un iceberg que se funde en la Figura 1, derecha). Los materiales más aceptados para estos métodos de extracción por desorción son Tenax, una resina sortiva, y la ciclodextrina, un agente solubilizante (ISO, 2018). Estos métodos permiten una concentración química acuosa permanente de casi cero, y por lo tanto, se puede descuidar la sorción del químico de regreso al suelo o sedimento. Se pueden utilizar varios pasos de extracción, cubriendo un lapso de tiempo variable, el cual depende de la muestra ambiental.
Se puede utilizar el siguiente modelo cinético de dos compartimentos de primer orden para analizar los datos de extracción de desorción:
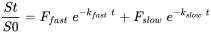
En esta ecuación, S t y S o (mg) son las cantidades absorbidas por el suelo del químico en el tiempo t (h) y al inicio del experimento, respectivamente. F rápido y F lento son las fracciones de desorción rápida y lenta, y k rápido y k lento (h -1) son las constantes de velocidad de desorción rápida y lenta, respectivamente. Para calcular los valores de las diferentes constantes y fracciones (F rápido, F lento, k rápido y k lento) se puede utilizar un ajuste de curva exponencial. La forma ln de la ecuación se puede utilizar para simplificar el ajuste de curvas.
Una vez que se conoce la cinética de desorción, el método puede simplificarse para una serie de muestras, mediante el uso de extracciones de punto de tiempo único. Se ha sugerido un periodo de tiempo de 20 h como un periodo de tiempo suficiente para aproximar F rápido. Es muy conveniente por razones operativas (ISO, 2018), pero indicativo en el mejor de los casos, ya que el tiempo necesario para extraer Ffast tiende a variar entre químicos y suelos/sedimentos.
Referencias
Burkhard, L.P., Mount, D., R., Burgess, R., M. (2017). Desarrollo de Objetivos de Remediación de Sedimentos en Sitios Superfund Basados en Agua Porosa para la Protección de Organismos Bentónicos de Toxicidad Directa a Contaminantes Orgánicos No Iónicos EPA/600/R 15/289; Agencia de Protección Ambiental de Estados Unidos Oficina de Investigación y Desarrollo: Washington, DC
ISO (2018). Comité Técnico ISO/TC 190 Calidad del suelo - Disponibilidad ambiental de compuestos orgánicos no polares - Determinación de la fracción potencialmente biodisponible y la fracción no biodisponible utilizando un fuerte adsorbente o agente complejante; Organización Internacional de Normalización: Ginebra, Suiza.
Jonker, M.T.O., van der Heijden, S.A., Adelman, D., Apell, J.N., Burgess, R.M., Choi, Y., Fernández, L.A., Flavetta, G.M., Ghosh, U., Gschwend, P.M., Hale, S.E., Jalalizadeh, M., Khairy, M., Lampi, M.A., Lao, W., Lohmann, R., Lydy, M.J., Maruya, K.A., Nutile, S., A., Oen, A.M.P., Rakowska, M.I., Reible, D., Rusina , T.P., Smedes, F., Wu, Y. (2018) Avanzando en el uso del muestreo pasivo en la evaluación de riesgos y manejo de sedimentos contaminados con químicos orgánicos hidrófobos: resultados de una comparación interlaboratorio internacional de muestreo pasivo ex situ. Ciencia y Tecnología Ambiental 52 (6), 3574-3582.
Describir por qué la concentración libremente disuelta se utiliza a menudo como un indicador de la biodisponibilidad de los químicos orgánicos en el suelo y los sedimentos.
¿Qué es el muestreo pasivo y cómo se puede utilizar este para determinar las concentraciones biodisponibles de químicos en el suelo o sedimento?
¿Qué se entiende por fracción de desorción rápida de un químico en el suelo o sedimento y cómo se puede determinar esto con métodos de extracción por desorción?
3.6.3. Evaluación de las concentraciones de metales disponibles
Autores: Kees van Gestel
Crítico: Martina Vijver, Steve Lofts
Objetivos de Inclinación:
Deberías ser capaz de:
- mencionan diferentes métodos para evaluar fracciones metálicas químicamente disponibles en suelos y sedimentos.
- indicar las fuerzas de unión relativas de los metales extraídos con los diferentes métodos o en diferentes etapas de un procedimiento de extracción secuencial.
- explicar los pros y los contras de los métodos de extracción química para evaluar la (bio) disponibilidad de metales en suelos y sedimentos.
Palabras clave: Disponibilidad química, captación real y potencial, toxicocinética, toxicodinámica.
Introducción:
Las concentraciones totales no son muy informativas sobre la disponibilidad de metales en suelos o sedimentos. El destino y el comportamiento de los metales -en términos generales de movilidad- así como la absorción biológica y la toxicidad están altamente determinados por su especiación. Especiación describe la partición de un metal entre las diversas formas en que puede existir (ver sección Especiación de metales). Para evaluar el riesgo de metales para el hombre y el medio ambiente, la especiación es por lo tanto altamente relevante ya que puede determinar su disponibilidad para la captación y efectos en los organismos. Se han desarrollado varias herramientas para determinar las concentraciones de metales disponibles o su especiación en suelos y sedimentos. Como se indica en el apartado de Disponibilidad y biodisponibilidad, dichos métodos químicos son meramente indicativos, y en gran medida ignoran la dinámica de disponibilidad. Además, la disponibilidad también está influenciada por procesos biológicos, con interacciones abiótico-bióticas que influyen en el proceso de biodisponibilidad siendo especies- y a menudo incluso específicas de la etapa de vida. Sin embargo, las extracciones químicas pueden proporcionar información útil para predecir o estimar los riesgos potenciales de los metales y, por lo tanto, se prefieren sobre la determinación de las concentraciones totales de metales.
Los métodos disponibles incluyen:
- Extracción de agua de poros
- Extracciones con agua
- Extracciones con sales diluidas
- Extracciones con agentes quelantes
- Extracciones con ácidos diluidos
- Extracciones secuenciales utilizando una serie de diferentes soluciones de extracción
- Métodos de muestreo pasivo
La extracción de agua porosa probablemente se aproxima mejor a la fracción fácilmente disponible de metales en el suelo, lo que impulsa la movilidad y es la fracción de metales experimentada directamente por muchos organismos expuestos. En general, el agua de poro se extrae del suelo o sedimento por centrifugación, y se filtra sobre un filtro de 0.45 µm (o 0.22 µm) para eliminar partículas más grandes y tal vez parte de la materia orgánica disuelta. La filtración, sin embargo, no eliminará todos los complejos, haciendo imposible determinar únicamente la fracción metálica disuelta en el agua del poro. Sin embargo, se ha demostrado que las concentraciones de metales en agua porosa tienen correlaciones significativas con la captación de metales (por ejemplo, para la captación de cobre por la cebada y el tomate por Zhao et al., 2006) y que son útiles para predecir concentraciones umbral tóxicas de metales, con corrección para el pH (por ejemplo, para toxicidad de níquel para tomate y cebada por Rooney et al., 2007).
La extracción con agua simula la fracción inmediatamente disponible, por lo que la fracción presente en la solución del suelo o agua de poro. Al extraer suelo con agua, sin embargo, el agua de los poros se diluye, lo que por un lado puede facilitar el análisis de metales al crear mayores volúmenes de solución, pero por otro lado puede conducir a diferencias entre las concentraciones de metal medidas y reales en el agua de poro ya que puede impactar los equilibrios químicos.
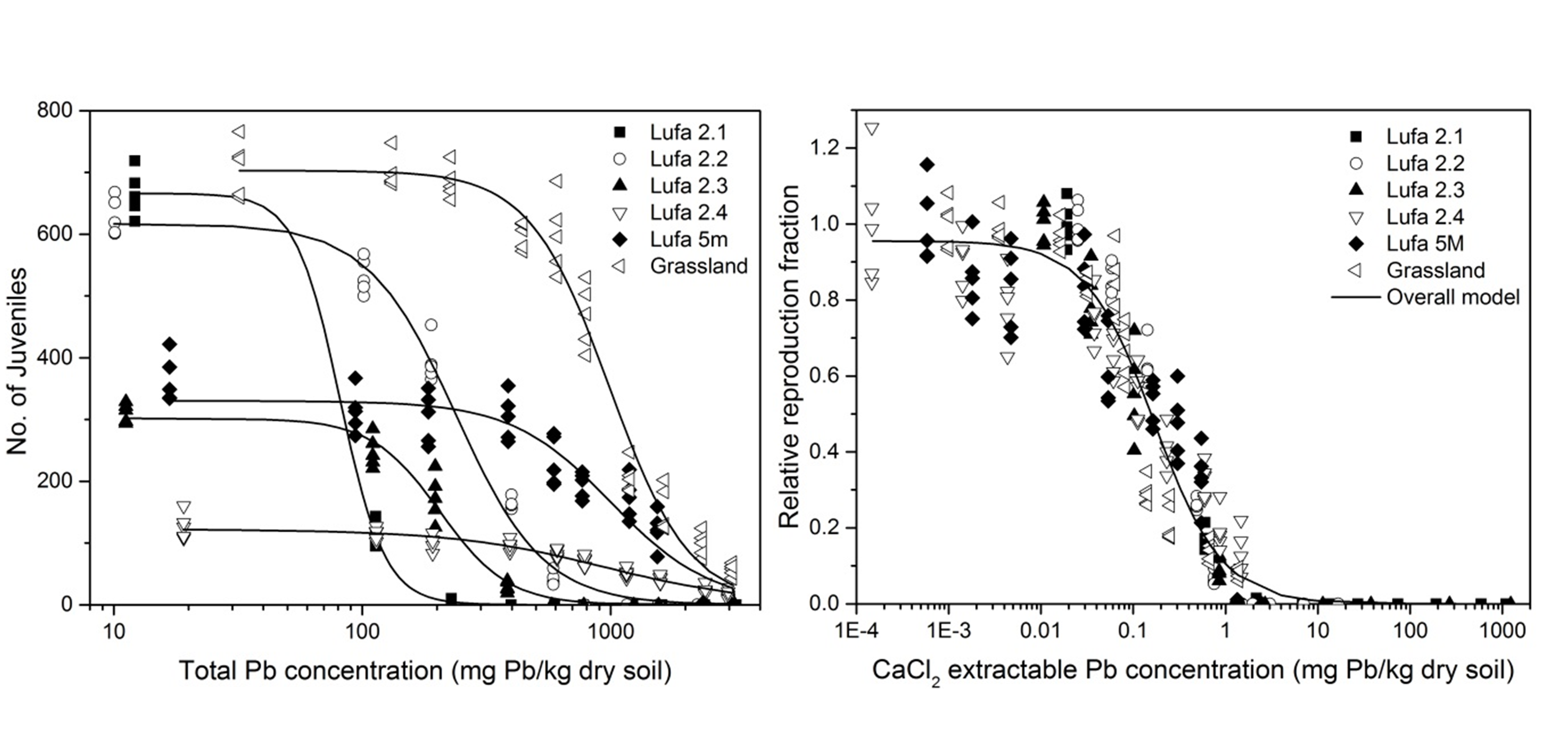
La extracción con sales diluidas tiene como objetivo determinar la fracción de metal que está fácilmente disponible o puede estar disponible ya que está en la forma intercambiable. Esto se refiere a los metales catiónicos que pueden estar unidos a las partículas de suelo cargadas negativamente (ver sección Suelo). Las soluciones salinas tamponadas, por ejemplo NH 4-acetato 1 M a pH 4.8 (con ácido acético) o a pH 7, pueden subestimar o sobreestimar las concentraciones de metal disponibles debido a su interferencia con el pH del suelo. Por lo tanto, las soluciones salinas no tamponadas se usan más ampliamente y pueden incluir, por ejemplo, CaCl 2 0.001 o 0.01 M, NaN 3 0.1 M o NH 4 NO 3 1 M (Gupta y Aten, 1993; Novozamsky et al., 1993). Gupta y Aten (1993) mostraron buenas correlaciones entre la captación de algunos metales en las plantas y concentraciones extraíbles de NaN3 0.1 M en el suelo, mientras que Novozamsky et al. (1993) encontraron correlaciones similares con CaCl 2 0.01 M. Este último método también parecía muy capaz de predecir la absorción de metales en invertebrados del suelo, por lo que ha sido más aceptado para predecir la disponibilidad de metal en la ecotoxicología del suelo. La Figura 1 (Zhang et al., 2019) proporciona un ejemplo con la correlación entre la toxicidad de Pb para gusanos enquitraeidos en diferentes suelos y concentraciones extraíbles de CaCl 2 0.01 M.
Las extracciones con agua (incluyendo agua de poro) y sales diluidas se describen con mayor precisión como medidas de la solubilidad química del metal en el suelo. Los valores obtenidos pueden ser indicadores útiles de la reactividad relativa del metal en los suelos, pero tienden a ser menos útiles para la evaluación de la biodisponibilidad, a menos que los suelos considerados tengan un rango estrecho de propiedades del suelo. Esto se debe a que las soluciones obtenidas de tales suelos tienen propiedades químicas variables (por ejemplo, pH, concentración de DOC) que probablemente afecten la disponibilidad del metal medido para los organismos.
La extracción con agentes quelantes, como EDTA (0.01-0.05 M) o DTPA (0.005 M) (como sus sales de sodio o amonio), tiene como objetivo evaluar la disponibilidad de metales para las plantas. Muchas plantas tienen la capacidad de afectar activamente la especiación de metales en el suelo al producir exudados de raíces. Estos extractantes pueden formar complejos solubles en agua muy estables con muchos metales catiónicos polivalentes diferentes. Cabe señalar que la gran variación en las especies de plantas y fisiologías correspondientes, así como sus interacciones con microorganismos simbióticos (por ejemplo, hongos micorrícicos) hacen que no exista un método de extracción único que sea capaz de predecir adecuadamente la disponibilidad de metal para todas las especies de plantas.
La extracción con ácidos diluidos ha sido abogada para predecir la fracción potencialmente disponible de metales en los suelos, por lo que la fracción que puede estar disponible a largo plazo. Se trata de un método de extracción bastante riguroso que se puede ejecutar de manera robusta. Las concentraciones de metales determinadas mediante la extracción de suelos con HNO 3 0.43 M mostraron muy buena correlación con las concentraciones bioaccesibles orales (Rodrigues et al., 2013), probablemente porque en cierto grado simula la liberación de metal en condiciones ácidas del estómago.
Ambos métodos de extracción con agentes quelantes y ácido diluido también pueden disolver sólidos, como carbonatos y óxidos de Fe y Al-. Esto plantea preocupaciones en cuanto a la interpretación de los resultados de estos sistemas de extracción, y especialmente a su generalización a diferentes sistemas suelo-planta (Novozamsky et al., 1993). Las extracciones con agentes quelantes y ácidos diluidos se consideran métodos para estimar el metal “geoquímicamente activo” en el suelo, el charco de metal adsorbido que puede participar en la adsorción/desorción en solución sólida e intercambiar equilibrios en escalas de tiempo de horas a días. Esta alberca, junto con las propiedades básicas del suelo como pH etc., también controla las concentraciones fácilmente disponibles obtenidas con la extracción de agua/sal débil/agua de poro. Desde el punto de vista de la biodisponibilidad, estas extracciones tienden a ser más útiles como insumos para modelos de biodisponibilidad/toxicidad como el de Lofts et al. (2014), que toman más en cuenta los efectos de la especiación de metales y la química del suelo sobre la biodisponibilidad de metales para organismos ambientales.
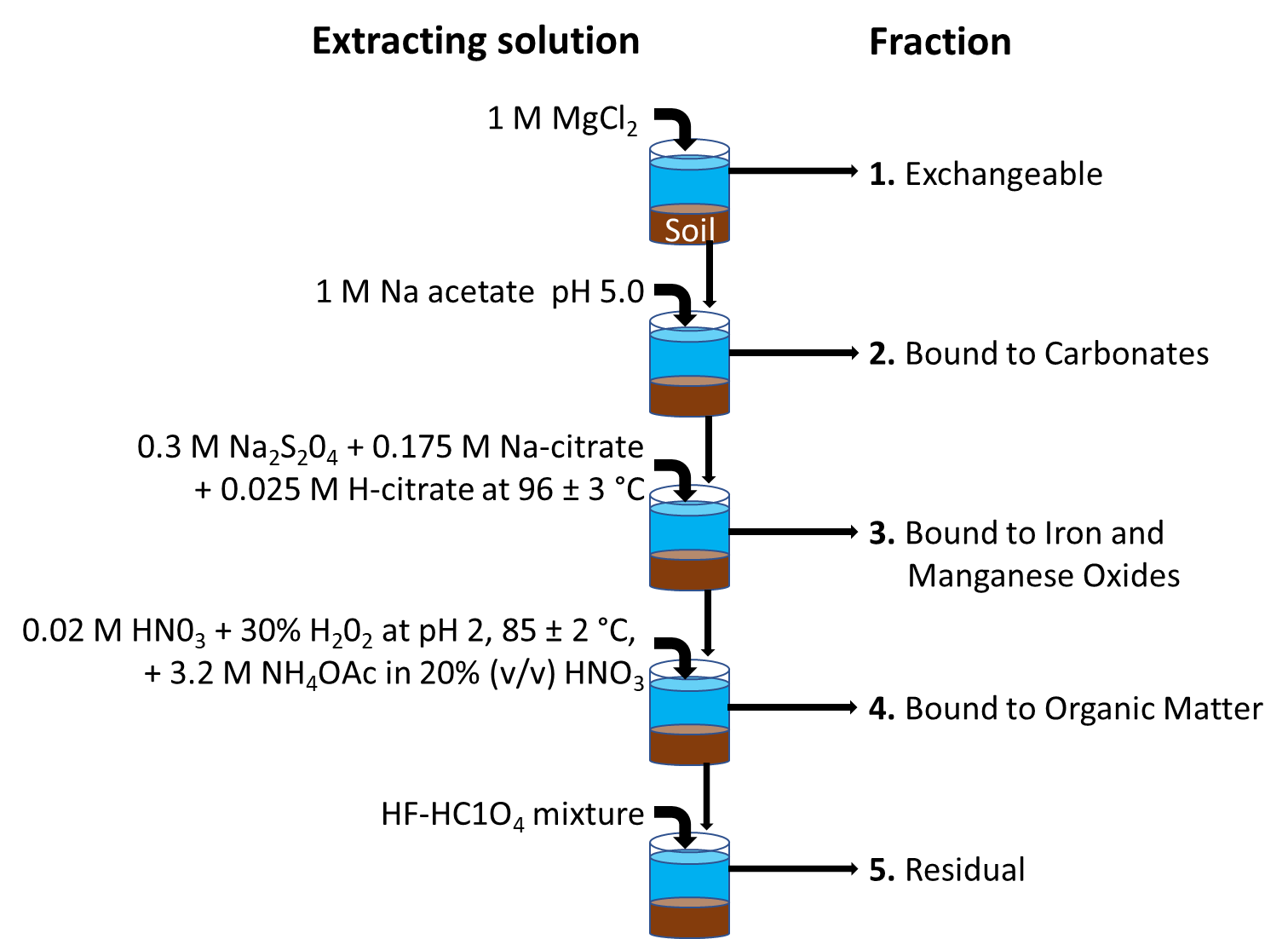
La extracción secuencial reúne diferentes métodos de extracción, y tiene como objetivo determinar con qué fuerza se retienen los metales o a qué componentes de la fase sólida están unidos en suelos o sedimentos. Esto permite determinar cómo se unen los metales a diferentes fracciones dentro del mismo suelo o sedimento, y permite interpretar la dinámica de biodisponibilidad. Con mucho, el método de extracción secuencial más utilizado es el propuesto por Tessier et al. (1979). Se distinguen cinco fracciones, lo que indica cómo interactúan los metales con los componentes del suelo o del sedimento: ver Figura 2.
Donde el método Tessier tiene como objetivo evaluar la disponibilidad ambiental de metales en suelos y sedimentos, también se han desarrollado métodos de extracción secuencial similares para evaluar la disponibilidad potencial de metales para los humanos (bioaccesibilidad) después del paso intestinal de las partículas del suelo (ver por ejemplo Basta y Gradwohl, 2000).
También se puede aplicar un muestreo pasivo para evaluar las concentraciones de metales disponibles. El método más conocido es el de Gradientes Difusivos en Películas Delgadas (DGT), desarrollado por Zhang et al. (1998). En este método, una resina (Chelex) con alta afinidad por los metales se coloca en un dispositivo y se cubre con un gel difusivo y una membrana de nitrato de celulosa de 0.45 µm (Figura 3). La membrana se pone en contacto con el suelo. Los metales disueltos en la solución del suelo se difundirán a través de una membrana y gel difusivo y se unirán a la resina. Con base en el grosor de la membrana y el gel y el tiempo de contacto con el suelo, la concentración de metal en el agua de poro se puede calcular a partir de la cantidad de metal acumulado en la resina. El método puede ser indicativo de concentraciones de metal disponibles en suelos y sedimentos, pero solo puede funcionar eficazmente cuando el suelo está suficientemente húmedo para garantizar una difusión óptima de los metales a la resina. Por las mismas razones, el método probablemente sea más adecuado para evaluar la disponibilidad de metales para las plantas que para los invertebrados, especialmente para los animales que no están en contacto continuo con la solución del suelo.

Varios de los métodos descritos anteriormente han sido adoptados por la Organización Internacional de Normalización (ISO) en (borrador) de pautas de prueba estandarizadas para evaluar las fracciones metálicas disponibles en suelos, sedimentos y materiales de desecho, por ejemplo, para evaluar el potencial de lixiviación a aguas subterráneas o su potencial bioaccesibilidad. Esto incluye por ejemplo ISO/TS 21268-1 (2007) “Calidad del suelo - Procedimientos de lixiviación para pruebas químicas y ecotoxicológicas posteriores del suelo y materiales del suelo - Parte 1: Prueba por lotes usando una relación líquido/sólido de 2 l/kg de materia seca”, ISO 19730 (2008) “Calidad del suelo -Extracción de oligoelementos del suelo usando solución de nitrato de amonio” e ISO 17586 (2016) “Calidad del suelo — Extracción de oligoelementos utilizando ácido nítrico diluido”.
Referencias:
Basta, N., Gradwohl, R. (2000). Estimación de la biodisponibilidad de Cd, Pb y Zn en suelos contaminados por fundición mediante un procedimiento de extracción secuencial. Diario de Contaminación del Suelo 9, 149-164.
Gupta, S.K., Aten, C. (1993). Comparación y evaluación de los medios de extracción y su idoneidad en un modelo simple para predecir la relevancia biológica de las concentraciones de metales pesados en suelos contaminados. Revista Internacional de Química Analítica Ambiental 51, 25-46.
Lofts, S., Spurgeon, D.J., Svendsen, C., Tipping, E. (2004). Derivar límites críticos del suelo para Cu, Zn, Cd y Pb: Un método basado en concentraciones de iones libres. Ciencia y Tecnología Ambiental 38, 3623-3631.
Novozamsky, I., Lexmond, Th.M., Houba, V.J.G. (1993). Un solo procedimiento de extracción de suelo para la evaluación de la absorción de algunos metales pesados por las plantas. Revista Internacional de Química Analítica Ambiental 51, 47-58.
Rodrigues, S.M., Cruz, N., Coelho, C., Henriques, B., Carvalho, L., Duarte, A.C., Pereira, E., Römkens, P.F. (2013). Evaluación de riesgos para Cd, Cu, Pb y Zn en suelos urbanos: la disponibilidad química como concepto central. Contaminación Ambiental 183, 234-242.
Rooney, C.P., Zhao, F.-J., McGrath, S.P. (2007). Fitotoxicidad del níquel en una variedad de suelos europeos: Influencia de las propiedades del suelo, solubilidad de Ni y especiación. Contaminación Ambiental 145, 596-605.
Tessier, A., Campbell, P.G.C., Bisson, M. (1979). Procedimiento de extracción secuencial para la especiación de metales traza particulados. Química Analítica 51, 844-851.
Zhang, H., Davison, W., Knight, B., McGrath, S. (1998). Mediciones in situ de concentraciones de solución y flujos de metales traza en suelos usando DGT. Ciencia y Tecnología Ambiental 32, 704-710.
Zhang, L., Verweij, R.A., Van Gestel, C.A.M. (2019). Efecto de las propiedades del suelo sobre la biodisponibilidad y toxicidad del Pb en el invertebrado de suelo Enchytraeus crypticus. Quimosfera 217, 9-17.
Zhao, F.J., Rooney, C.P., Zhang, H., McGrath, S.P. (2006). Comparación de especiación de solución de suelo y gradientes difusivos en la medición de películas delgadas como indicador de biodisponibilidad de cobre para plantas. Toxicología y Química Ambiental 25, 733-742.
¿Qué fracciones metálicas se extraen con el método Tessier y qué dice eso de la disponibilidad del metal?
¿Por qué se prefiere la extracción de agua porosa por encima de la extracción con agua?
¿Cuál es el principio del método de muestreo pasivo de la DGT y por qué no funciona para suelos bastante secos?
¿Qué método puede dar la mejor estimación de los metales potencialmente disponibles para la absorción oral por los mamíferos?
Cuáles son los pros y los contras de los métodos de extracción química para evaluar la disponibilidad de metales en suelos o sedimentos


