1.2: Toxicidad dirigida y no dirigida
- Page ID
- 75360
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Después de completar esta lección, usted será capaz de:
- Discutir las diferencias entre toxicidad dirigida y no dirigida.
- Explicar cómo la absorción, distribución y metabolismo de un tóxico podría influir en sus efectos en el cuerpo.
- Discutir los tipos de interacciones que pueden ocurrir entre un tóxico y su molécula diana y cómo impactan al huésped.
- Explicar la importancia de la bioactivación en la fisiopatología de la toxicosis por acetaminofén.
Tóxicos
 1. Los efectos tóxicos ocurren cuando el tóxico definitivo reacciona con una molécula huésped, célula o tejido, desencadenando una serie secundaria de eventos que conducen a lesiones tóxicas.
1. Los efectos tóxicos ocurren cuando el tóxico definitivo reacciona con una molécula huésped, célula o tejido, desencadenando una serie secundaria de eventos que conducen a lesiones tóxicas.
2. El tóxico final puede ser el xenobiótico original al que se expuso el huésped, un metabolito del xenobiótico original, una especie reactiva generada por el xenobiótico original o su metabolito, o un compuesto endógeno alterado o inalterado.
3. Algunos tóxicos pueden interactuar con cualquier compuesto que encuentren, mientras que otros tóxicos ejercen sus efectos al interactuar con sitios específicos (dianas) en las moléculas.
4. Los tipos de interacción entre los tóxicos y sus dianas: unión covalente, unión no covalente, transferencia de electrones, abstracción de hidrógeno, reacciones enzimáticas.
Encuadernación covalente
La unión covalente forma enlaces prácticamente irreversibles entre el tóxico y la molécula diana; la molécula tóxico-diana resultante se denomina aducto. La unión covalente ocurre más comúnmente cuando los compuestos electrófilos (que buscan electrones) se unen con compuestos nucleofílicos (donadores de electrones). Los compuestos nucleofílicos son abundantes en los sistemas biológicos e incluyen macromoléculas celulares tales como proteínas, ácidos nucleicos y fosfolípidos.
La unión covalente de tóxicos a proteínas celulares puede inhibir reacciones enzimáticas vitales, alterar la función de las proteínas, inhibir o estimular los receptores de membrana, o dañar las proteínas de membrana. La unión covalente de tóxicos a ácidos nucleicos como ARN y ADN puede inhibir o alterar la síntesis de proteínas o inducir mutaciones de ADN que pueden conducir a disfunción celular o carcinogénesis. La unión covalente de tóxicos a fosfolípidos puede resultar en daño directo a las membranas celulares u orgánulos o puede desencadenar la peroxidación lipídica, lo que se discutirá más adelante.
La exposición al fármaco analgésico acetaminofén es la causa más común de lesión hepática inducida por fármacos en humanos, representando 30,000 hospitalizaciones y aproximadamente 1200 trasplantes hepáticos realizados cada año en Estados Unidos. La mayoría de los casos de lesión hepática inducida por acetaminofeno son el resultado de sobredosis accidentales o intencionales. Sin embargo, ciertos factores de riesgo pueden aumentar la probabilidad de que se desarrolle una lesión hepática a dosis terapéuticas de acetaminofén. Estos factores de riesgo incluyen el consumo crónico de alcohol, la ingestión de drogas o hierbas que alteran los niveles o vías de antioxidantes hepáticos, la desnutrición o el avance de la edad con posterior deterioro o disminución de las vías metabólicas hepáticas normales y la presencia de enfermedad hepática crónica (por ejemplo, hepatitis viral).
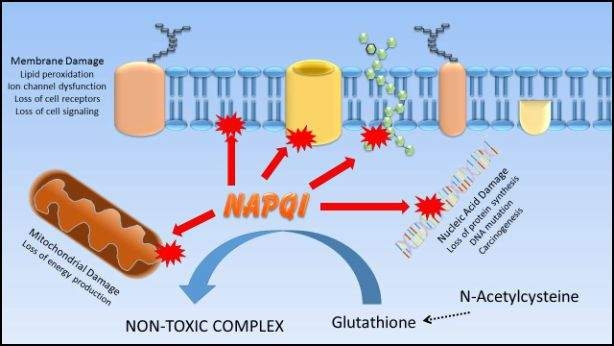
El paracetamol en sí mismo no causa daño hepático. En circunstancias normales, el acetaminofén se convierte en el hígado principalmente en metabolitos no tóxicos que luego se excretan del cuerpo. Sin embargo, alrededor del 10% del acetaminofén es bioactivado por las enzimas CYP450 a un metabolito tóxico llamado N-acetil-p-benzoquinoneimina (NAPQI); en circunstancias normales, el hígado puede neutralizar NAPQI uniéndolo a la molécula antioxidante glutatión. Sin embargo, en situaciones de sobredosis o cuando los niveles de glutatión son bajos (como en la enfermedad hepática crónica o desnutrición), la cantidad de NAPQI formado excede la capacidad del glutatión para unirse a él, y en su lugar NAPQI se une covalentemente a macromoléculas en el hepatocito, causando lesión hepatocelular y muerte. El tratamiento de la sobredosis de acetaminofén frecuentemente implica la administración de antioxidantes y precursores de glutatión, como la N-acetilcisteína, en un intento de proporcionar moléculas alternativas a las que se pueda unir NAPQI.
La unión no covalente de tóxicos a moléculas diana implica la formación de enlaces iónicos o de hidrógeno relativamente débiles. Debido a los enlaces relativamente débiles formados, la unión no covalente suele ser reversible. La unión no covalente se observa comúnmente con tóxicos que interactúan con receptores de membrana celular, receptores intracelulares, algunos sistemas enzimáticos y canales iónicos de membrana. La unión no covalente a estas estructuras puede resultar en una estimulación excesiva o insuficiente de la función normal. Estas interacciones pueden resultar en alteración de la señalización inter e intracelular, disfunción de orgánulos, alteración de la función enzimática, interferencia con el movimiento normal de iones homeostáticos, disfunción celular general o muerte celular.
Transferencia de electrones
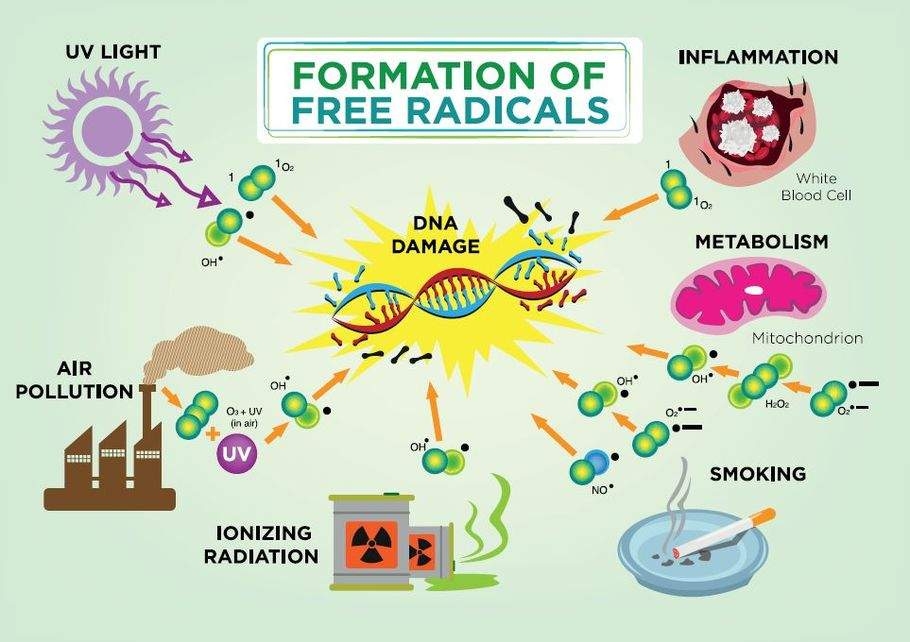 La transferencia de electrones puede resultar en la oxidación de algunas macromoléculas endógenas, alterando su función. Por ejemplo, los químicos que oxidan el hierro ferroso (Fe 2 +) a hierro férrico (Fe 3 +) en la molécula de hemoglobina causan una condición denominada metahemoglobinemia, lo que resulta en una disminución de la capacidad de la hemoglobina en los glóbulos rojos para entregar oxígeno a los tejidos corporales. Las transferencias de electrones pueden resultar en la formación de radicales, átomos altamente reactivos o moléculas con electrones desapareados que pueden unirse y dañar moléculas y estructuras celulares. Los radicales libres derivados del oxígeno (“libres” porque no están unidos a moléculas más grandes) como el ion superóxido (•O 2-) y el radical hidroxilo (HO•) se producen durante los procesos fisiológicos normales, pero cuando están presentes en exceso pueden causar lesiones celulares significativas debido a su capacidad de auto- perpetuar. Los antioxidantes presentes en los organismos vivos ayudan a mitigar este “efecto bola de nieve” al donar electrones sin formar especies radicales. Los antioxidantes importantes presentes dentro de las células incluyen superóxido dismutasa, catalasa, vitamina A y glutatión.
La transferencia de electrones puede resultar en la oxidación de algunas macromoléculas endógenas, alterando su función. Por ejemplo, los químicos que oxidan el hierro ferroso (Fe 2 +) a hierro férrico (Fe 3 +) en la molécula de hemoglobina causan una condición denominada metahemoglobinemia, lo que resulta en una disminución de la capacidad de la hemoglobina en los glóbulos rojos para entregar oxígeno a los tejidos corporales. Las transferencias de electrones pueden resultar en la formación de radicales, átomos altamente reactivos o moléculas con electrones desapareados que pueden unirse y dañar moléculas y estructuras celulares. Los radicales libres derivados del oxígeno (“libres” porque no están unidos a moléculas más grandes) como el ion superóxido (•O 2-) y el radical hidroxilo (HO•) se producen durante los procesos fisiológicos normales, pero cuando están presentes en exceso pueden causar lesiones celulares significativas debido a su capacidad de auto- perpetuar. Los antioxidantes presentes en los organismos vivos ayudan a mitigar este “efecto bola de nieve” al donar electrones sin formar especies radicales. Los antioxidantes importantes presentes dentro de las células incluyen superóxido dismutasa, catalasa, vitamina A y glutatión.
Peroxidación lipídica
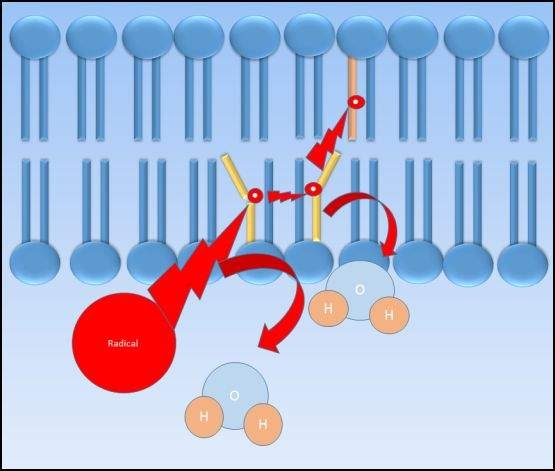
La extracción de hidrógeno inducida por tóxicos a partir de fosfolípidos de membrana puede inducir peroxidación lipídica que resulta en lesiones de membrana que conducen a fugas y/o muerte celular. La peroxidación lipídica ocurre cuando un compuesto electrófilo roba un electrón de un fosfolípido de membrana, produciendo un radical de ácido graso. Este radical de ácido graso es relativamente inestable y reaccionará fácilmente con oxígeno molecular para producir un radical peroxil-ácido graso. El radical de ácido graso peroxílico reacciona luego con otro ácido graso, produciendo otro peróxido lipídico y radical de ácido graso que continúa el ciclo en un mecanismo de reacción en cadena. Cuando están presentes en cantidades suficientes, los antioxidantes como la vitamina E pueden ayudar a terminar la peroxidación lipídica.
Algunos tóxicos actúan enzimáticamente con las moléculas diana para ejercer sus efectos adversos. La ricina, una toxina de la planta de ricino, hidroliza enzimáticamente un enlace en la molécula de ARN ribosómico, bloqueando así la síntesis de proteínas. Muchos venenos de serpiente contienen una variedad de enzimas que pueden destruir células y tejidos del cuerpo; por ejemplo, la hialuronidasa escinde el tejido conectivo a través de la hidrólisis del ácido hialurónico, un polisacárido esencial en el tejido conectivo.
Toxicidad no dirigida
No todos los efectos tóxicos están mediados por la acción directa del tóxico en el sitio de la lesión. Algunos tóxicos ejercen sus efectos alterando el microambiente biológico de las células o tejidos afectados, y la lesión resultante puede estar distante del sitio de acción tóxica. Por ejemplo, los alcaloides tóxicos del cornezuelo de centeno producidos por el hongo Claviceps purpurea actúan sobre los vasos sanguíneos para causar vasoconstricción, lo que resulta en una disminución de la circulación sanguínea y gangrena de las extremidades. Otros tóxicos pueden ejercer sus efectos simplemente por estar físicamente presentes, como cuando gases inertes como el metano desplazan el oxígeno en el ambiente, resultando en asfixia. Algunos xenobióticos pueden precipitar como cristales en los túbulos renales, resultando en daño mecánico al epitelio tubular, lo que lleva a lesión renal.
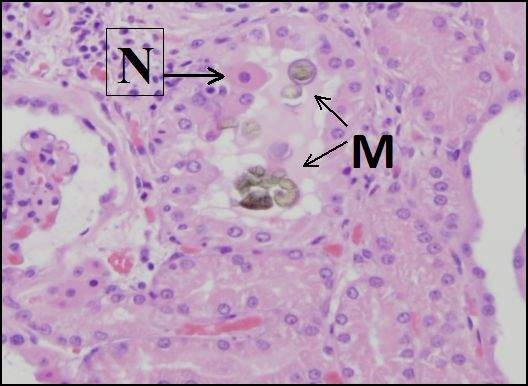 Figura\(\PageIndex{3}\): La precipitación de cristales de melamina-ácido cianúrico (M) causa daño mecánico a las células en los túbulos distales de un riñón canino. Una célula necrótica (muerta) (N) se ha desprendido de la membrana basal. La contaminación por melamina de alimentos para mascotas causó lesión renal a cientos de perros y gatos en 2007. (Cortesía de la Universidad de California, Davis Patología Anatómica.)
Figura\(\PageIndex{3}\): La precipitación de cristales de melamina-ácido cianúrico (M) causa daño mecánico a las células en los túbulos distales de un riñón canino. Una célula necrótica (muerta) (N) se ha desprendido de la membrana basal. La contaminación por melamina de alimentos para mascotas causó lesión renal a cientos de perros y gatos en 2007. (Cortesía de la Universidad de California, Davis Patología Anatómica.)
Tema 2: Puntos Clave
En esta sección, exploramos los siguientes puntos principales:
- 1: Los tóxicos pueden interactuar con las moléculas hospedadoras de una manera dirigida o no dirigida.
- Las interacciones dirigidas incluyen unión covalente y no covalente, transferencia de electrones, abstracción de hidrógeno y reacciones enzimáticas.
- 2: La unión covalente de moléculas tóxicas y diana forman aductos, que pueden causar daño físico o funcional a macromoléculas como proteínas y ácidos nucleicos.
- La unión covalente del metabolito de acetaminofén, NAPQI, a macromoléculas en hepatocitos puede resultar en lesiones hepáticas graves que requieren trasplante hepático.
- 3: La unión no covalente entre las moléculas tóxicas y diana forma enlaces reversibles relativamente débiles.
- 4: La transferencia de electrones puede resultar en la formación de radicales autoperpetuantes que pueden causar daños significativos a las estructuras celulares.
- Los antioxidantes como la superóxido dismutasa se unen a los radicales libres y ayudan a prevenir la perpetuación de la formación de radicales libres.
- 5: La peroxidación lipídica comienza con la extracción de hidrógeno de los fosfolípidos de membrana, dando como resultado la formación de radicales de ácidos grasos y daño a las membranas.
- 6: Los tóxicos pueden actuar como enzimas, dañando las estructuras celulares o tisulares o interfiriendo con la función celular normal.
- 7: Las interacciones no dirigidas incluyen alteraciones en el microambiente biológico de células y tejidos y deterioro de la función normal por obstrucción física o daño mecánico.
1. Los compuestos electrofílicos que se unen a compuestos nucleofílicos para formar aductos es un ejemplo de qué tipo de toxicidad dirigida:
Encuadernación covalente
Encuadernación no covalente
Reacciones enzimáticas
- Contestar
-
Encuadernación covalente
2. En comparación con la unión covalente de un tóxico a su molécula diana, los enlaces no covalentes tienden a ser:
Más Fuerte
De resistencia similar
Más débil
- Contestar
-
Más débil
3. Los antioxidantes mitigan la lesión celular donando electrones a ________.
- Contestar
-
radicales libres
4. La unión del metabolito de acetaminofén NAPQI con ADN celular es un ejemplo de:
Formación de radicales libres
Formación de aductos
Peroxidación lipídica
Degradación enzimática
- Contestar
-
Formación de aductos
5. La lesión renal mecánica causada por la precipitación de cristales dentro de los túbulos renales es un ejemplo de ________
- Contestar
-
Toxicidad no dirigida


