2.1: Precipitación
- Page ID
- 76296
Las reacciones químicas en estos ejercicios se realizan en un tubo de ensayo. Los tubos de ensayo vienen en diferentes tamaños. Estos experimentos están diseñados para tubos de ensayo de 9 mL de capacidad. El reactivo se encuentra en un tubo de ensayo y el reactivo (2do reactivo) se agrega gota a gota desde una botella de reactivo usando un cuentagotas, mientras se agita la mezcla de reacción. Use una varilla de vidrio limpia para agitar la mezcla de reacción. La agitación es necesaria ya que los reactivos deben mezclarse antes de que puedan reaccionar. La figura\(\PageIndex{1}\) ilustra los tubos de ensayo y las botellas de reactivo comúnmente utilizados.


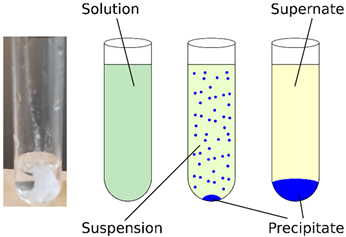
- Los compuestos disueltos hacen una solución transparente, es decir, la solución puede ser coloreada pero es transparente (no opaca) -permanece transparente.
- En una reacción de precipitación, el producto sólido se separa de la solución transparente haciendo que la solución sea opaca o turbia llamada suspensión.
- El producto sólido es decir, precipitado, puede ser filtrado, pero generalmente, es forzado a sedimentar en el fondo del tubo de ensayo como sedimento o un sedimento sólido, mediante proceso de centrifugación dejando una solución transparente, es decir, sobrenadante, en la parte superior.
La Figura\(\PageIndex{2}\) ilustra una reacción de precipitación y la diferencia entre solución, suspensión, sobrenadante y precipitado.
La reacción de precipitación debe probarse para verificar su integridad, ya que, de lo contrario, el reactivo residual interferirá con las otras pruebas a realizar usando el sobrenadante. Se agrega una gota más de reactivo al sobrenadante transparente y si no se forma más precipitado la precipitación es completa. De lo contrario, repita la centrifugación y vuelve a comprobarlo.


