3.2: Separación y confirmación de iones individuales en precipitados del grupo I
- Page ID
- 76249
Separación y confirmación del ion plomo (II)
La solubilidad de\(\ce{PbCl2}\) en agua a 20 o C es de aproximadamente 1.1 g/100 mL, que es significativamente mayor a 1.9 x 10 -4 g/100 mL para\(\ce{AgCl}\) y 3.2 x 10 -5 g/100 mL para\(\ce{Hg2Cl2}\). Además, la solubilidad de\(\ce{PbCl2}\) aumenta tres veces hasta aproximadamente 3.2 g/100 mL en agua hirviendo a 100 o C, mientras que la solubilidad\(\ce{AgCl}\) y\(\ce{Hg2Cl2}\) permanecen despreciables. Una muestra de 15 gotas que se emplea para precipitar los cationes del grupo I corresponde a aproximadamente 0.75 mL, que basado en la masa molar de\(\ce{PbCl2}\) es 278.1 g y la concentración de cada ion ~0.1M, contiene aproximadamente 0.02 g de\(\ce{PbCl2}\) precipitado. Este 0.02 g de\(\ce{PbCl2}\) requiere ~0.6 mL de agua caliente para su disolución. El precipitado se resuspende en ~2 mL de agua y se calienta en un baño de agua hirviendo para disolverse selectivamente\(\ce{PbCl2}\), dejando cualquiera\(\ce{AgCl}\) y\(\ce{Hg2Cl2}\) casi sin disolver, como se muestra en la Figura\(\PageIndex{1}\).
\[\ce{ PbCl2 (s) <=>[Hot~water] Pb^{2+}(aq) + 2Cl^{-}(aq)}\nonumber\]
La suspensión calentada se filtra usando un sistema de filtración por gravedad calentado para separar el residuo que comprende\(\ce{AgCl}\) y\(\ce{Hg2Cl2}\) del filtrado que contiene disuelto\(\ce{PbCl2}\).

La solubilidad de\(\ce{PbCl2}\) es tres veces menor a temperatura ambiente que en agua hirviendo. Por lo tanto, el filtrado de 2 ml se enfría a temperatura ambiente para cristalizar\(\ce{PbCl2}\):
\[\ce{Pb^{2+}(aq) + 2Cl^{-}(aq) <=>[Cold~water] PbCl2(s)}\nonumber\]
Si se observan\(\ce{PbCl2}\) cristales en el filtrado al enfriarse a temperatura ambiente, es una confirmación de\(\ce{PbCl2}\) en la solución de prueba. Si\(\ce{PbCl2}\) la concentración es baja en el filtrado, es posible que los cristales no se formen al enfriarse. Pocas gotas de 5M\(\ce{HCl}\) se mezclan con el filtrado para forzar la formación de cristales en base al efecto iónico común de Cl - en los reactivos. La formación de\(\ce{PbCl2}\) cristales se confirma\(\ce{Pb^{2+}}\) como se muestra en la Figura\(\PageIndex{2}\), y ninguna formación de cristales en esta etapa confirma que\(\ce{Pb^{2+}}\) estuvo ausente en la solución de prueba.

Separación del ion mercurio (I) del ion de plata (I) y confirmación del ion mercurio (I)
El residuo que queda después de filtrar\(\ce{Pb^{2+}}\) en agua caliente, se lava adicionalmente con 10 mL de agua caliente para lavar el residuo\(\ce{PbCl2}\). Después se pasan 2 mL de\(\ce{NH3}\) solución acuosa 6M a través del residuo gota a gota. La acuosa\(\ce{NH3}\) disuelve el\(\ce{AgCl}\) precipitado formando iones complejos solubles en agua\(\ce{[Ag(NH3)2(aq)]^+}\) a través de las siguientes series de reacciones:
\[\ce{AgCl(s) <=> Ag^{+}(aq) + Cl^{-}(aq)}\quad K_f = 1.8\times10^{-10}\nonumber\]
\[\ce{Ag^{+}(aq) + 2NH3(aq) <=> Ag(NH3)2^{+}(aq)}\quad K_f = 1.7\times10^7\nonumber\]
\[\text{Overall reaction:}~\ce{AgCl(aq) + 2NH3(aq) <=> Ag(NH3)2^{+}(aq) + Cl^{-}(aq)}\quad K = 3.0\times10^{-3}\nonumber\]
El filtrado de 2 mL se recoge en un tubo de ensayo separado para la confirmación del\(\ce{Ag^+}\) ion. Aunque el\(\ce{Hg2Cl2}\) precipitado es insoluble en agua, se disocia ligeramente como todos los compuestos iónicos. Los\(\ce{Hg2^{2+}}\) iones se someten a una reacción de auto-oxidación o desproporción produciendo líquido de Hg negro e\(\ce{Hg2^{2+}}\) iones. Los\(\ce{Hg2^{2+}}\) iones reaccionan con\(\ce{NH3}\) y\(\ce{Cl^-}\) forman\(\ce{HgNH2Cl}\) precipitado blanco insoluble en agua a través de las siguientes series de reacciones:
\[\ce{Hg2Cl2(s) <=> Hg2^{2+}(aq) + 2Cl^{-}(aq)}\nonumber\]
\[\ce{Hg2^{2+}(aq) <=> Hg(l) + Hg^{2+}(aq)}\nonumber\]
\[\ce{Hg^{2+}(aq) + 2NH3(aq) + Cl^{-}(aq) <=> HgNH2Cl(s) + NH4^{+}(aq)}\nonumber\]
\[\text{Overall reaction:}\ce{~Hg2Cl2(s, white) + 2NH3(aq) <=> HgNH2Cl(s, white) + NH4^{+}(aq) + Cl^{-}(aq) + Hg(l, black)}\nonumber\]
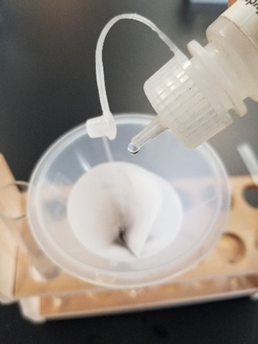
Una mezcla de sólido blanco\(\ce{HgNH2Cl}\) y líquido negro Hg aparece de color gris. El cambio del\(\ce{Hg2Cl2}\) precipitado blanco a color grisáceo tras la adición de gotas de\(\ce{NH3}\) solución 6M confirma que\(\ce{Hg2^{2+}}\) los iones están presentes en la solución de prueba como se muestra en la Figura\(\PageIndex{3}\). Si el precipitado blanco se redisuelve sin dejar ningún residuo grisáceo, significa que el precipitado estuvo\(\ce{AgCl}\) y\(\ce{Hg2^{2+}}\) estuvo ausente en la solución de prueba.
Confirmación de iones de plata (I)
Aunque el ion complejo soluble en agua\(\ce{[Ag(NH3)2(aq)]^+}\) es bastante estable, se descompone ligeramente en\(\ce{Ag^+}\) y\(\ce{NH3(aq)}\). El exceso\(\ce{NH3}\) agregado para disolver el\(\ce{AgCl}\) precipitado y el producido por disociación de\(\ce{[Ag(NH3)2(aq)]^+}\) se elimina haciendo ácida la solución añadiendo 6M\(\ce{HNO3}\). El\(\ce{Cl^-}\) formado a partir de la disolución del\(\ce{AgCl}\) precipitado en las reacciones anteriores todavía está presente en el medio. La descomposición\(\ce{[Ag(NH3)2(aq)]^+}\) en el medio ácido produce suficientes\(\ce{Ag^+}\) iones para volver a formar el\(\ce{AgCl}\) precipitado blanco mediante la siguiente serie de reacciones de equilibrio.
\[\ce{[Ag(NH3)2]^{+}(aq) <=> Ag^{+}(aq) + 2NH3(aq)}\nonumber\]
\[\ce{2NH3(aq) + 2H3O^{+}(aq) <=> 2NH4^{+}(aq) + 2H2O(l)}\nonumber\]
\[\ce{Ag^{+}(aq) + Cl^{-}(aq) <=> AgCl(s, white)}\nonumber\]
\[\text{Overall reaction:}\ce{~[Ag(NH3)2]^{+}(aq) + 2H3O^{+}(aq) + Cl^{-}(aq) <=> AgCl(s, white) + 2NH4^{+}(aq) + 2H2O(l)}\nonumber\]
La formación de\(\ce{AgCl}\) precipitado blanco en esta etapa en el filtrado acidificado confirma que el\(\ce{Ag^+}\) ion estaba presente en la solución de prueba, como se muestra en la Figura\(\PageIndex{4}\), y su ausencia confirma que el\(\ce{Ag^+}\) ion no estaba presente en la solución de prueba.



