6.2: Separación y confirmación de iones individuales en precipitados del grupo IV y mezcla del grupo V
- Page ID
- 76254
Separación y confirmación de iones de bario
Los precipitados de los cationes del Grupo IV, es decir,\(\ce{CaCO3}\)\(\ce{BaCO3}\) son solubles en medio ácido. En estos experimentos\(\ce{CH3COOH}\) se utiliza ácido acético para hacer ácida la solución que resulta en la disolución de\(\ce{CaCO3}\) y\(\ce{BaCO3}\):
\[\ce{4CH3COOH(aq) + 4H2O(l) <=> 4CH3COO^{-}(aq) + 4H3O^{+}(aq)}\nonumber\]
\[\ce{CaCO3(s, white) <=> Ca^{2+}(aq) + CO3^{2-}(aq)}\nonumber\]
\[\ce{BaCO3(s, white) <=> Ba^{2+}(aq) + CO3^{2-}(aq)}\nonumber\]
\[\ce{2CO3^{2-}(aq) + 4H3O^{+}(aq) <=> 2H2CO3(aq) +4H2O(l)}\nonumber\]
\[\ce{2H2CO3(aq) <=> 2H2O(l) + 2CO2(g)(^)}\nonumber\]
\[\text{Overall reaction: }\ce{~4CH3COOH(aq) + CaCO3(s, white) + BaCO3(s, white) <=> 4CH3COO^{-}(aq) + Ca^{2+} + Ba^{2+} + 2H2O(l) + 4CO2(g)(^)}\nonumber\]
\(\ce{CO3^{2-}}\)ion es una base débil que reacciona con\(\ce{H3O^{+}}\) y forma ácido carbónico (\(\ce{H2CO3}\). El ácido carbónico es inestable en el agua y se descompone en dióxido de carbono y agua. El dióxido de carbono sale de la solución que impulsa las reacciones hacia adelante, como se muestra en la Figura\(\PageIndex{1}\).

El ion Acetato (\(\ce{CH3COO^{-}}\)) producido en las reacciones anteriores es una base conjugada de un ácido acético ácido débil (\(\ce{CH3COOH}\)). Se agrega más ácido acético a la solución para hacer un\(\ce{CH3COOH}\)/\(\ce{CH3COO^{-}}\)tampón que puede mantenerse\(pH\) a ~5.
En esta etapa se agrega solución de cromato de potasio (\(\ce{K2CrO4}\)) que introduce ion cromato\(\ce{CrO4^{2-}}\):
\[\ce{K2CrO4(s) <=> 2K^{+}(aq) + CrO4^{2-}(aq)}\nonumber\]
Aunque tanto los iones calcio como el bario forman sal insoluble con ion cromato (\(\ce{CaCrO4}\)\(K_{sp}\)= 7.1 x 10 -4 y\(\ce{BaCrO4}\)\(K_{sp}\) = 1.8 x 10 -10),\(\ce{BaCrO4}\) es menos soluble y puede precipitarse selectivamente controlando la\(\ce{CrO4^{2-}}\) concentración. El ion cromato está involucrado en el siguiente equilibrio\(pH\) dependiente:
\[\ce{2CrO4^{2-}(aq) + 2H3O^{+}(aq) <=> Cr2O7^{2-}(aq) + 3H2O(l)}\quad K = 4.0\times10^{14}\nonumber\]
A\(pH\) ~5 en un\(\ce{CH3COOH}\)/\(\ce{CH3COO^{-}}\)tampón, la concentración de\(\ce{CrO4^{2-}}\) es suficiente para precipitar selectivamente iones de bario dejando iones de calcio en la solución:
\[\ce{Ba^{2+}(aq) + CrO4^{2-}(aq) <=> BaCrO4(s, light~yellow)(v)}\nonumber\]
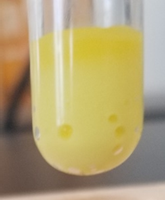
La mezcla se centrifuga y se decanta para separar el\(\ce{BaCrO4}\) precipitado del sobrenadante que contiene\(\ce{Ca^{2+}}\) iones como se muestra en la Figura\(\PageIndex{2}\). Si bien la formación de un precipitado amarillo claro (\(\ce{BaCrO4}\)) en esta etapa es una fuerte indicación de que\(\ce{Ba^{2+}}\) está presente en la muestra de prueba, también\(\ce{Ca^{2+}}\) puede formar un precipitado amarillo claro (\(\ce{CaCrO4}\)), particularmente si el pH es superior al valor recomendado de 5.

Los cationes de los grupos IV y V se confirman con mayor frecuencia mediante la prueba de llama. La figura\(\PageIndex{3}\) muestra los resultados de la prueba de llama de los cationes del grupo IV. La presencia de bario se confirma adicionalmente mediante una prueba de llama. Para ello, el\(\ce{BaCrO4}\) precipitado se trata con 12M\(\ce{HCl}\). El concentrado\(\ce{HCl}\) elimina\(\ce{CrO4^{2-}}\) convirtiéndolo en dicromato (\(\ce{Cr2O7^{2-}}\)) que resulta en la disolución de\(\ce{BaCrO4}\):
\[\ce{2BaCrO4(s, light~yellow) <=> 2Ba^{2+}(aq) + 2CrO4^{2-}(aq)}\nonumber\]
\[\ce{2CrO4^{2-}(aq) + 2H3O^{+}(aq) <=> Cr2O7^{2-}(aq) + 3H2O(l)}\nonumber\]
Se aplica una prueba de llama a la solución. \(\ce{Ba^{2+}}\)imparte característico color amarillo-verde a la llama. Si se observa el color amarillo-verde en la prueba de llama, se confirma que\(\ce{Ba^{2+}}\) está presente en la muestra de prueba.



Confirmando el ion calcio
El\(\ce{Ca^{2+}}\) presente en el sobrenadante se precipita mediante la adición de ion oxalato (\(\ce{C2O4^{2-}}\)):
\[\ce{Ca^{2+}(aq) + C2O4^{2-}(aq) <=> CaC2O4(s, white)(v)}\nonumber\]


La formación de precipitado blanco, es decir, que\(\ce{CaC2O4}\) se muestra en la Figura\(\PageIndex{4}\), es una fuerte indicación de que\(\ce{Ca^{2+}}\) está presente en la muestra de ensayo. Sin embargo, si no\(\ce{Ba^{2+}}\) se separa completamente antes, también forma un precipitado blanco\(\ce{BaC2O4}\). La presencia de\(\ce{Ca^{2+}}\) se verifica adicionalmente mediante prueba de llama. Para ello, el precipitado se disuelve en 6M\(\ce{HCl}\):
\[\ce{CaC2O4(s, white) <=> Ca^{2+}(aq) + C2O4^{2-}(aq)}\nonumber\]
\[\ce{C2O4^{2-}(aq) + 2H3O^{+}(aq) <=> H2C2O4(aq)}\nonumber\]
El ácido fuerte\(\ce{HCl}\) aumenta la concentración de\(\ce{H3O^{+}}\) iones que impulsa la reacción anterior basada en el principio de Le Chatelier. La prueba de llama se aplica a la solución. Si\(\ce{Ca^{2+}}\) está presente en la solución, imparte característico color rojo ladrillo a la llama, como se muestra en la Fig. 6.2.3. La observación del color rojo ladrillo en la prueba de llama confirma la presencia de\(\ce{Ca^{2+}}\) en la muestra de prueba. El color de la llama cambia a verde claro cuando se ve a través del vidrio azul cobalto.
Confirmando los cationes del grupo V mediante la prueba de llama
Los cationes del grupo V, es decir, metales alcalinos\(\ce{Na^{+}}\)\(\ce{K^{+}}\), etc. forman compuestos iónicos solubles. La separación de cationes de metales alcalinos por precipitación selectiva no es posible usando reactivos comúnmente disponibles. Entonces, los cationes del grupo V no están separados en estos análisis. Sin embargo, los cationes de metales alcalinos imparten color característico a la llama que ayuda en su confirmación como se muestra en la Figura\(\PageIndex{5}\). El sobrenadante después de separar el precipitado del grupo IV se concentra calentando la solución para evaporar el disolvente. Se aplica una prueba de llama a la solución concentrada.
El litio imparte rojo carmín, el sodio imparte amarillo intenso y el potasio imparte color lila a la llama.




