8.1: Espectros Atómicos Ópticos
- Page ID
- 79003
Diagramas de nivel energético
La energía de la radiación electromagnética ultravioleta y visible es suficiente para provocar un cambio en la configuración electrónica de valencia de un átomo. El sodio, por ejemplo, tiene un solo electrón de valencia en su orbital atómico de 3 s. Como se muestra en la Figura\(\PageIndex{1}\), también existen orbitales atómicos desocupados de mayor energía. El diagrama de nivel de energía de la capa de valencia en la Figura\(\PageIndex{1}\) podría parecerte extraño porque muestra los orbitales de 3 p divididos en dos grupos de energía ligeramente diferente (las dos líneas difieren en solo 0.6 nm). La causa de esta división es consecuencia del momento angular de un electrón y su giro. Cuando estos dos están en la dirección opuesta, entonces la energía es ligeramente menor que cuando los dos están en la misma dirección. El efecto es mayor para los orbitales p y suficientemente menor para los orbitales d y f que no nos molestamos en mostrar la diferencia en sus energías en este diagrama.
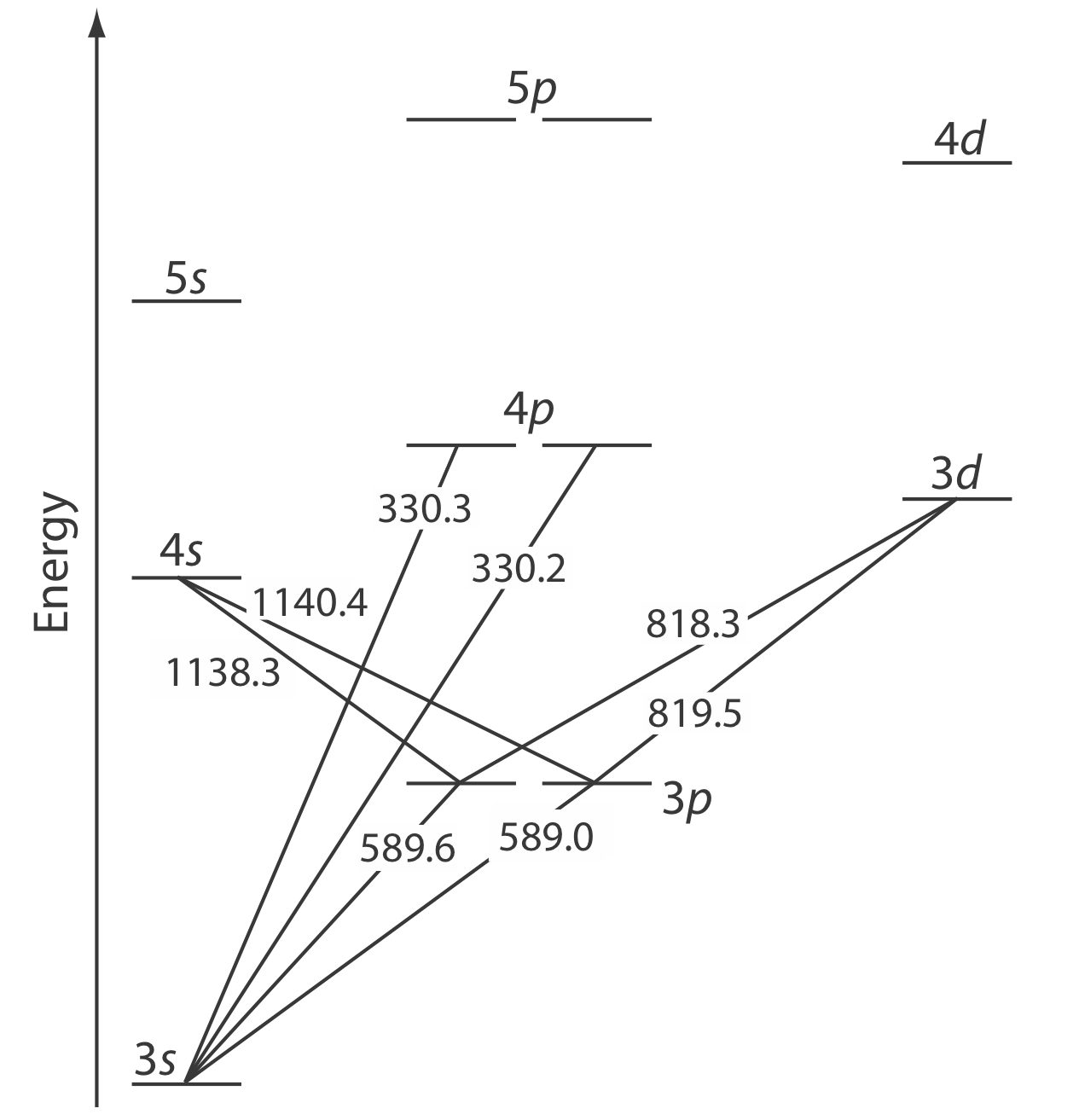
La absorción de un fotón se acompaña de la excitación de un electrón desde un orbital atómico de menor energía a un orbital atómico de mayor energía. No se permiten todas las transiciones posibles entre orbitales atómicos. Para el sodio las únicas transiciones permitidas son aquellas en las que hay un cambio de ±1 en el número cuántico orbital (l); así se permiten transiciones desde\(s \rightarrow p\) orbitales, pero se prohíben las transiciones desde\(s \rightarrow s\) y desde\(s \rightarrow d\) orbitales.
Espectros de absorción atómica
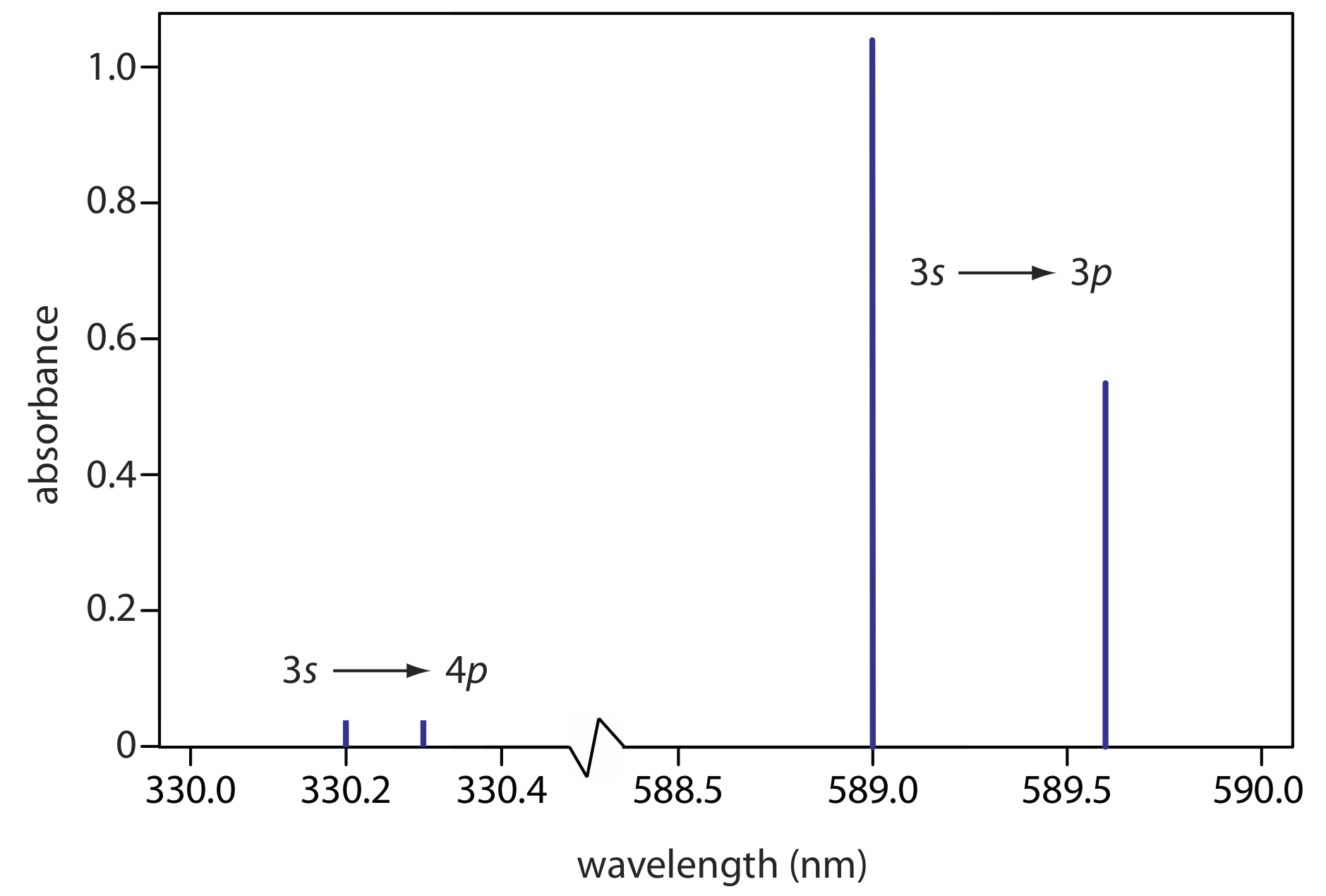
El espectro de absorción atómica para Na se muestra en la Figura\(\PageIndex{2}\), y es típico del que se encuentra para la mayoría de los átomos. La característica más obvia de este espectro es que consiste en un pequeño número de líneas de absorción discretas que corresponden a transiciones entre el estado fundamental (el orbital atómico de 3 s) y los orbitales atómicos de 3 p y 4 p. La absorción de estados excitados, como la\(3p \rightarrow 4s\) y las\(3p \rightarrow 3d\) transiciones incluidas en la Figura\(\PageIndex{1}\), son demasiado débiles para detectarse. Debido a que la vida útil de un estado excitado es corta (un átomo de estado excitado normalmente regresa a un estado de energía más baja en 10 —7 a 10 —8 segundos), es probable que un átomo en el estado salido regrese al estado fundamental antes de que tenga la oportunidad de absorber un fotón.
Espectros de emisión atómica
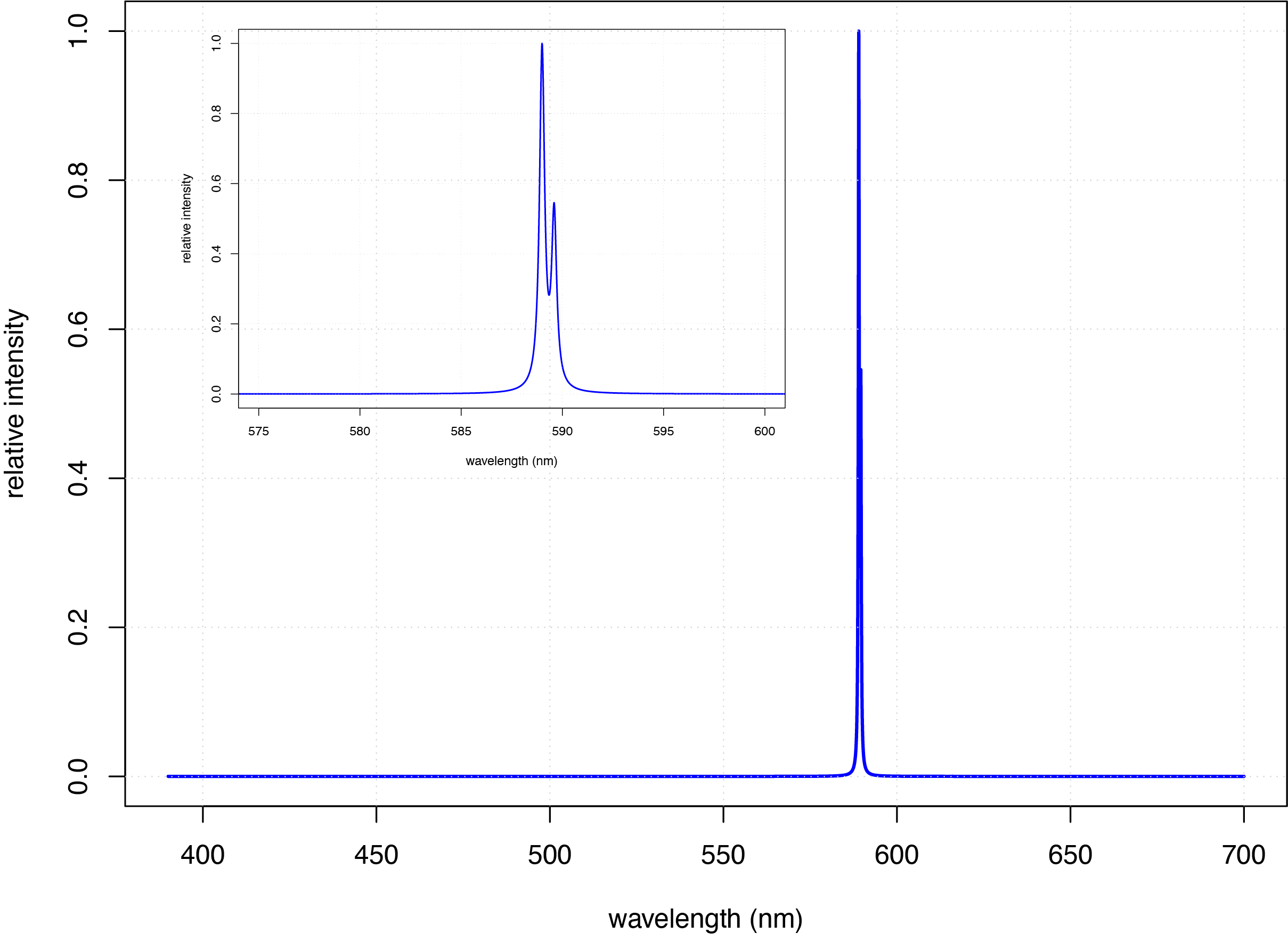
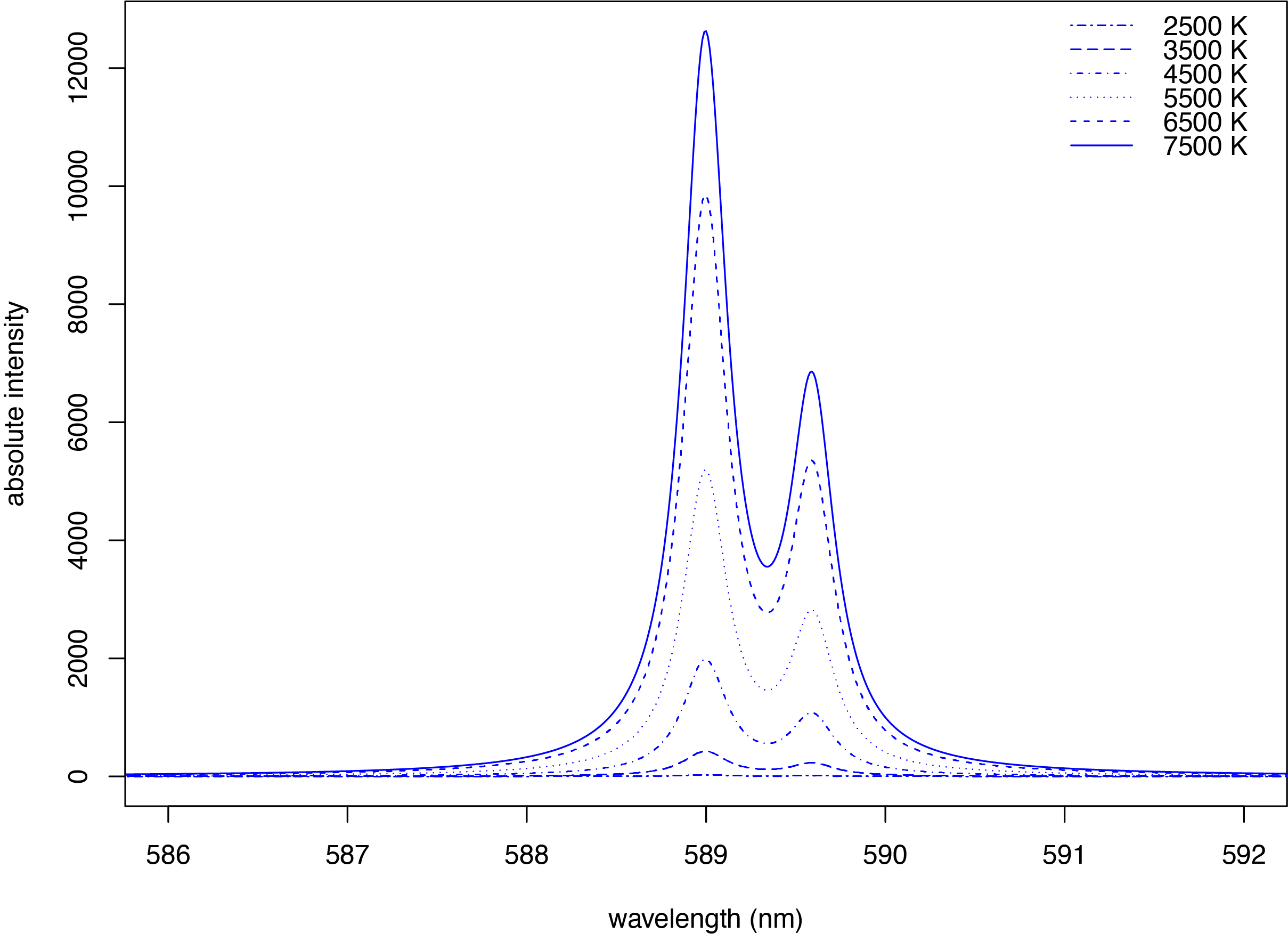
La emisión atómica ocurre cuando los electrones en orbitales de mayor energía regresan a un estado de menor energía, liberando el exceso de energía como fotón. La configuración electrónica del estado fundamental para Na de\(1s^2 2s^2 2p^6 3s^1\) coloca un solo electrón en la capa de\(3s\) valencia. La introducción de una solución de NaCl a una llama da como resultado la formación de átomos de Na (más sobre esto en el Capítulo 9) y proporciona energía suficiente para promover el electrón de valencia en la\(3s\) órbita a estados excitados de mayor energía, como los\(3p\) orbitales identificados en el diagrama de niveles de energía para el sodio en la Figura\(\PageIndex{1}\). Cuando un electrón vuelve a su estado fundamental, el exceso de energía se libera como fotón. Como se ve en la Figura\(\PageIndex{3}\), el espectro de emisión para Na está dominado por el par de líneas con longitudes de onda de 589.0 y 589.6 nm.
Espectros de fluorescencia atómica
Cuando un átomo en estado excitado emite un fotón como medio para regresar a un estado de energía inferior, la forma en que describamos el proceso depende de la fuente de energía que crea el estado excitado. Cuando la excitación es el resultado de la energía térmica, como es el caso del espectro en la Figura\(\PageIndex{3}\), llamamos al proceso espectroscopia de emisión atómica. Cuando la excitación es el resultado de la absorción de un fotón, llamamos al proceso espectroscopia de fluorescencia atómica. El espectro de absorción para Na en la Figura\(\PageIndex{2}\) y su espectro de emisión en la Figura\(\PageIndex{2}\) muestra que Na tiene líneas de absorción y emisión fuertes a 589.0 y 589.6 nm. Si usamos una fuente de luz a 589.6 nm para mover el electrón de valencia de 3 s a un estado excitado de 3 p, entonces podemos medir la emisión de luz a la misma longitud de onda, haciendo la medición a 90° para evitar una interferencia de la fuente de luz original.
La fluorescencia también puede ocurrir cuando un electrón en estado excitado primero pierde energía por un proceso que no sea la emisión de un fotón, lo llamamos transición sin radiación, alcanzando un estado excitado de menor energía desde el cual luego emite un fotón. Por ejemplo, un átomo de Na en estado fundamental puede absorber primero un fotón con una longitud de onda de 330.2 nm (una\(3s \rightarrow 4 p\) transición), que luego pierde energía a través de una transición sin radiación al orbital 3p donde luego emite un fotón para alcanzar el orbital de 3 s.
Anchos de Línea Atómica
Otra característica del espectro de absorción atómica en la Figura\(\PageIndex{2}\) y del espectro de emisión atómica en la Figura\(\PageIndex{3}\) es el ancho estrecho de las líneas de absorción y emisión, lo que es consecuencia de la diferencia fija de energía entre el estado fundamental y el estado excitado, y la falta de niveles de energía vibracional y rotacional. El ancho de una línea de absorción atómica o emisión surge de varios factores que consideramos aquí.
Ampliación por Principio de Incertidumbre
Desde el principio de incertidumbre, el producto de la incertidumbre de la frecuencia de la luz y la incertidumbre en el tiempo debe ser mayor a 1.
\[\Delta \nu \times \Delta t > 1 \nonumber \]
Para determinar la frecuencia con infinita precisión,\(\Delta \nu = 0\), se requiere que la vida útil de un electrón en un orbital particular sea infinitamente grande. Si bien esto puede ser esencialmente cierto para un electrón en el estado fundamental, no lo es para un electrón en un estado excitado donde la vida promedio, cuánto tiempo tarda antes de que regrese al estado terrestre, puede estar en el orden de\(10^{-7} \text{ to }10^{-8} \text{ s}\). Por ejemplo, si\(\Delta t = 5 \times 10^{-8} \text{ s}\) para la emisión de un fotón con una longitud de onda de 500.0 nm, entonces
\[\Delta \nu = 2 \times 10^7 \text{ s}^{-1} \nonumber \]
Para convertir esto en una incertidumbre en longitud de onda\(\Delta \lambda\),, comenzamos con la relación
\[\nu = \frac{c}{\lambda} \nonumber \]
y tomar la derivada de\(\nu\) con respecto a la longitud de onda
\[d \nu = - \frac{c}{\lambda^2} d \lambda \nonumber \]
Reorganizar para resolver la incertidumbre en la longitud de onda, y dejar\(\Delta \nu\) y\(\Delta \lambda\) servir como estimaciones para\(d \nu\) y nos\(d \lambda\) deja con
\[ \left| \Delta \lambda \right| = \frac{\Delta \nu \times \lambda^2}{c} = \frac{(500.0 \times 10^{-9} \text{ m}^2) \times (2 \times 10^7 \text{s}^{-1})}{2.998 \times 10^8 \text{ m/s}} = 1.7 \times 10^{-14} \text{ m} \nonumber \]
o\(1.7 \times 10^{-5} \text{ nm}\). Los anchos de línea naturales para los espectros atómicos son aproximadamente de 10 —5 nm.
Ampliamiento Doppler y Ampliamiento de Presión
Cuando un átomo emite un fotón, la frecuencia (y, por lo tanto, la longitud de onda) del fotón depende de si el átomo emisor se está moviendo hacia el detector o alejándose del detector. Cuando el átomo se mueve hacia el detector, como en la Figura\(\PageIndex{4}a\), su luz emitida llega al detector a una frecuencia mayor —una longitud de onda más corta— que cuando la fuente de luz está estacionaria, como en la Figura\(\PageIndex{4}b\). Un átomo que se aleja del detector, como en la Figura\(\PageIndex{4}c\) emite luz que llega al detector con una frecuencia menor y una longitud de onda más larga.
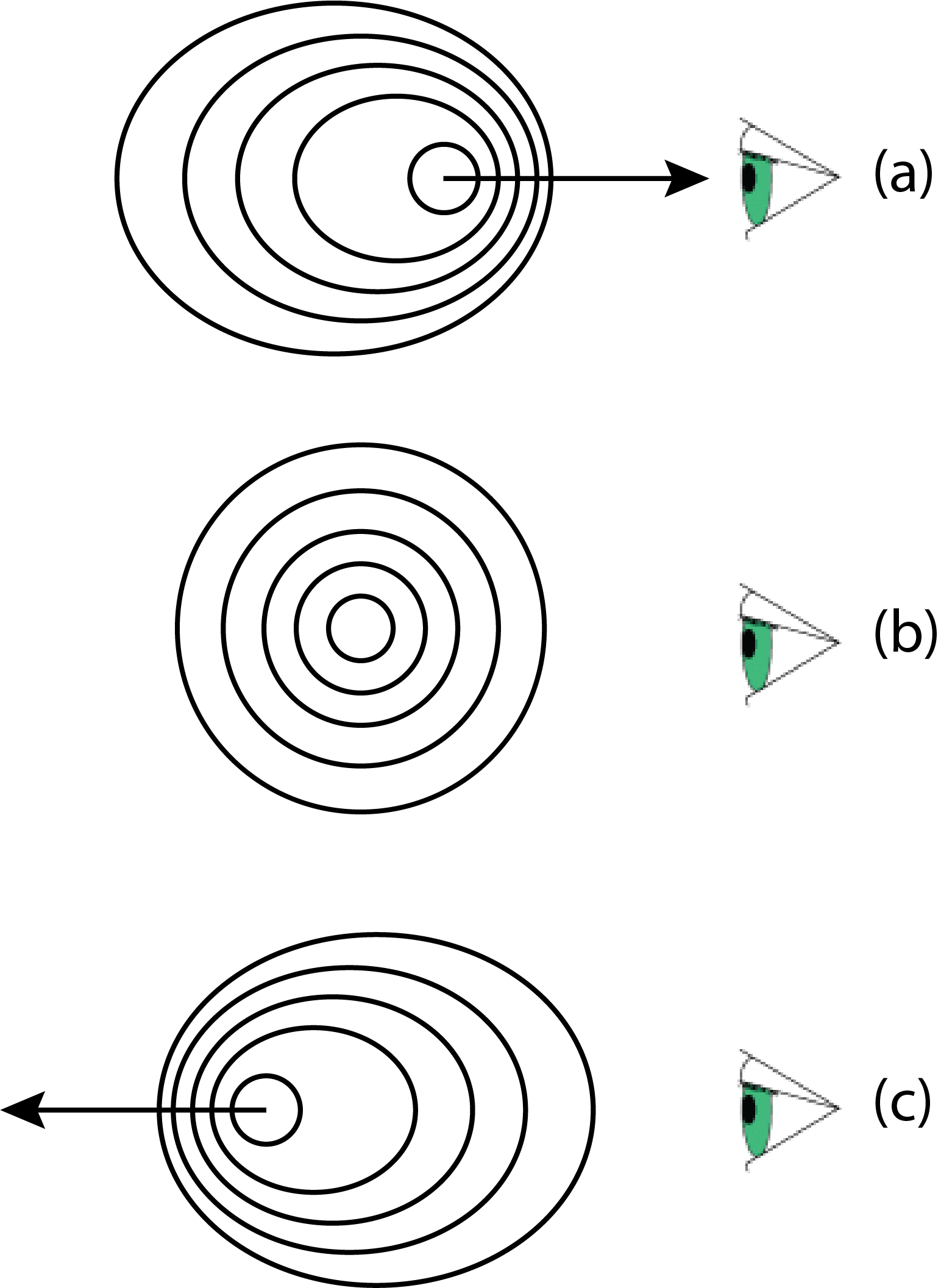
Los átomos están en constante movimiento, lo que significa que también experimentan colisiones constantes, cada una de las cuales resulta en un pequeño cambio en la energía de un electrón en el estado fundamental o en un estado excitado, y un cambio correspondiente en la longitud de onda emitida o absorbida. Este efecto se llama ensanchamiento de presión (o colisional). Como es el caso del ensanchamiento Doppler, el ensanchamiento de presión aumenta con la temperatura. Juntos, el ensanchamiento Doppler y el ensanchamiento de presión resultan en un aumento de aproximadamente 100 veces en el ancho de línea, con anchos de línea del orden de aproximadamente 10 —3 nm.
Efecto de la Temperatura en Espectros Atómicos
Como se señaló en el apartado anterior, la temperatura contribuye a la ampliación de las líneas de absorción atómica y emisión atómica. La temperatura también tiene un efecto sobre la intensidad de las líneas de emisión, ya que determina la población relativa de los diversos estados excitados de un átomo. La distribución de Boltzmann
\[\frac{N_i}{N_0} = \frac{P_i}{P_0} e^{-E_i/kT} \nonumber \]
da el número relativo de átomos en un estado excitado específico\(N_i\),, relativo al número de átomos en el estado fundamental,\(N_0\), en función de la diferencia en sus energías,\(E_i\), la constante de Boltzmann\(k\),, la temperatura en Kelvin\(T\),,\(P_i\) y\(P_0\) son factores estadísticos que dan cuenta del número de estados energéticos equivalentes para el estado excitado y el estado fundamental. La figura\(\PageIndex{5}\) muestra cómo la temperatura afecta el espectro de emisión atómica para dos líneas de emisión intensas de sodio a 589.0 y 589.6 nm para temperaturas de 2500 K a 7500 K. Obsérvese que la emisión a 2500 K es demasiado pequeña para aparecer usando una escala del eje y de intensidades absolutas. Un cambio en la temperatura de 5500 K a 4500 K reduce la intensidad de emisión en 62%. Como se puede adivinar a partir de esto, un pequeño cambio en la temperatura, tal vez tan solo 10 K, puede resultar en una disminución medible en la intensidad de emisión de unos pocos por ciento.
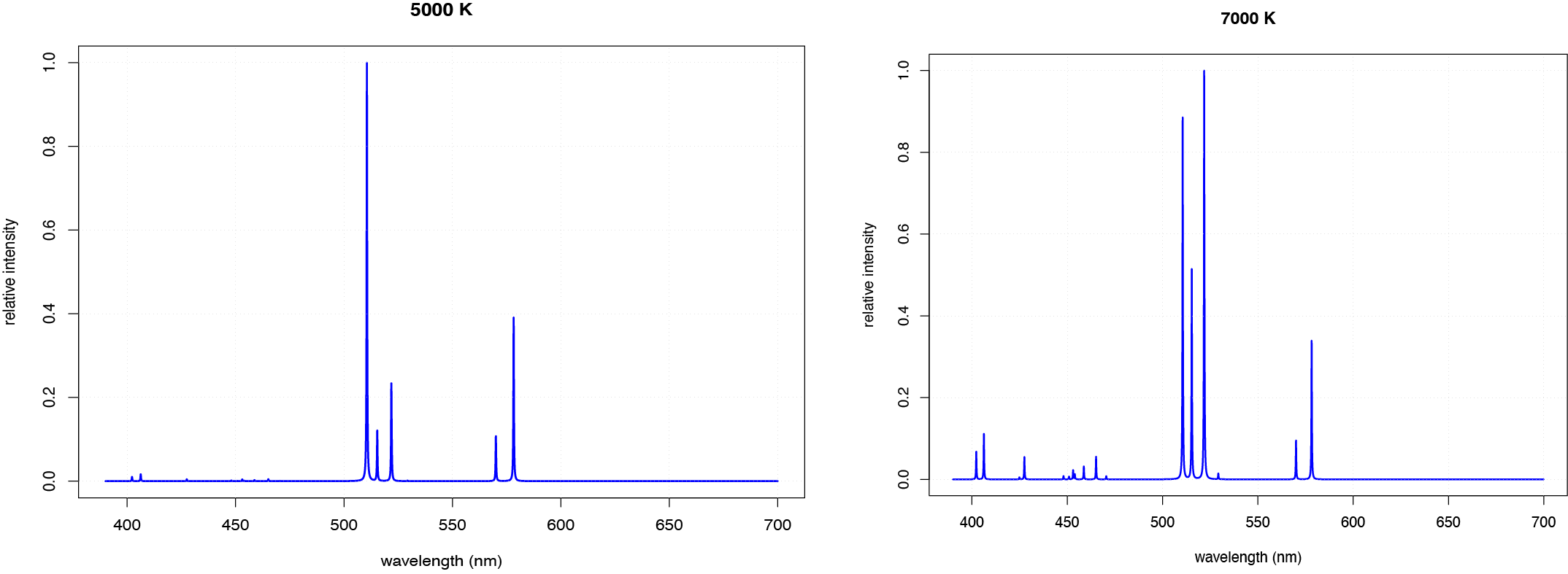
Un aumento en la temperatura también puede cambiar la intensidad relativa de emisión de diferentes líneas. La figura\(\PageIndex{6}\), por ejemplo, muestra los espectros de emisión atómica para cobre a 5000 K y 7000 K. A la temperatura más alta, la línea de emisión más intensa cambia de 510.55 nm a 521.82 nm, y varios picos adicionales entre 400 nm y 500 nm se vuelven más intensos.
Espectros de Banda y Continuo
Los espectros de emisión atómica para el sodio en la Figura\(\PageIndex{3}\) consisten en líneas discretas y estrechas debido a que surgen de la transición entre los niveles de energía discretos y bien definidos que se ven en la Figura\(\PageIndex{1}\). La emisión atómica de una llama también incluye contribuciones de dos fuentes adicionales: la emisión de especies moleculares que se forman en la llama y la emisión de la llama. Una muestra de agua, por ejemplo, es probable que contenga una variedad de iones, como Ca 2 +, que forman especies moleculares, como CaOH en la llama, y que emiten fotones en un rango mucho más amplio de longitudes de onda que los átomos. La llama, en sí misma, emite fotones en todo el rango de longitudes de onda utilizadas en la emisión atómica UV/Vis.


