14.4: Aplicaciones Cuantitativas
- Page ID
- 78517
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Ámbito
La determinación de la concentración de un analito basada en su absorción de radiación ultravioleta o visible es uno de los métodos analíticos cuantitativos más frecuentes. Una razón de su popularidad es que muchos compuestos orgánicos e inorgánicos tienen fuertes bandas de absorción en la región UV/Vis del espectro electromagnético. Además, si un analito no absorbe radiación UV/Vis, o si su absorbancia es demasiado débil, a menudo podemos reaccionar con otra especie que absorbe fuertemente. Por ejemplo, una solución diluida de Fe 2 + no absorbe la luz visible. Reaccionar Fe 2 + con o -fenantrolina, sin embargo, forma un complejo naranja-rojo\(\text{Fe(phen)}_3^{2+}\) que tiene una banda de absorbancia fuerte y ancha cerca de 500 nm. Una ventaja adicional de la absorción UV/Vis es que en la mayoría de los casos es relativamente fácil ajustar las condiciones experimentales e instrumentales para que se obedezca la ley de Beer.
Aplicaciones Ambientales
El análisis de aguas y aguas residuales a menudo se basa en la absorción de radiación ultravioleta y visible. Muchos de estos métodos se describen en la Tabla\(\PageIndex{1}\). Varios de estos métodos se describen aquí con más detalle.
| analito | método | \(\lambda\)(nm) |
|---|---|---|
| \ (\ lambda\) (nm) ">metales traza | ||
| aluminio | reaccionar con tinte de cianuro R de eriocromo a pH 6; forma complejo de rojo a rosa | \ (\ lambda\) (nm) ">535 |
| arsénico | reducir a Ash 3 usando Zn y reaccionar con dietilditiocarbamato de plata; forma complejo rojo | \ (\ lambda\) (nm) ">535 |
| cadmio | extraer en CHCl 3 que contiene ditizona de una muestra hecha básica con NaOH; forma complejo rosa a rojo | \ (\ lambda\) (nm) ">518 |
| cromo | oxidar a Cr (VI) y reaccionar con difenilcarbazida; forma 540 producto rojo-violeta | \ (\ lambda\) (nm) ">540 |
| cobre | reaccionar con neocuprina en solución neutra a ligeramente ácida y extraer en CHCl 3/CH 3 OH; forma complejo amarillo | \ (\ lambda\) (nm) ">457 |
| hierro | reducir a Fe 2 + y reaccionar con o -fenantrolina; forma complejo naranja-rojo | \ (\ lambda\) (nm) ">510 |
| plomo | extraer en CHCl 3 que contiene ditizona de muestra hecha básica con tampón NH 3/NH 4 +; forma complejo rojo cereza | \ (\ lambda\) (nm) ">510 |
| manganeso | oxidar a MnO 4 — con persulfato; forma solución púrpura | \ (\ lambda\) (nm) ">525 |
| mercurio | extraer en CHCl 3 que contiene ditizona de muestra ácida; forma complejo naranja | \ (\ lambda\) (nm) ">492 |
| zinc | reaccionar con zincon a pH 9; forma complejo azul | \ (\ lambda\) (nm) ">620 |
| \ (\ lambda\) (nm) ">no metales inorgánicos | ||
| amoníaco | reacción con hipoclorito y fenol usando un catalizador de sal manganosa 630; forma indofenol azul como producto | \ (\ lambda\) (nm) ">630 |
| cianuro | reaccionar con cloroamina-T para formar CNCl y luego con un ácido piridina-barbitúrico; forma un tinte rojo-azul | \ (\ lambda\) (nm) ">578 |
| fluoruro | reaccionar con el lago rojo Zr-Spadns; formación de ZrF 6 2 — disminuye el color del lago rojo | \ (\ lambda\) (nm) ">570 |
| cloro (residual) | reaccionar con violeta de cristal leuco; forma un producto azul | \ (\ lambda\) (nm) ">592 |
| nitrato | reaccionar con Cd para formar NO 2 — y luego reaccionar con sulfanilamida y N - (1-naftil) -etilendiamina; forma colorante azoico rojo 543 | \ (\ lambda\) (nm) ">543 |
| fosfato | reaccionar con molibdato de amonio y luego reducir con SnCl 2; forma azul de molibdeno | \ (\ lambda\) (nm) ">690 |
| \ (\ lambda\) (nm) ">orgánicos | ||
| fenol | reaccionar con 4-aminoantipirina y K 3 Fe (CN) 6; forma colorante antipirina amarillo | \ (\ lambda\) (nm) ">460 |
| tensioactivos aniónicos | reaccionar con colorante catiónico de azul de metileno y extraer en CHCl 3; forma un par iónico azul | \ (\ lambda\) (nm) ">652 |
Aunque el análisis cuantitativo de metales en aguas y aguas residuales se realiza principalmente por absorción atómica o espectroscopía de emisión atómica, muchos metales también se pueden analizar después de la formación de un complejo colorido metal-ligando. Una ventaja de estos métodos espectroscópicos es que se adaptan fácilmente al análisis de muestras en campo usando un fotómetro de filtro. Un ligando utilizado para el análisis de varios metales es la difeniltiocarbazona, también conocida como ditizona. La ditizona no es soluble en agua, pero cuando una solución de ditizona en CHCl 3 se agita con una solución acuosa que contiene un ion metálico apropiado, se forma un complejo metal-ditizonato coloreado que es soluble en CHCl 3. La selectividad de la ditizona se controla ajustando el pH de la muestra. Por ejemplo, Cd 2 + se extrae de soluciones hechas fuertemente básicas con NaOH, Pb 2 + de soluciones hechas básicas con un tampón NH 3/NH 4 +, y Hg 2 + de soluciones que son ligeramente ácidas.
La estructura de la ditizona se muestra a continuación.

Cuando se agrega cloro al agua, la porción disponible para la desinfección se llama cloro residual. Hay dos formas de cloro residual. El residuo de cloro libre incluye Cl 2, HOCl y OCl —. El cloro residual combinado, que se forma a partir de la reacción de NH 3 con HOCl, consiste en monocloramina, NH 2 Cl, dicloramina, NHCl 2 y tricloramina, NCl 3. Debido a que el residuo de cloro libre es más eficiente como desinfectante, existe un interés en métodos que puedan distinguir entre las diferentes formas del residuo de cloro total. Uno de esos métodos es el método del violeta de cristal leuco. El cloro residual libre se determina añadiendo violeta de cristal leuco a la muestra, el cual se oxida instantáneamente para dar un compuesto de color azul que se monitorea a 592 nm. Completar el análisis en menos de cinco minutos evita una posible interferencia del cloro residual combinado. El cloro residual total (libre + combinado) se determina haciendo reaccionar una muestra separada con yoduro, el cual reacciona con ambos residuos de cloro para formar HOI. Cuando se completa la reacción, se agrega violeta de cristal leuco y se oxida por HOI, dando el mismo producto de color azul. El cloro residual combinado se determina por diferencia.
La concentración de fluoruro en el agua potable está determinada indirectamente por su capacidad para formar un complejo con el circonio. En presencia del colorante SPADNS, una solución de circonio forma un compuesto de color rojo, llamado lago, que absorbe a 570 nm. Cuando se agrega fluoruro, la formación del\(\text{ZrF}_6^{2-}\) complejo estable provoca que una porción del lago se disocie, disminuyendo la absorbancia. Una gráfica de absorbancia versus la concentración de fluoruro, por lo tanto, tiene una pendiente negativa.
SPADNS, cuya estructura se muestra a continuación, es una abreviatura de la sal sódica del ácido 2- (4-sulfofenilazo) -1,8-dihidroxi-3,6-naftalenodisulfónico, que es un bocado para decir.

También se utilizan métodos espectroscópicos para determinar los constituyentes orgánicos en el agua. Por ejemplo, las concentraciones combinadas de fenol y fenoles orto y meta-sustituidos se determinan mediante destilación al vapor para separar los fenoles de las impurezas no volátiles. El destilado reacciona con 4-aminoantipirina a pH 7.9 ± 0.1 en presencia de K 3 Fe (CN) 6 a un tinte antipirina de color amarillo. Después de extraer el colorante en CHCl 3, se monitoriza su absorbancia a 460 nm. Se prepara una curva de calibración utilizando únicamente el fenol no substituido, C 6 H 5 OH. Debido a que la absortividad molar de los fenoles sustituidos generalmente es menor que la del fenol, la concentración reportada representa la concentración mínima de compuestos fenólicos.

4-aminoantipireno
La absorción molecular también se utiliza para el análisis de contaminantes atmosféricos significativos desde el punto de vista ambiental. En muchos casos el análisis se realiza recogiendo la muestra en agua, convirtiendo el analito en una forma acuosa que puede ser analizada por métodos como los descritos en la Tabla\(\PageIndex{1}\). Por ejemplo, la concentración de NO 2 se determina oxidando NO 2 a\(\text{NO}_3^-\). La concentración de\(\text{NO}_3^-\) se determina luego reduciéndola primero a\(\text{NO}_2^-\) con Cd, y luego reaccionando\(\text{NO}_2^-\) con sulfanilamida y N - (1-naftil) -etilendiamina para formar un colorante azoico rojo. Otra aplicación importante es el análisis para SO 2, el cual se determina mediante la recolección de la muestra en una solución acuosa de\(\text{HgCl}_4^{2-}\) donde reacciona para formar\(\text{Hg(SO}_3)_2^{2-}\). La adición de p-rosanilina y formaldehído produce un complejo púrpura que se monitorea a 569 nm. La absorción infrarroja es útil para el análisis de vapores orgánicos, incluyendo HCN, SO 2, nitrobenceno, metil mercaptano y cloruro de vinilo. Con frecuencia, estos análisis se realizan utilizando fotómetros infrarrojos portátiles dedicados.
Aplicaciones Clínicas
El análisis de muestras clínicas a menudo se complica por la complejidad de la matriz de la muestra, lo que puede contribuir a una absorción de fondo significativa a la longitud de onda deseada. La determinación de los barbitúricos séricos proporciona un ejemplo de cómo se supera este problema. Los barbitúricos se extraen primero de una muestra de suero con CHCl 3 y luego se extraen del CHCl 3 en NaOH 0.45 M (pH ≈ 13). La absorbancia del extracto acuoso se mide a 260 nm, e incluye contribuciones de los barbitúricos así como otros componentes extraídos de la muestra de suero. Luego se baja el pH de la muestra a aproximadamente 10 mediante la adición de NH 4 Cl y se vuelve a medir la absorbancia. Debido a que los barbitúricos no absorben a este pH, podemos usar la absorbancia a pH 10, A pH 10, para corregir la absorbancia a pH 13, A pH 13
\[A_\text{barb} = A_\text{pH 13} - \frac {V_\text{samp} + V_{\text{NH}_4\text{Cl}}} {V_\text{samp}} \times A_\text{pH 10} \nonumber \]
donde A barb es la absorbancia debida a los barbitúricos séricos y V samp y\(V_{\text{NH}_4\text{Cl}}\) son los volúmenes de muestra y NH 4 Cl, respectivamente. \(\PageIndex{2}\)La tabla proporciona un resumen de varios otros métodos para analizar muestras clínicas.
| analito | método | \(\lambda\)(nm) |
|---|---|---|
| proteína sérica total | reaccionar con NaOH y Cu 2 +; forma complejo azul-violeta | \ (\ lambda\) (nm) ">540 |
| colesterol sérico | reaccionar con Fe 3 + en presencia de isopropanol, ácido acético y H 2 SO 4; forma complejo azul-violeta | \ (\ lambda\) (nm) ">540 |
| ácido úrico | reaccionar con ácido fosfotungstico; forma azul de tungsteno | \ (\ lambda\) (nm) ">710 |
| barbituatos séricos | extraer en CHCl 3 para aislar de los interferentes y luego extraer en NaOH 0.45 M | \ (\ lambda\) (nm) ">260 |
| glucosa | reaccionar con o -toludina a 100 o C; forma complejo azul-verde | \ (\ lambda\) (nm) ">630 |
| yodo unido a proteínas | descomponer la proteína para liberar yoduro, que cataliza la reacción redox entre Ce 3 + y As 3 +; forma Ce 4 + de color amarillo | \ (\ lambda\) (nm) ">420 |
Aplicaciones Industriales
La absorción molecular UV/Vis se utiliza para el análisis de una amplia gama de muestras industriales, incluyendo productos farmacéuticos, alimentos, pintura, vidrio y metales. En muchos casos los métodos son similares a los descritos en Tabla\(\PageIndex{1}\) y en Tabla\(\PageIndex{2}\). Por ejemplo, la cantidad de hierro en los alimentos se determina poniendo el hierro en solución y analizándolo utilizando el método de o -fenantrolina listado en la Tabla\(\PageIndex{1}\).
Muchos compuestos farmacéuticos contienen cromóforos que los hacen adecuados para su análisis por absorción UV/Vis. Los productos analizados de esta manera incluyen antibióticos, hormonas, vitaminas y analgésicos. Un ejemplo del uso de la absorción UV es en la determinación de la pureza de las tabletas de aspirina, para lo cual el ingrediente activo es el ácido acetilsalicílico. El ácido salicílico, que se produce por la hidrólisis del ácido acetilsalicílico, es una impureza indeseable en los comprimidos de aspirina, y no debe estar presente a más de 0.01% w/w; las muestras se tamizan para detectar niveles inaceptables de ácido salicílico monitoreando la absorbancia a una longitud de onda de 312 nm. El ácido acetilsalicílico absorbe a 280 nm, pero absorbe mal a 312 nm. Se eligen las condiciones para preparar la muestra de manera que una absorbancia mayor a 0.02 signifique un nivel inaceptable de ácido salicílico.
Aplicaciones Forenses
La absorción molecular UV/Vis se utiliza rutinariamente para el análisis de narcóticos y para pruebas de drogas. Una aplicación forense interesante es la determinación de alcohol en sangre mediante la prueba de alcoholímetro. En esta prueba se burbujea una muestra de aliento de 52.5-mL a través de una solución acidificada de K 2 Cr 2 O 7, que oxida el etanol a ácido acético. La concentración de etanol en la muestra de aliento se determina por una disminución en la absorbancia a 440 nm donde absorbe el ion dicromato. Un contenido de alcohol en sangre de 0.10%, que está por encima del límite legal, corresponde a 0.025 mg de etanol en la muestra de aliento.
Desarrollo de un método cuantitativo para un solo componente
Para desarrollar un método analítico cuantitativo, se deben establecer las condiciones bajo las cuales se obedece la ley de Beer. Primero, la longitud de onda más apropiada para el análisis se determina a partir de un espectro de absorción. En la mayoría de los casos la mejor longitud de onda corresponde a un máximo de absorción porque proporciona mayor sensibilidad y es menos susceptible a limitaciones instrumentales. Segundo, si el instrumento tiene ranuras ajustables, entonces se elige un ancho de hendidura apropiado. El espectro de absorción también ayuda a seleccionar un ancho de hendidura al elegir un ancho que sea lo suficientemente estrecho como para evitar limitaciones instrumentales a la ley de Beer, pero lo suficientemente amplio como para aumentar el rendimiento de la radiación de la fuente. Finalmente, se construye una curva de calibración para determinar el rango de concentraciones para el cual es válida la ley de Beer. Consideraciones adicionales que son importantes en cualquier método cuantitativo son el efecto de los potenciales interferentes y el establecimiento de un blanco apropiado.
Análisis cuantitativo para una sola muestra
Para determinar la concentración de un analito medimos su absorbancia y aplicamos la ley de Beer utilizando cualquiera de los métodos de estandarización descritos en el Capítulo 5. Los métodos más comunes son una curva de calibración normal utilizando estándares externos y el método de adiciones estándar. También es posible una estandarización de un solo punto, aunque primero debemos verificar que la ley de Beer es válida para la concentración de analito en las muestras y el estándar.
La determinación de hierro en una corriente de residuos industriales se realiza mediante la o-fenantrolina descrita en el Método Representativo 10.3.1. Utilizando los datos de la siguiente tabla, determinar los mg Fe/L en el flujo de desechos.
| mg Fe/L | absorbancia |
|---|---|
| 0.00 | 0.000 |
| 1.00 | 0.183 |
| 2.00 | 0.364 |
| 3.00 | 0.546 |
| 4.00 | 0.727 |
| muestra | 0.269 |
Solución
La regresión lineal de la absorbancia frente a la concentración de Fe en los patrones da la curva de calibración y la ecuación de calibración que se muestran aquí

\[A=0.0006+\left(0.1817 \ \mathrm{mg}^{-1} \mathrm{L}\right) \times(\mathrm{mg} \mathrm{Fe} / \mathrm{L}) \nonumber \]
Sustituyendo la absorbancia de la muestra en la ecuación de calibración da la concentración de Fe en la corriente residual como 1.48 mg Fe/L
La concentración de Cu 2 + en una muestra se determina haciéndola reaccionar con el ligando cuprizona y midiendo su absorbancia a 606 nm en una celda de 1.00-cm. Cuando una muestra de 5.00-mL es tratada con cuprizona y diluida a 10.00 mL, la solución resultante tiene una absorbancia de 0.118. Una segunda muestra de 5.00-mL se mezcla con 1.00 mL de un estándar de 20.00 mg/L de Cu 2 +, se trata con cuprizona y se diluye a 10.00 mL, dando una absorbancia de 0.162. Reportan los mg Cu 2 + /L en la muestra.
- Contestar
-
Para esta adición estándar escribimos ecuaciones que relacionan la absorbancia con la concentración de Cu 2 + en la muestra antes de la adición estándar
\[0.118=\varepsilon b \left[ C_{\mathrm{Cu}} \times \frac{5.00 \text{ mL}}{10.00 \text{ mL}}\right] \nonumber \]
y después de la adición estándar
\[0.162=\varepsilon b\left(C_{\mathrm{Cu}} \times \frac{5.00 \text{ mL}}{10.00 \text{ mL}}+\frac{20.00 \ \mathrm{mg} \ \mathrm{Cu}}{\mathrm{L}} \times \frac{1.00 \ \mathrm{mL}}{10.00 \ \mathrm{mL}}\right) \nonumber \]
en cada caso contabilizando la dilución de la muestra original y del estándar. El valor de\(\varepsilon b\) es el mismo en ambas ecuaciones. Resolver cada ecuación para\(\varepsilon b\) e igualar
\[\frac{0.162}{C_{\mathrm{Cu}} \times \frac{5.00 \text{ mL}}{10.00 \text{ mL}}+\frac{20.00 \ \mathrm{mg} \ \mathrm{Cu}}{\mathrm{L}} \times \frac{1.00 \ \mathrm{mL}}{10.00 \ \mathrm{mL}}}=\frac{0.118}{C_{\mathrm{Cu}} \times \frac{5.00 \text{ mL}}{10.00 \text{ mL}}} \nonumber \]
nos deja con una ecuación en la que C Cu es la única variable. Resolviendo para C Cu da su valor como
\[\frac{0.162}{0.500 \times C_{\mathrm{Cu}}+2.00 \ \mathrm{mg} \ \mathrm{Cu} / \mathrm{L}}=\frac{0.118}{0.500 \times C_{\mathrm{Cu}}} \nonumber \]
\[0.0810 \times C_{\mathrm{Cu}}=0.0590 \times C_{\mathrm{Ca}}+0.236 \ \mathrm{mg} \ \mathrm{Cu} / \mathrm{L} \nonumber \]
\[0.0220 \times C_{\mathrm{Cu}}=0.236 \ \mathrm{mg} \ \mathrm{Cu} / \mathrm{L} \nonumber \]
\[C_{\mathrm{Cu}}=10.7 \ \mathrm{mg} \ \mathrm{Cu} / \mathrm{L} \nonumber \]
Análisis cuantitativo de mezclas
Supongamos que necesitamos determinar la concentración de dos analitos, X e Y, en una muestra. Si cada analito tiene una longitud de onda donde el otro analito no absorbe, entonces podemos proceder utilizando el enfoque del Ejemplo 14.4.1 . Desafortunadamente, las bandas de absorción UV/Vis son tan amplias que frecuentemente no es posible encontrar longitudes de onda adecuadas. Debido a que la ley de Beer es aditiva la absorbancia de la mezcla, Una mezcla, es
\[\left(A_{m i x}\right)_{\lambda_{1}}=\left(\varepsilon_{x}\right)_{\lambda_{1}} b C_{X}+\left(\varepsilon_{Y}\right)_{\lambda_{1}} b C_{Y} \label{10.1} \]
donde\(\lambda_1\) es la longitud de onda a la que medimos la absorbancia. Debido a que la Ecuación\ ref {10.1} incluye términos para la concentración tanto de X como de Y, la absorbancia a una longitud de onda no proporciona suficiente información para determinar C X o C Y. Si medimos la absorbancia a una segunda longitud de onda
\[\left(A_{m i x}\right)_{\lambda_{2}}=\left(\varepsilon_{x}\right)_{\lambda_{2}} b C_{X}+\left(\varepsilon_{Y}\right)_{\lambda_{2}} b C_{Y} \label{10.2} \]
entonces podemos determinar C X y C Y resolviendo simultáneamente la Ecuación\ ref {10.1} y la Ecuación\ ref {10.2}. Por supuesto, también debemos determinar el valor para\(\varepsilon_X\) y\(\varepsilon_Y\) en cada longitud de onda. Para una mezcla de n componentes, debemos medir la absorbancia a n longitudes de onda diferentes.
Las concentraciones de Fe 3 + y Cu 2 + en una mezcla se determinan siguiendo su reacción con hexacyanorutenato (II)\(\text{Ru(CN)}_6^{4-}\), que forma un complejo púrpura-azul con Fe 3 + (\(\lambda_\text{max}\)= 550 nm) y un complejo verde pálido con Cu 2 + (\(\lambda_\text{max}\)= 396 nm) [DiTUSA, M. R.; Schlit, A. A. J. Chem. Educ. 1985, 62, 541—542]. Las absorbilidades molares (M —1 cm —1) para los complejos metálicos en las dos longitudes de onda se resumen en la siguiente tabla.
| analito | \(\varepsilon_{550}\) | \(\varepsilon_{396}\) |
|---|---|---|
| Fe 3 + | \ (\ varepsilon_ {550}\) ">9970 | \ (\ varepsilon_ {396}\) ">84 |
| Cu 2 + | \ (\ varepsilon_ {550}\) ">34 | \ (\ varepsilon_ {396}\) ">856 |
Cuando se analiza una muestra que contiene Fe 3 + y Cu 2 + en una celda con una longitud de trayectoria de 1.00 cm, la absorbancia a 550 nm es 0.183 y la absorbancia a 396 nm es 0.109. ¿Cuáles son las concentraciones molares de Fe 3 + y Cu 2 + en la muestra?
Solución
Sustituir valores conocidos en Ecuación\ ref {10.1} y Ecuación\ ref {10.2} da
\[\begin{aligned} A_{550} &=0.183=9970 C_{\mathrm{Fe}}+34 C_{\mathrm{Cu}} \\ A_{396} &=0.109=84 C_{\mathrm{Fe}}+856 C_{\mathrm{Cu}} \end{aligned} \nonumber \]
Para determinar C Fe y C Cu resolvemos la primera ecuación para C Cu
\[C_{\mathrm{Cu}}=\frac{0.183-9970 C_{\mathrm{Fe}}}{34} \nonumber \]
y sustituir el resultado en la segunda ecuación.
\[\begin{aligned} 0.109 &=84 C_{\mathrm{Fe}}+856 \times \frac{0.183-9970 C_{\mathrm{Fe}}}{34} \\ &=4.607-\left(2.51 \times 10^{5}\right) C_{\mathrm{Fe}} \end{aligned} \nonumber \]
Resolviendo para C Fe da la concentración de Fe 3 + como\(1.8 \times 10^{-5}\) M. Sustituyendo esta concentración de nuevo en la ecuación por la absorbancia de la mezcla a 396 nm da la concentración de Cu 2 + como\(1.3 \times 10^{-4}\) M.
Otro enfoque para resolver Ejemplo 14.4.2 es multiplicar la primera ecuación por 856/34 dando
\[4.607=251009 C_{\mathrm{Fe}}+856 C_\mathrm{Cu} \nonumber \]
Restar la segunda ecuación de esta ecuación
\[\begin{aligned} 4.607 &=251009 C_{\mathrm{Fe}}+856 C_{\mathrm{Cu}} \\-0.109 &=84 C_{\mathrm{Fe}}+856 C_{\mathrm{Cu}} \end{aligned} \nonumber \]
da
\[4.498=250925 C_{\mathrm{Fe}} \nonumber \]
y nos encontramos con que C Fe es\(1.8 \times 10^{-5}\). Habiendo determinado C Fe podemos sustituir de nuevo en una de las otras ecuaciones para resolver por C Cu, que es\(1.3 \times 10^{-5}\).
Los espectros de absorbancia para Cr 3 + y Co 2 + se superponen significativamente. Para determinar la concentración de estos analitos en una mezcla, se mide su absorbancia a 400 nm y a 505 nm, dando valores de 0.336 y 0.187, respectivamente. Las absorbilidades molares individuales (M —1 cm —1) para Cr3 + son 15.2 a 400 nm y 0.533 a 505 nm; los valores para Co 2 + son 5.60 a 400 nm y 5.07 a 505 nm.
- Contestar
-
Sustituyendo en Ecuación\ ref {10.1} y Ecuación\ ref {10.2} da
\[A_{400} = 0.336 = 15.2C_\text{Cr} + 5.60C_\text{Co} \nonumber \]
\[A_{400} = 0187 = 0.533C_\text{Cr} + 5.07C_\text{Co} \nonumber \]
Para determinar C Cr y C Co resolvemos la primera ecuación para C Co
\[C_{\mathrm{Co}}=\frac{0.336-15.2 \mathrm{C}_{\mathrm{Co}}}{5.60} \nonumber \]
y sustituir el resultado en la segunda ecuación.
\[0.187=0.533 C_{\mathrm{Cr}}+5.07 \times \frac{0.336-15.2 C_{\mathrm{Co}}}{5.60} \nonumber \]
\[0.187=0.3042-13.23 C_{\mathrm{Cr}} \nonumber \]
Resolviendo para C Cr da la concentración de Cr 3 + como\(8.86 \times 10^{-3}\) M. Sustituyendo esta concentración de nuevo en la ecuación por la absorbancia de la mezcla a 400 nm da la concentración de Co 2 + como\(3.60 \times 10^{-2}\) M.
Para obtener resultados con buena precisión y precisión se deben seleccionar las dos longitudes de onda de manera que\(\varepsilon_X > \varepsilon_Y\) a una longitud de onda y\(\varepsilon_X < \varepsilon_Y\) a la otra longitud de onda. Es fácil apreciar por qué esto es cierto. Debido a que la absorbancia en cada longitud de onda está dominada por un analito, cualquier incertidumbre en la concentración del otro analito tiene menor impacto. La figura\(\PageIndex{q}\) muestra que la elección de longitudes de onda para el ejercicio de práctica 14.4.2 son razonables. Cuando la elección de longitudes de onda no es obvia, un método para localizar las longitudes de onda óptimas es graficar\(\varepsilon_X / \varepsilon_y\) como función de la longitud de onda, y determinar las longitudes de onda donde\(\varepsilon_X / \varepsilon_y\) alcanza los valores máximos y mínimos [Mehra, M. C.; Rioux, J. J. Chem. Educ. 1982, 59, 688—689].
Cuando los espectros del analito se superponen severamente, de tal manera que\(\varepsilon_X \approx \varepsilon_Y\) en todas las longitudes de onda, otros métodos computacionales pueden proporcionar una mejor precisión y precisión. En un análisis de regresión lineal multilongitud de onda, por ejemplo, se compara la absorbancia de una mezcla con la de un conjunto de soluciones estándar a varias longitudes de onda [Blanco, M.; Iturriaga, H.; Maspoch, S.; Tarin, P. J. Chem. Educ. 1989, 66, 178—180]. Si A SX y A SY son los valores de absorbancia para soluciones estándar de los componentes X e Y en cualquier longitud de onda, entonces
\[A_{SX}=\varepsilon_{X} b C_{SX} \label{10.3} \]
\[A_{SY}=\varepsilon_{Y} b C_{SY} \label{10.4} \]
donde C SX y C SY son las concentraciones conocidas de X e Y en las soluciones estándar. Resolviendo la ecuación\ ref {10.3} y la ecuación\ ref {10.4} para\(\varepsilon_X\) y para\(\varepsilon_Y\), sustituyendo en la ecuación\ ref {10.1}, y reordenando, da
\[\frac{A_{\operatorname{mix}}}{A_{S X}}=\frac{C_{X}}{C_{S X}}+\frac{C_{Y}}{C_{S Y}} \times \frac{A_{S Y}}{A_{S X}} \nonumber \]
Para determinar C X y C Y, la absorbancia de la mezcla y las absorbancias de las soluciones estándar se miden a varias longitudes de onda. Graficando Una mezcla/A SX versus A SY/A SX da una línea recta con una pendiente de C Y/ C SY y una intercepción y de C X/C SX. Este enfoque es particularmente útil cuando no es posible encontrar longitudes de onda donde\(\varepsilon_X > \varepsilon_Y\) y\(\varepsilon_X < \varepsilon_Y\).
El enfoque descrito aquí para una regresión lineal multilongitud de onda utiliza una única solución estándar para cada analito. Un enfoque más riguroso utiliza múltiples estándares para cada analito. La matemática detrás del análisis de tales datos —que llamamos regresión lineal múltiple— está más allá del nivel de este texto. Para más detalles sobre regresión lineal múltiple ver Brereton, R. G. Chemometrics: Data Analysis for the Laboratory and Chemical Plant, Wiley: Chichester, Inglaterra, 2003.
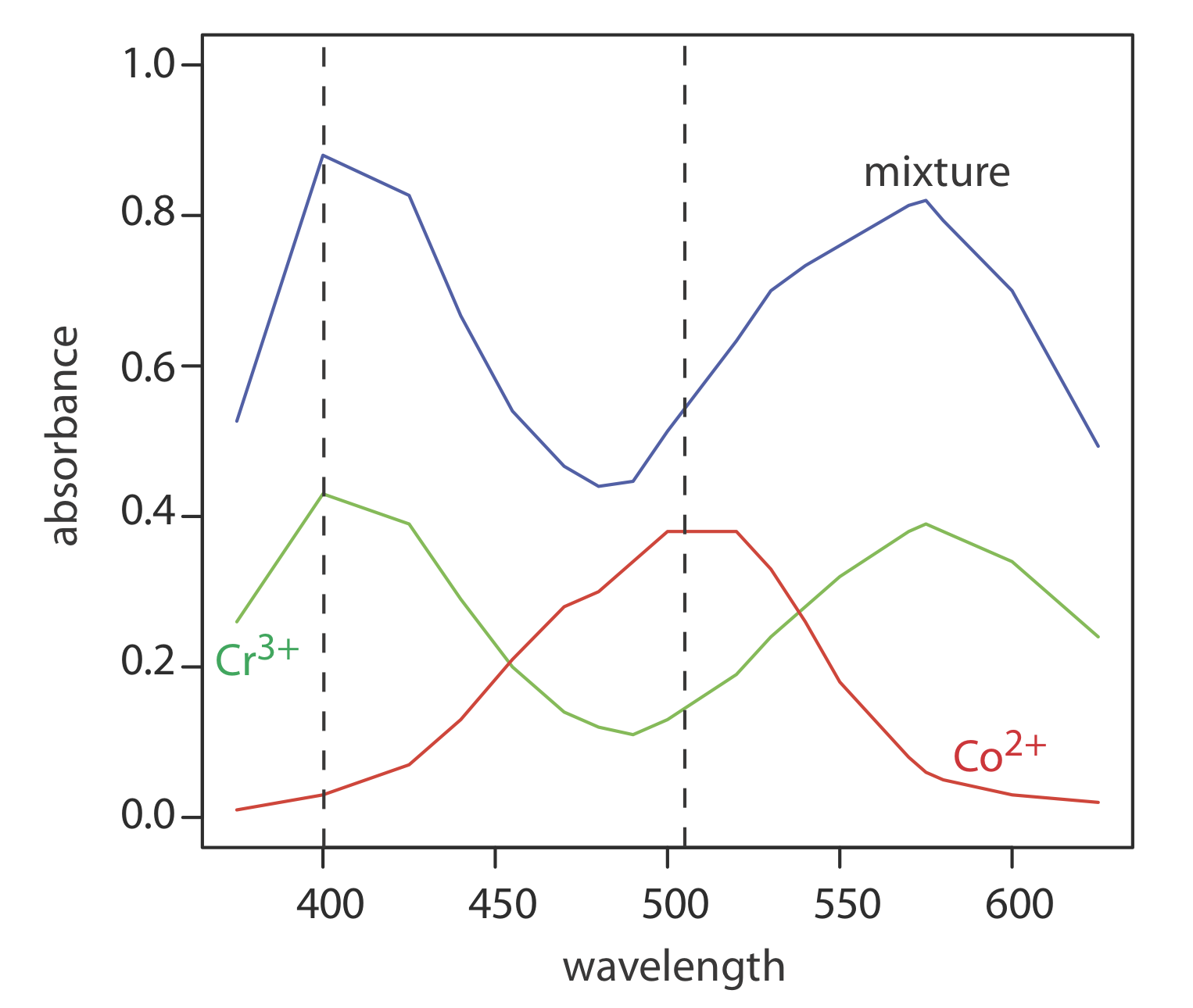
La Figura\(\PageIndex{1}\) muestra espectros de absorbancia visibles para una solución estándar de 0.0250 M Cr 3 +, una solución estándar de 0.0750 M Co 2 +, y una mezcla que contiene concentraciones desconocidas de cada ion. Aquí se muestran los datos de estos espectros.
| \(\lambda\)(nm) | A Cr | A Cu | Una mezcla | \(\lambda\)(nm) | A Cr | A Cu | Una mezcla |
|---|---|---|---|---|---|---|---|
| \ (\ lambda\) (nm) ">375 | 0.26 | 0.01 | 0.53 | \ (\ lambda\) (nm) ">520 | 0.19 | 0.38 | 0.63 |
| \ (\ lambda\) (nm) ">400 | 0.43 | 0.03 | 0.88 | \ (\ lambda\) (nm) ">530 | 0.24 | 0.33 | 0.70 |
| \ (\ lambda\) (nm) ">425 | 0.39 | 0.07 | 0.83 | \ (\ lambda\) (nm) ">540 | 0.28 | 0.26 | 0.73 |
| \ (\ lambda\) (nm) ">440 | 0.29 | 0.13 | 0.67 | \ (\ lambda\) (nm) ">550 | 0.32 | 0.18 | 0.76 |
| \ (\ lambda\) (nm) ">455 | 0.20 | 0.21 | 0.54 | \ (\ lambda\) (nm) ">570 | 0.38 | 0.08 | 0.81 |
| \ (\ lambda\) (nm) ">470 | 0.14 | 0.28 | 0.47 | \ (\ lambda\) (nm) ">575 | 0.39 | 0.06 | 0.82 |
| \ (\ lambda\) (nm) ">480 | 0.12 | 0.30 | 0.44 | \ (\ lambda\) (nm) ">580 | 0.38 | 0.05 | 0.79 |
| \ (\ lambda\) (nm) ">490 | 0.11 | 0.34 | 0.45 | \ (\ lambda\) (nm) ">600 | 0.34 | 0.03 | 0.70 |
| \ (\ lambda\) (nm) ">500 | 0.13 | 0.38 | 0.51 | \ (\ lambda\) (nm) ">625 | 0.24 | 0.02 | 0.49 |
Utilizar un análisis de regresión multilongitud de onda para determinar la composición de lo desconocido.
Solución
Primero necesitamos calcular los valores para A mix/A SX y para A SY/A SX. Definamos X como Co 2 + e Y como Cr 3 +. Por ejemplo, a una longitud de onda de 375 nm Una mezcla/A SX es 0.53/0.01, o 53 y A SY/A SX es 0.26/0.01, o 26. Completar el cálculo para todas las longitudes de onda y graficar una mezcla/A SX versus A SY/A SX da la curva de calibración mostrada en la Figura\(\PageIndex{2}\). Ajustar una línea recta a los datos da un modelo de regresión de
\[\frac{A_{\operatorname{mix}}}{A_{S X}}=0.636+2.01 \times \frac{A_{S Y}}{A_{S X}} \nonumber \]
Usando la intersección y, la concentración de Co 2 + es
\[\frac{C_{X}}{C_{S X}}=\frac{\left[\mathrm{Co}^{2+}\right]}{0.0750 \mathrm{M}}=0.636 \nonumber \]
o [Co 2 +] = 0.048 M; usando la pendiente la concentración de Cr 3 + es
\[\frac{C_{Y}}{C_{S Y}}=\frac{\left[\mathrm{Cr}^{3+}\right]}{0.0250 \mathrm{M}}=2.01 \nonumber \]
o [Cr 3 +] = 0.050 M.

Una mezcla de\(\text{MnO}_4^{-}\) y\(\text{Cr}_2\text{O}_7^{2-}\), y estándares de 0.10 mM KMnO 4 y de 0.10 mM K 2 Cr 2 O 7 dan los resultados que se muestran en la siguiente tabla. Determinar la composición de la mezcla. Los datos para este problema son de Blanco, M. C.; Iturriaga, H.; Maspoch, S.; Tarin, P. J. Chem. Educ. 1989, 66, 178—180.
| \(\lambda\)(nm) | A Mn | A Cr | Una mezcla |
|---|---|---|---|
| \ (\ lambda\) (nm) ">266 | 0.042 | 0.410 | 0.766 |
| \ (\ lambda\) (nm) ">288 | 0.082 | 0.283 | 0.571 |
| \ (\ lambda\) (nm) ">320 | 0.168 | 0.158 | 0.422 |
| \ (\ lambda\) (nm) ">350 | 0.125 | 0.318 | 0.672 |
| \ (\ lambda\) (nm) ">360 | 0.036 | 0.181 | 0.366 |
- Contestar
-
Dejando que X represente\(\text{MnO}_4^{-}\) y dejando que Y represente\(\text{Cr}_2\text{O}_7^{2-}\), trazamos la ecuación
\[\frac{A_{\operatorname{mix}}}{A_{SX}}=\frac{C_{X}}{C_{SX}}+\frac{C_{Y}}{C_{S Y}} \times \frac{A_{S Y}}{A_{SX}} \nonumber \]
colocando una mezcla/A SX en el eje y y A SY/A SX en el eje x. Por ejemplo, a una longitud de onda de 266 nm el valor A mix/A SX de es 0.766/0.042, o 18.2, y el valor de A SY/A SX es 0.410 /0.042, o 9.76. Completar los cálculos para todas las longitudes de onda y trazar los datos da el resultado que se muestra aquí

Ajustar una línea recta a los datos da un modelo de regresión de
\[\frac{A_{\text { mix }}}{A_{\text { SX }}}=0.8147+1.7839 \times \frac{A_{SY}}{A_{SX}} \nonumber \]
Usando la intercepción y, la concentración\(\text{MnO}_4^{-}\) de
\[\frac{C_{X}}{C_{S X}}=0.8147=\frac{\left[\mathrm{MnO}_{4}^{-}\right]}{1.0 \times 10^{-4} \ \mathrm{M} \ \mathrm{MnO}_{4}^{-}} \nonumber \]
o\(8.15 \times 10^{-5}\) M\(\text{MnO}_4^{-}\), y usando la pendiente, la concentración de\(\text{Cr}_2\text{O}_7^{2-}\) es
\[\frac{C_{Y}}{C_{S Y}}=1.7839=\frac{\left[\mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}\right]}{1.00 \times 10^{-4} \ \mathrm{M} \ \text{Cr}_{2} \mathrm{O}_{7}^{2-}} \nonumber \]
o\(1.78 \times 10^{-4}\)\(\text{Cr}_2\text{O}_7^{2-}\) M.
Espectroscopia derivada
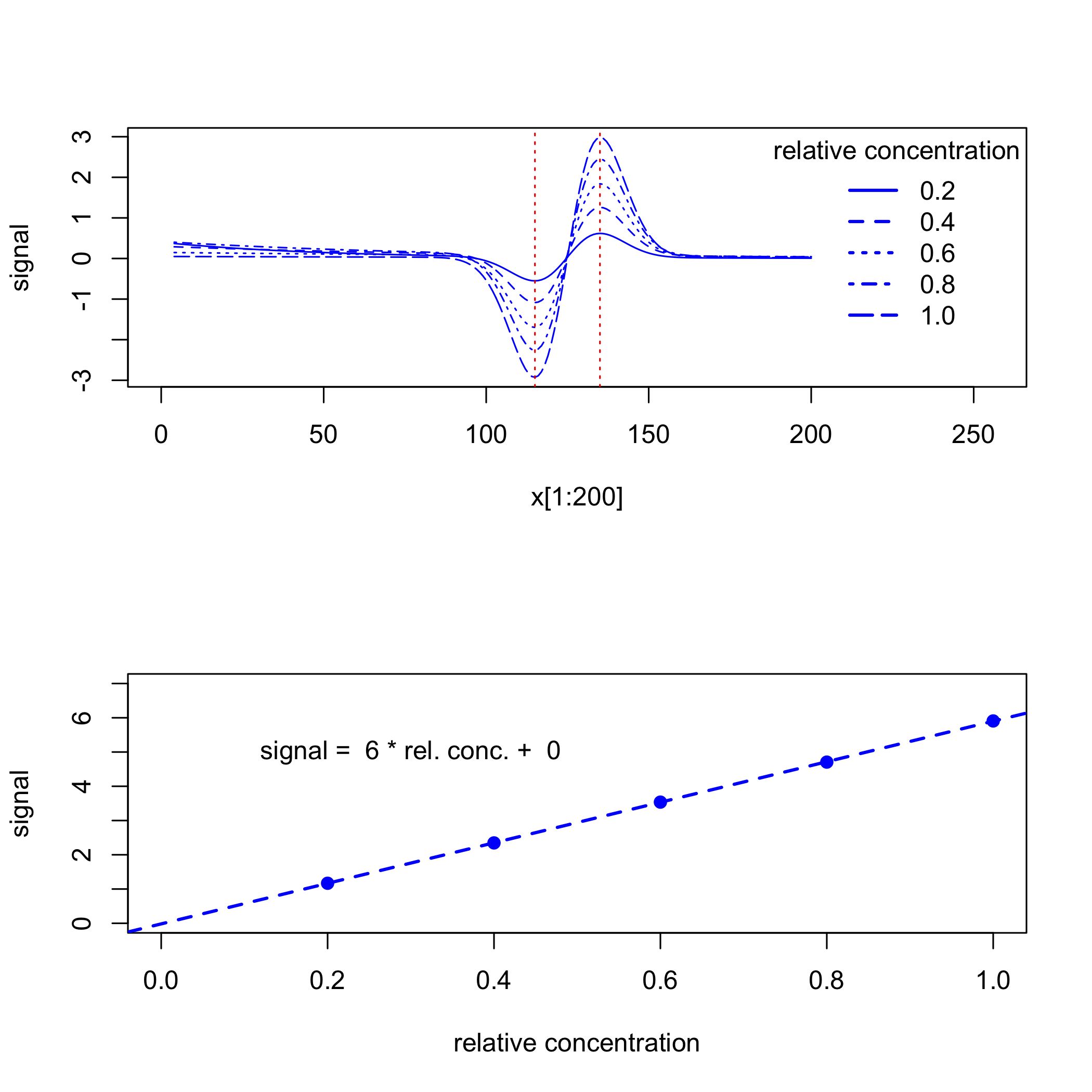
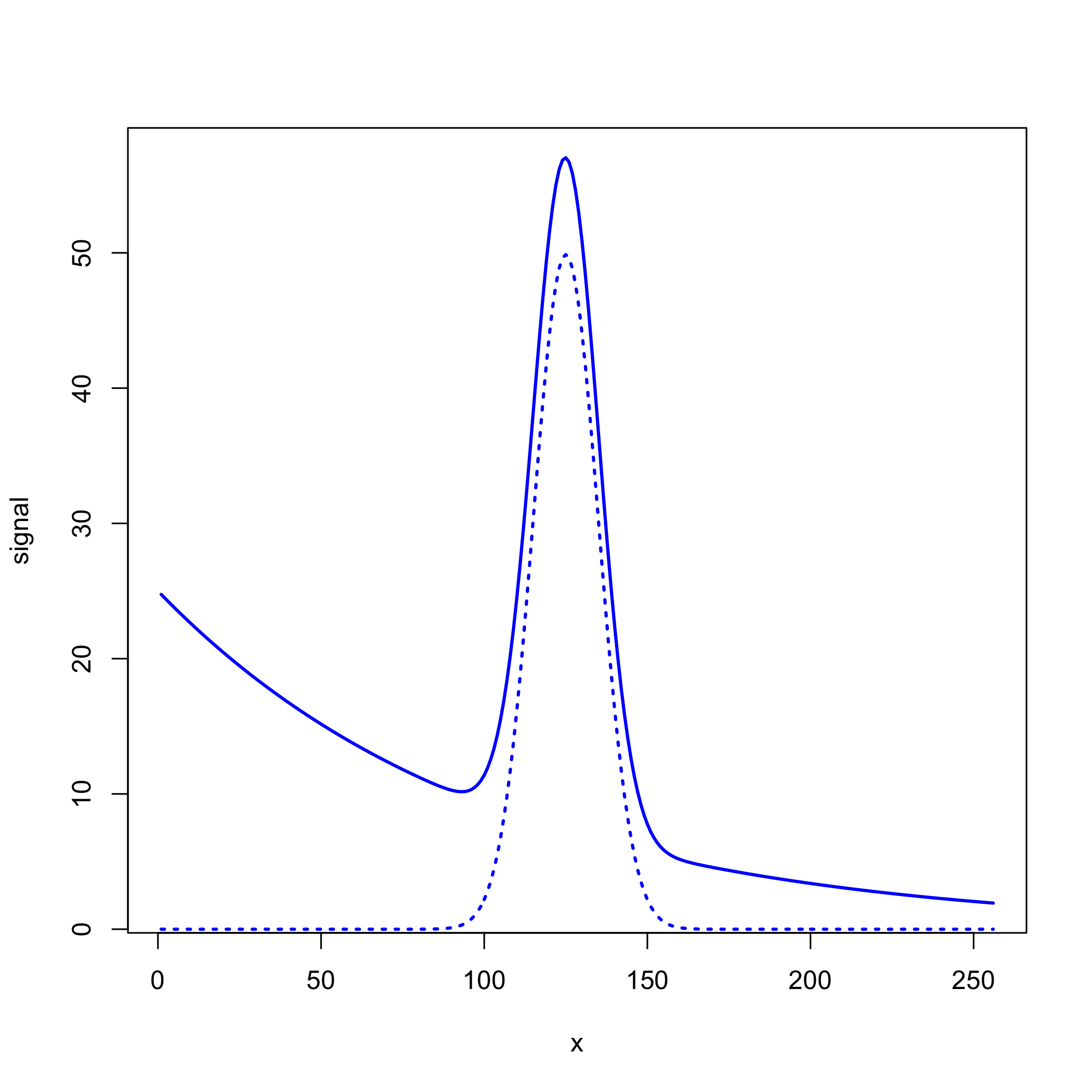
En ocasiones nuestra señal se superpone sobre una señal de fondo, lo que complica nuestro análisis porque la absorbancia medida tiene contribuciones tanto de nuestro analito como del fondo. Por ejemplo, la siguiente figura muestra una señal gaussiana con un valor máximo de 50 centrado en\(x = 125\) que se superpone sobre un fondo exponencial. La línea punteada es la señal gaussiana, que tiene un valor máximo de 50 at\(x = 125\), y la línea continua es la señal medida, que tiene un valor máximo de 57 at\(x = 125\).
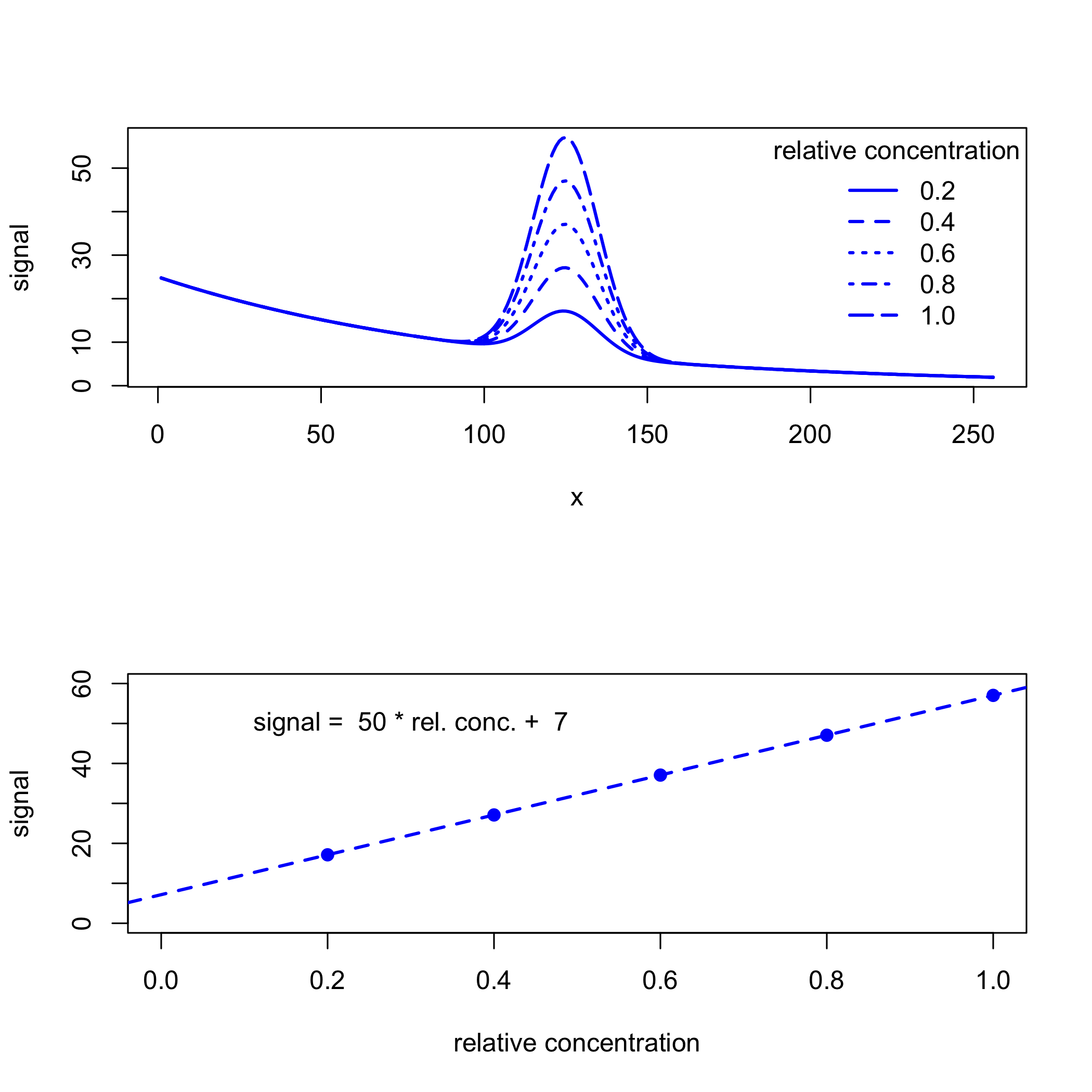
Si la señal de fondo es consistente en todas las muestras, entonces podemos analizar los datos sin eliminar primero su contribución. Por ejemplo, la siguiente figura muestra un conjunto de estándares de calibración y su curva de calibración resultante, para lo cual la intercepción y de 7 da el desplazamiento introducido por el fondo.
Pero las señales de fondo a menudo no son consistentes entre las muestras, particularmente cuando la fuente del fondo es una propiedad de las muestras que recolectamos (las muestras de agua natural, por ejemplo, pueden tener variaciones de color debido a diferencias en la concentración de materia orgánica disuelta) o una propiedad del instrumento que estamos utilizando (como una variación en la intensidad de la fuente a lo largo del tiempo). Cuando son ciertos, nuestros datos pueden parecerse más a lo que vemos en la siguiente figura, lo que lleva a una curva de calibración con una mayor incertidumbre.
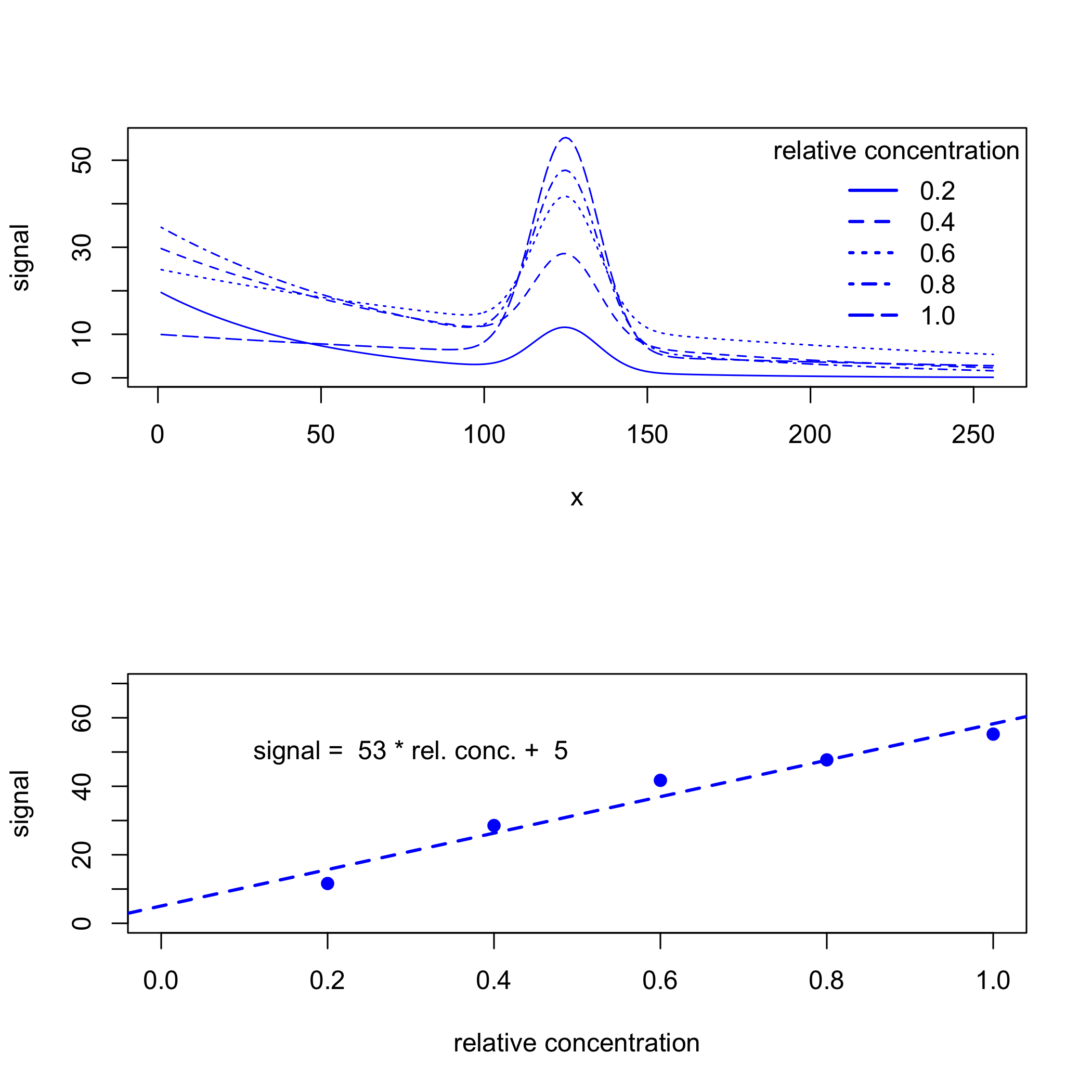
Debido a que el fondo cambia gradualmente con los valores para x mientras que la señal del analito cambia rápidamente, podemos usar una derivada para distinguir entre los dos. Un enfoque es calcular y trazar la derivada\(\frac{\Delta y}{\Delta x}\), en función de\(x\), como se muestra en la Figura\(\PageIndex{6}\). La señal de calibración en este caso es la diferencia entre la señal máxima y la señal mínima, las cuales se muestran por las líneas rojas punteadas en la parte superior de la figura. El ajuste de la curva de calibración a los datos y la intercepción y de cero de la curva de calibración muestra que hemos compensado satisfactoriamente las señales de fondo.