15.1: Teoría de Fluorescencia y Fosforescencia
- Page ID
- 78840
El uso de fluorescencia molecular para análisis cualitativos y semicuantitativos data de principios a mediados del siglo XIX, con métodos cuantitativos más precisos que aparecieron en la década de 1920. La instrumentación para espectroscopía de fluorescencia usando un filtro o un monocromador para la selección de longitud de onda apareció, respectivamente, en los años 1930 y 1950. Aunque el descubrimiento de la fosforescencia precedió al de la fluorescencia por casi 200 años, las aplicaciones cualitativas y cuantitativas de la fosforescencia molecular no recibieron mucha atención hasta después del desarrollo de la instrumentación de fluorescencia.
Fuente de Fluorescencia y Fosforescencia
La fotoluminiscencia se divide en dos categorías: fluorescencia y fosforescencia. Un par de electrones que ocupan el mismo estado básico electrónico tienen espines opuestos y están en un estado de giro singlete (Figura\(\PageIndex{1}a\)).
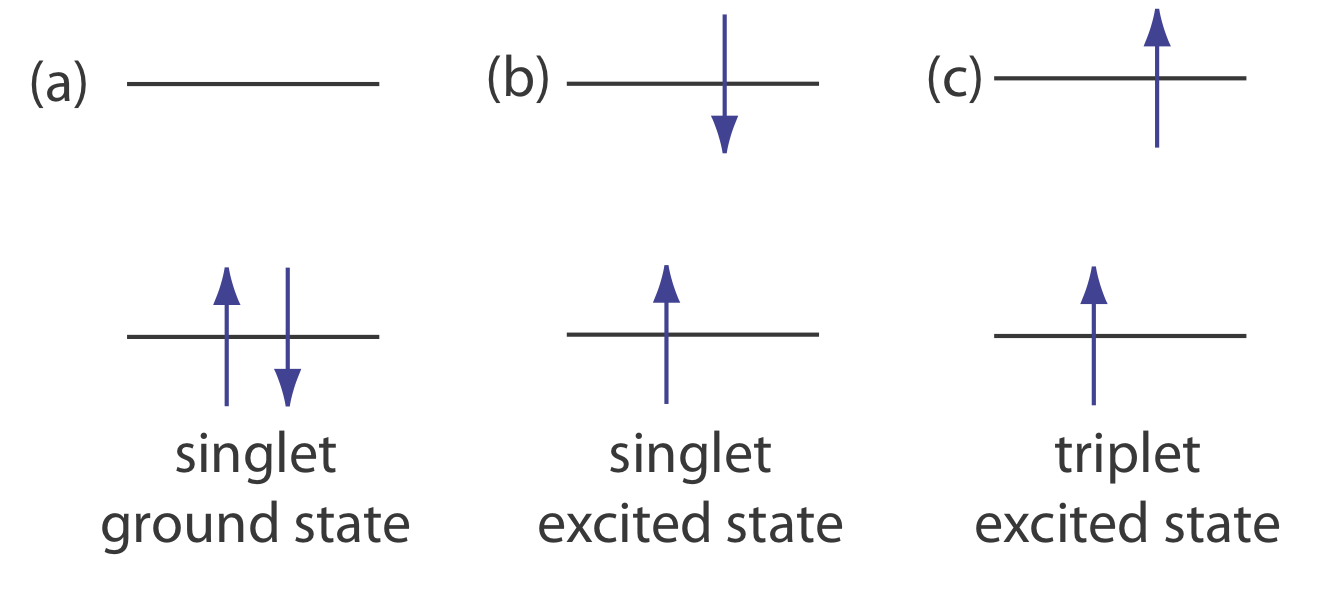
Cuando un analito absorbe un ultravioleta o un fotón visible, uno de sus electrones de valencia se mueve del estado fundamental a un estado excitado con una conservación del espín del electrón (Figura\(\PageIndex{1}b\)). La emisión de un fotón desde un estado excitado singlete al estado de tierra singlete, o entre dos niveles de energía cualesquiera con la misma espina, se llama fluorescencia. La probabilidad de fluorescencia es muy alta y la vida media de un electrón en estado excitado es de solo 10 —5 —10 —8 s. La fluorescencia, por lo tanto, decae rápidamente una vez que se elimina la fuente de excitación.
En algunos casos, un electrón en un estado excitado singlete se transforma a un estado excitado de triplete (Figura\(\PageIndex{1}c\)) en el que su espín ya no está emparejado con el estado fundamental. La emisión entre un estado excitado de triplete y un estado de tierra singlete, o entre dos niveles de energía que difieren en sus respectivos estados de espín, se llama fosforescencia. Debido a que la vida útil promedio de la fosforescencia puede ser bastante larga, oscila entre 10 —4 —10 4 segundos, la fosforescencia puede continuar por algún tiempo después de eliminar la fuente de excitación.
Para apreciar el origen de la fluorescencia y fosforescencia debemos considerar qué le sucede a una molécula tras la absorción de un fotón. Supongamos que la molécula inicialmente ocupa el nivel de energía vibracional más bajo de su estado básico electrónico, que es el estado singlete etiquetado S 0 en la Figura\(\PageIndex{2}\). La absorción de un fotón excita la molécula a uno de varios niveles de energía vibracional en el primer estado electrónico excitado, S1, o el segundo estado excitado electrónico, S2, ambos de los cuales son estados singlete. La relajación al estado fundamental se produce por una serie de mecanismos, algunos de los cuales dan como resultado la emisión de un fotón y otros que ocurren sin la emisión de un fotón. Estos mecanismos de relajación se muestran en la Figura\(\PageIndex{2}\). La vía de relajación más probable de cualquier estado excitado es la que tiene la vida más corta.

Procesos de Desactivación
Una molécula en estado excitado puede regresar a su estado fundamental en una variedad de formas que colectivamente llamamos procesos de desactivación.
Desactivación sin radiación
Cuando una molécula se relaja sin emitir un fotón llamamos desactivación sin radiación al proceso. Un ejemplo de desactivación sin radiación es la relajación vibracional, en la que una molécula en un nivel de energía vibracional excitada pierde energía al moverse a un nivel de energía vibracional más bajo en el mismo estado electrónico. La relajación vibracional es muy rápida, con una vida útil promedio de <10 —12 s. Debido a que la relajación vibracional es tan eficiente, una molécula en uno de los niveles de energía vibratoria más altos de su estado excitado regresa rápidamente al nivel de energía vibracional más bajo del estado excitado.
Otra forma de desactivación sin radiación es una conversión interna en la que una molécula en el nivel vibratorio del suelo de un estado excitado pasa directamente a un nivel de energía vibracional más alto de un estado electrónico de menor energía del mismo estado de giro. Mediante una combinación de conversiones internas y relajaciones vibracionales, una molécula en un estado electrónico excitado puede regresar al estado electrónico básico sin emitir un fotón. Una forma relacionada de desactivación sin radiación es una conversión externa en la que el exceso de energía se transfiere al disolvente o a otro componente de la matriz de la muestra.
Usemos Figura\(\PageIndex{2}\) para ilustrar cómo una molécula puede relajarse de nuevo a su estado fundamental sin emitir un fotón. Supongamos que nuestra molécula se encuentra en el nivel de energía vibracional más alto del segundo estado excitado electrónico. Después de que una serie de relajaciones vibracionales lleva a la molécula al nivel de energía vibracional más bajo de S2, sufre una conversión interna en un nivel de energía vibracional más alto del primer estado electrónico excitado. Las relajaciones vibracionales llevan a la molécula al nivel de energía vibracional más bajo de S1. Después de una conversión interna en un nivel de energía vibracional más alto del estado fundamental, la molécula continúa experimentando relajación vibracional hasta alcanzar el nivel de energía vibracional más bajo de S 0.
Una forma final de desactivación sin radiación es un cruce entre sistemas en el que una molécula en el nivel de energía vibratoria terrestre de un estado electrónico excitado pasa a uno de los niveles de energía vibratoria más altos de un estado electrónico de energía más baja con un estado de giro diferente. Por ejemplo, en la Figura se muestra un cruce entre sistemas\(\PageIndex{2}\) entre el estado excitado singlete S1 y el estado excitado triplete T1.
Variables que afectan a la fluorescencia
La fluorescencia ocurre cuando una molécula en el nivel de energía vibracional más bajo de un estado excitado regresa a un estado electrónico de menor energía al emitir un fotón. Debido a que las moléculas regresan a su estado fundamental por el mecanismo más rápido, la fluorescencia se observa solo si es un medio de relajación más eficiente que una combinación de conversiones internas y relajaciones vibracionales.
Una expresión cuantitativa de la eficiencia de fluorescencia es el rendimiento cuántico fluorescente\(\Phi_f\), que es la fracción de moléculas en estado excitado que regresan al estado fundamental por fluorescencia. Los rendimientos cuánticos fluorescentes varían de 1 cuando cada molécula en estado excitado experimenta fluorescencia, a 0 cuando no ocurre fluorescencia.
La intensidad de fluorescencia, I f, es proporcional a la cantidad de radiación absorbida por la muestra, P 0 — P T, y el rendimiento cuántico de fluorescencia
\[I_{f}=k \Phi_{f}\left(P_{0}-P_{\mathrm{T}}\right) \label{10.1} \]
donde k es una constante que da cuenta de la eficiencia de recolección y detección de la emisión fluorescente. De la ley de Beer sabemos que
\[\frac{P_{\mathrm{T}}}{P_{0}}=10^{-\varepsilon b C} \label{10.2} \]
donde C es la concentración de las especies fluorescentes. Resolviendo la ecuación\ ref {10.2} para P T y sustituyendo en la ecuación\ ref {10.1} da, después de simplificar
\[I_{f}=k \Phi_{f} P_{0}\left(1-10^{-\varepsilon b C}\right) \label{10.3} \]
Cuando\(\varepsilon bC\) < 0.01, que a menudo es el caso cuando la concentración del analito es pequeña, la Ecuación\ ref {10.3} simplifica a
\[I_{f}=2.303 k \Phi_{f} \varepsilon b C P_{0}=k^{\prime} P_{0} \label{10.4} \]
donde k ′ es una colección de constantes. La intensidad de la fluorescencia, por lo tanto, aumenta con un incremento en la eficiencia cuántica, la potencia incidente de la fuente, y la absortividad molar y la concentración de las especies fluorescentes.
La fluorescencia generalmente se observa cuando la absorción de energía más baja de la molécula es una\(\pi \rightarrow \pi^*\) transición, aunque algunas\(n \rightarrow \pi^*\) transiciones muestran fluorescencia débil. Muchos compuestos aromáticos no heterocíclicos no substituidos tienen un rendimiento cuántico de fluorescencia favorable, aunque las sustituciones en el anillo aromático pueden afectar\(\Phi_f\) significativamente. Por ejemplo, la presencia de un grupo aceptor de electrones, como —NO 2, disminuye\(\Phi_f\), mientras que la adición de un grupo donador de electrones, como —OH, aumenta\(\Phi_f\). La fluorrescencia también aumenta para sistemas de anillos aromáticos y para moléculas aromáticas con estructuras planas rígidas. La figura\(\PageIndex{3}\) muestra la fluorescencia de quinina bajo una lámpara UV.

El rendimiento cuántico fluorescente de una molécula también está influenciado por variables externas, como la temperatura y el disolvente. El aumento de la temperatura generalmente disminuye\(\Phi_f\) debido a que las colisiones más frecuentes entre la molécula y el disolvente aumentan la conversión externa. La disminución de la viscosidad del disolvente disminuye\(\Phi_f\) por razones similares. Para un analito con grupos funcionales ácidos o básicos, un cambio en el pH puede cambiar la estructura del analito y sus propiedades fluorescentes.
Como se muestra en la Figura\(\PageIndex{3}\), la fluorescencia puede devolver la molécula a cualquiera de varios niveles de energía vibratoria en el estado electrónico básico. La fluorescencia, por lo tanto, ocurre en un rango de longitudes de onda. Debido a que el cambio en la energía para la emisión fluorescente generalmente es menor que el de la absorción, el espectro de fluorescencia de una molécula se desplaza a longitudes de onda más altas que su espectro de absorción.
Variables que afectan a la fosforescencia
Una molécula en el nivel de energía vibracional más bajo de un estado excitado electrónico triplete normalmente se relaja al estado fundamental por un cruce entre sistemas a un estado singlete o por una conversión externa. La fosforescencia ocurre cuando la molécula se relaja emitiendo un fotón. Como se muestra en la Figura\(\PageIndex{2}\), la fosforescencia ocurre en un rango de longitudes de onda, todas las cuales están a energías más bajas que la banda de absorción de la molécula. La intensidad de fosforescencia,\(I_p\), viene dada por una ecuación similar a la Ecuación\ ref {10.4} para fluorescencia
\[\begin{align} I_{P} &= 2.303 k \Phi_{P} \varepsilon b C P_{0} \nonumber \\[4pt] &= k^{\prime} P_{0} \label{10.5} \end{align}\]
donde\(\Phi_p\) está el rendimiento cuántico de fosforescencia.
La fosforescencia es más favorable para las moléculas con\(n \rightarrow \pi^*\) transiciones, que tienen una mayor probabilidad de un cruce entre sistemas que\(\pi \rightarrow \pi^*\) las transiciones. Por ejemplo, se observa fosforescencia con moléculas aromáticas que contienen grupos carbonilo o heteroátomos. Los compuestos aromáticos que contienen átomos de haluro también tienen una mayor eficiencia para la fosforescencia. En general, un incremento en la fosforescencia corresponde a una disminución de la fluorescencia.
Debido a que la vida media de la fosforescencia puede ser bastante larga, oscilando entre 10 —4 —10 4 s, el rendimiento cuántico fosforescente suele ser bastante pequeño. Se\(\Phi_p\) logra una mejora al disminuir la eficiencia de la conversión externa. Esto se logra de varias maneras, incluyendo bajar la temperatura, usar un disolvente más viscoso, depositar la muestra sobre un sustrato sólido o atrapando la molécula en solución. La figura\(\PageIndex{4}\) muestra un ejemplo de fosforescencia.

Espectros de emisión y excitación
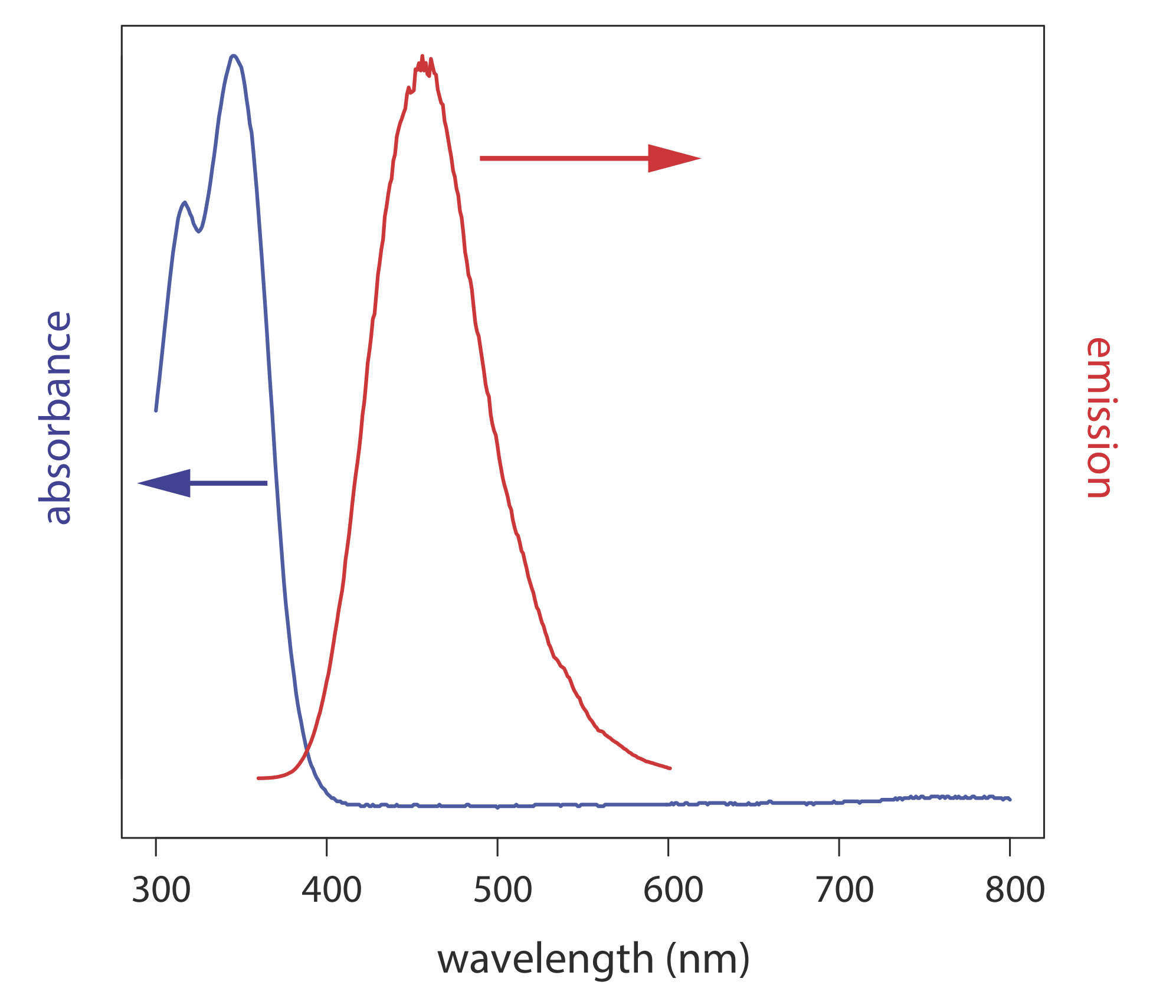
Los espectros de fotoluminiscencia se registran midiendo la intensidad de la radiación emitida en función de la longitud de onda de excitación o de la longitud de onda de emisión. Se obtiene un espectro de excitación monitorizando la emisión a una longitud de onda fija mientras se varía la longitud de onda de excitación. Cuando se corrige por variaciones en la intensidad de la fuente y la respuesta del detector, el espectro de excitación de una muestra es casi idéntico a su espectro de absorbancia. El espectro de excitación proporciona un medio conveniente para seleccionar la mejor longitud de onda de excitación para un análisis cuantitativo o cualitativo.
En un espectro de emisión se utiliza una longitud de onda fija para excitar la muestra y se monitorea la intensidad de la radiación emitida en función de la longitud de onda. Aunque una molécula tiene un único espectro de excitación, tiene dos espectros de emisión, uno para fluorescencia y otro para fosforescencia. La figura\(\PageIndex{5}\) muestra el espectro de absorción UV y el espectro de emisión de fluorescencia UV para quinina.