15.3: Aplicaciones y métodos de fotoluminiscencia
- Page ID
- 78841
Aplicaciones Cuantitativas
La fluorescencia molecular y, en menor medida, la fosforescencia se utilizan para el análisis cuantitativo directo o indirecto de analitos en una variedad de matrices. Un análisis cuantitativo directo es posible cuando el rendimiento cuántico fluorescente o fosforescente del analito es favorable. Si el analito no es fluorescente o fosforescente, o si el rendimiento cuántico es desfavorable, entonces puede ser factible un análisis indirecto. Un enfoque es hacer reaccionar el analito con un reactivo para formar un producto que sea fluorescente o fosforescente. Otro enfoque es medir una disminución en la fluorescencia o fosforescencia cuando el analito se agrega a una solución que contiene una molécula sonda fluorescente o fosforescente. Se observa una disminución en la emisión cuando la reacción entre el analito y la molécula sonda potencia la desactivación sin radiación o da como resultado un producto no emisor. En esta sección se considera la aplicación de fluorescencia y fosforescencia a analitos inorgánicos y orgánicos.
Analitos Inorgánicos
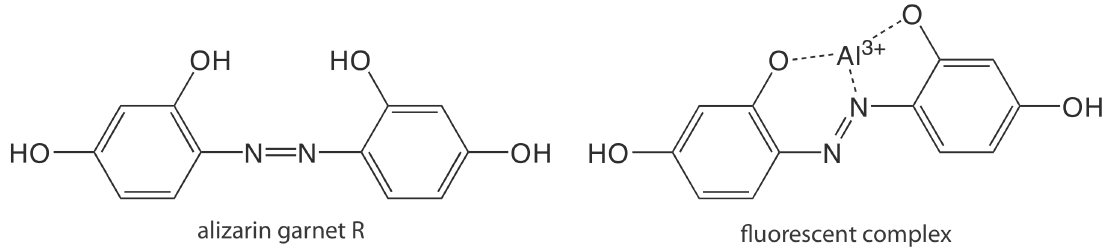
Excepto por algunos iones metálicos, lo más notable\(\text{UO}_2^+\), la mayoría de los iones inorgánicos no son suficientemente fluorescentes para un análisis directo. Muchos iones metálicos se determinan indirectamente al reaccionar con un ligando orgánico para formar un complejo fluorescente o, menos comúnmente, un complejo metal-ligando fosforescente. Un ejemplo es la reacción de Al 3 + con la sal sódica del ácido 2, 4, 3′-trihidroxiazobenceno-5′-sulfónico, también conocido como granate de alizarina R, que forma un complejo de metal-ligando fluorescente (Figura\(\PageIndex{1}\)). El análisis se realiza utilizando una longitud de onda de excitación de 470 nm, con fluorescencia monitoreada a 500 nm. \(\PageIndex{1}\)La tabla proporciona ejemplos adicionales de reactivos quelantes que forman complejos fluorescentes de metal-ligando con iones metálicos. Algunos no metales inorgánicos están determinados por su capacidad para disminuir, o apagar, la fluorescencia de otra especie. Un ejemplo es el análisis de F — basado en su capacidad para apagar la fluorescencia del complejo Al 3 + —granate alizarina R.
| agente quelante | iones metálicos |
|---|---|
| 8-hidroxiquinolina | Al 3 +, Be 2 +, Zn 2 +, Li +, Mg 2 + (y otros) |
| flavonal | Zr 2 +, Sn 4 + |
| benjuí | \(\text{B}_4\text{O}_6^{2-}\), Zn 2 + |
| \(2^{\prime},3^{\prime},4^{\prime},5,7-\text{pentahydroxylflavone}\) | Ser 2 + |
| 2- (o -hidroxifenil) benzoxazol | Cd 2 + |
Analitos Orgánicos
Como se señaló anteriormente, los compuestos orgánicos que contienen anillos aromáticos generalmente son fluorescentes y los heterociclos aromáticos a menudo son fosforescentes. \(\PageIndex{2}\)La tabla proporciona ejemplos de varios compuestos bioquímicos, farmacéuticos y ambientales importantes que se analizan cuantitativamente por fluorimetría o fosforimetría. Si un analito orgánico no es naturalmente fluorescente o fosforescente, puede ser posible incorporarlo a una reacción química que produzca un producto fluorescente o fosforescente. Por ejemplo, la enzima creatina fosfoquinasa se determina utilizándola para catalizar la formación de creatina a partir de fosfocreatina. La reacción de la creatina con ninhidrina produce un producto fluorescente de estructura desconocida.
| clase | compuestos (F = fluorescencia, P = fosforescencia) |
|---|---|
| aminoácidos aromáticos |
fenilalanina (F) tirosina (F) triptófano (F, P) |
| vitaminas |
vitamina A (F) vitamina B2 (F) vitamina B6 (F) vitamina B12 (F) vitamina E (F) ácido fólico (F) |
| catecolaminas |
dopamina (F) norepinefrina (F) |
| Farmacéuticos y Medicamentos |
quinina (F) ácido salicílico (F, P) morfina (F) barbitúricos (F) LSD (F) codeína (P) cafeína (P) sulfanilamida (P) |
| contaminantes ambientales |
pireno (F) benzo [a] pireno (F) plaguicidas organotiofosforados (F) insecticidas carbamato (F) DDT (P) |
Estandarización del Método
En la Sección 15.1 mostramos que la intensidad de fluorescencia o fosforescencia es una función lineal de la concentración del analito siempre que la absorbancia de la muestra de radiación fuente (\(A = \varepsilon bC\)) sea menor a aproximadamente 0.01. Las curvas de calibración a menudo son lineales en cuatro a seis órdenes de magnitud para fluorescencia y sobre dos a cuatro órdenes de magnitud para fosforescencia. Para mayores concentraciones de analito la curva de calibración se vuelve no lineal debido a que ya no se aplica la suposición de que la absorbancia es despreciable. Se puede observar no linealidad para concentraciones más pequeñas de analito fluorescente o contaminantes fosforescentes que están presentes. Como se discutió anteriormente, la eficiencia cuántica es sensible a la temperatura y la matriz de muestra, las cuales deben controlarse cuando se utilizan estándares externos. Además, la intensidad de emisión depende de la absortividad molar de las especies fotoluminiscentes, que es sensible a la matriz de muestra.
Método Representativo: Determinación de Quinina en Orina
La mejor manera de apreciar los detalles teóricos y prácticos discutidos en esta sección es examinar cuidadosamente un método analítico típico. Si bien cada método es único, la siguiente descripción de la determinación de quinina en orina proporciona un ejemplo instructivo de un procedimiento típico. La descripción aquí se basa en Mule, S. J.; Hushin, P. L. Anal. Chem. 1971, 43, 708—711, y O'Reilly, J. E.; J. Chem. Educ. 1975, 52, 610—612.
Descripción del Método
La quinina es un alcaloide utilizado para tratar la malaria. Es un compuesto fuertemente fluorescente en soluciones diluidas de H 2 SO 4 (\(\Phi_f = 0.55\)). El espectro de excitación de la quinina tiene bandas de absorción a 250 nm y 350 nm y su espectro de emisión tiene una sola banda de emisión a 450 nm. La quinina se excreta rápidamente del cuerpo en la orina y se determina midiendo su fluorescencia después de su extracción de la muestra de orina.
Procedimiento
Transfiera una muestra de orina de 2.00-mL a un tubo de ensayo de 15 mL y use NaOH 3.7 M para ajustar su pH entre 9 y 10. Agregar 4 mL de una mezcla 3:1 (v/v) de cloroformo e isopropanol y agitar el contenido del tubo de ensayo por un minuto. Permita que las capas orgánica y acuosa (orina) se separen y transfiera la fase orgánica a un tubo de ensayo limpio. Agregar 2.00 mL de 0.05 M H 2 SO 4 a la fase orgánica y agitar el contenido por un minuto. Permita que las capas orgánica y acuosa se separen y transfiera la fase acuosa a la celda de muestra. Mida la emisión fluorescente a 450 nm usando una longitud de onda de excitación de 350 nm. Determinar la concentración de quinina en la muestra de orina utilizando un conjunto de estándares externos en 0.05 M H 2 SO 4, preparado a partir de una solución de 100.0 ppm de quinina en 0.05 M H 2 SO 4. Use agua destilada como blanco.
Preguntas
1. El ion cloruro apaga la intensidad de la emisión fluorescente de la quinina. Por ejemplo, en presencia de 100 ppm de NaCl (61 ppm Cl —) la intensidad de emisión de quinina es solo 83% de su intensidad de emisión en ausencia de cloruro. La presencia de 1000 ppm de NaCl (610 ppm Cl —) reduce aún más la emisión fluorescente de quinina a menos de 30% de su intensidad de emisión en ausencia de cloruro. La concentración de cloruro en la orina típicamente oscila entre 4600—6700 ppm Cl —. Explique cómo este procedimiento evita una interferencia del cloruro.
El procedimiento utiliza dos extracciones. En la primera de estas extracciones, la quinina se separa de la orina extrayéndola en una mezcla de cloroformo e isopropanol, dejando atrás el ion cloruro en la muestra original.
2. Las muestras de orina pueden contener pequeñas cantidades de otros compuestos fluorescentes, que interferirán con el análisis si se llevan a través de las dos extracciones. ¿Explicar cómo se puede modificar el procedimiento para tener esto en cuenta?
Un enfoque es preparar un blanco que utilice una muestra de orina que se sabe que está libre de quinina. Restar la señal fluorescente del blanco de la fluorescencia medida de las muestras de orina corrige los compuestos interferentes.
3. La emisión fluorescente para quinina a 450 nm se puede inducir usando una frecuencia de excitación de 250 nm o 350 nm. La eficiencia cuántica fluorescente es la misma para cualquiera de las longitudes de onda de excitación. El espectro de absorción de quinina muestra que\(\varepsilon_{250}\) es mayor que\(\varepsilon_{350}\). Dado que la quinina tiene una absorbancia más fuerte a 250 nm, explique por qué su intensidad de emisión fluorescente es mayor cuando se utiliza 350 nm como longitud de onda de excitación.
Sabemos que I f es una función de los siguientes términos: k,\(\Phi_f\), P 0\(\varepsilon\),, b, y C. Sabemos que\(\Phi_f\), b y C son lo mismo para ambas longitudes de onda de excitación y eso\(\varepsilon\) es mayor para una longitud de onda de 250 nm; podemos, por lo tanto, ignorar estos términos. La mayor intensidad de emisión cuando se utiliza una longitud de onda de excitación de 350 nm debe deberse a un valor mayor para P 0 o k. De hecho, P 0 a 350 nm para una lámpara de arco Xe de alta presión es aproximadamente 170% de eso a 250 nm. Además, la sensibilidad de un detector fotomultiplicador típico (que contribuye al valor de k) a 350 nm es aproximadamente 140% de la de 250 nm.
Para evaluar el método descrito anteriormente, se prepara y analiza una serie de estándares externos, proporcionando los resultados que se muestran en la siguiente tabla. Todas las intensidades fluorescentes se corrigen utilizando un blanco preparado a partir de una muestra de orina sin quinina. Las intensidades fluorescentes se normalizan estableciendo If para el estándar de concentración más alto a 100.
| [quinina] (µg/mL) | I f |
|---|---|
| 1.00 | 10.11 |
| 3.00 | 30.20 |
| 5.00 | 49.84 |
| 7.00 | 69.89 |
| 10.00 | 100.0 |
Después de ingerir 10.0 mg de quinina, un voluntario proporciona una muestra de orina 24 h después. El análisis de la muestra de orina da una intensidad relativa de emisión de 28.16. Reportar la concentración de quinina en la muestra en mg/L y el porcentaje de recuperación para la quinina ingerida.
Solución
La regresión lineal de la intensidad de emisión relativa frente a la concentración de quinina en los estándares da la curva de calibración que se muestra a continuación y la siguiente ecuación de calibración.
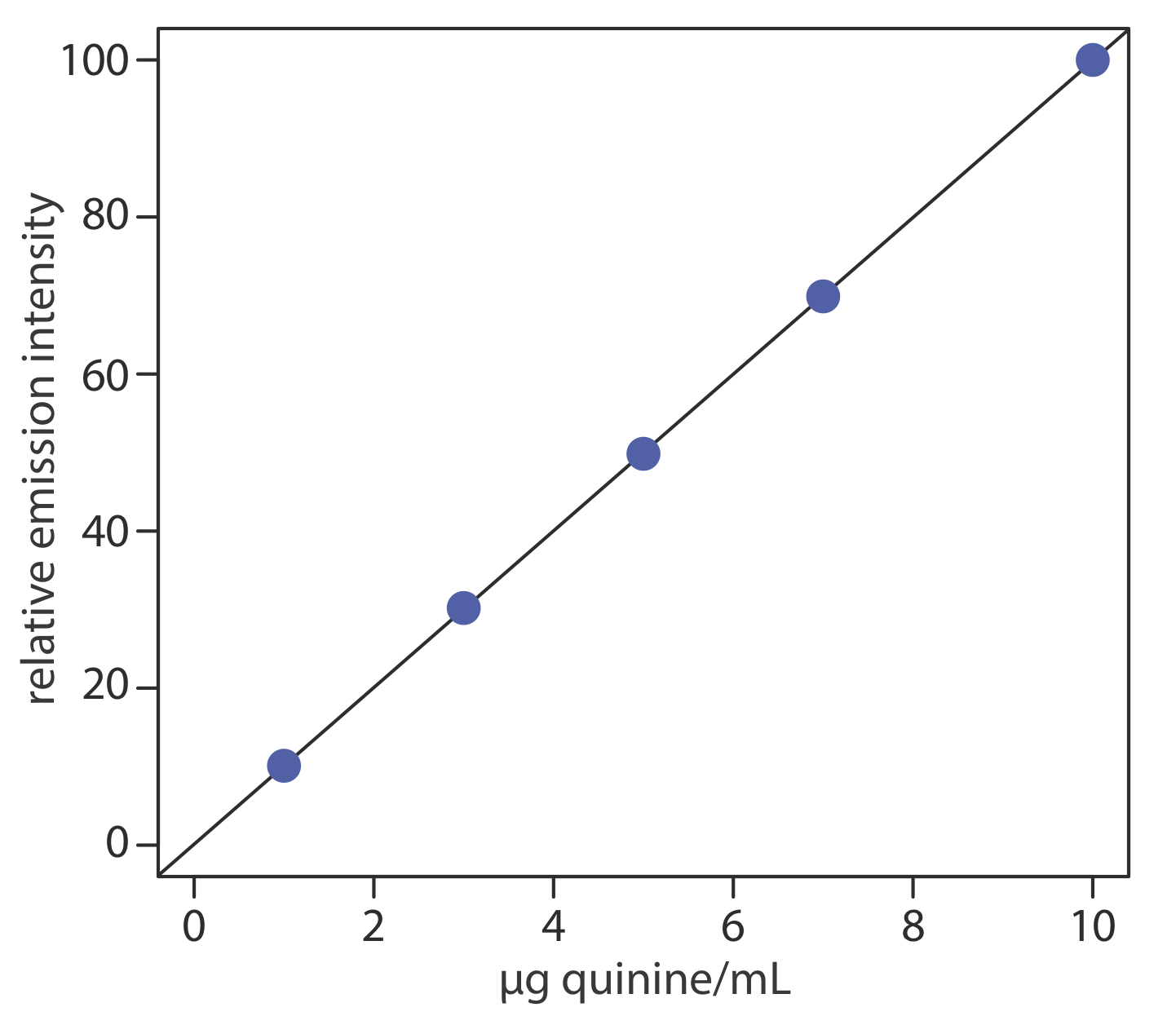
\[I_{f}=0.122+9.978 \times \frac{\mathrm{g} \text { quinine }}{\mathrm{mL}} \nonumber \]
Sustituyendo la intensidad de emisión relativa de la muestra en la ecuación de calibración da la concentración de quinina como 2.81 μg/mL. Debido a que el volumen de orina tomada, 2.00 mL, es el mismo que el volumen de 0.05 M H 2 SO 4 utilizado para extraer la quinina, la concentración de quinina en la orina también es de 2.81 μg/mL. La recuperación de la quinina ingerida es
\[\frac{\frac{2.81 \ \mu \mathrm{g} \text { quinine }}{\mathrm{mL} \text { urine }} \times 2.00 \ \mathrm{mL} \text { urine } \times \frac{1 \mathrm{mg}}{1000 \ \mu \mathrm{g}}} {10.0 \ \mathrm{mg} \text { quinine ingested }} \times 100=0.0562 \% \nonumber \]
Pueden tomar de 10 a 11 días para que el cuerpo excrete completamente la quinina por lo que no es de extrañar que una cantidad tan pequeña de quinina se recupere de esta muestra de orina.


