18.1: Teoría de la Espectroscopia Raman
- Page ID
- 79099
El color azul del cielo durante el día y el rojo del sol al atardecer son el resultado de la dispersión de la luz por pequeñas partículas de polvo, por moléculas de vapor de agua, y por otros gases en la atmósfera. La eficiencia de la dispersión de un fotón depende de su longitud de onda. Vemos el cielo como azul durante el día porque la luz violeta y azul se dispersan en mayor medida que otras longitudes de onda de luz más largas. Por la misma razón, el sol aparece rojo al atardecer porque la luz roja se dispersa de manera menos eficiente y es más probable que pase a través de la atmósfera que otras longitudes de onda de la luz. Si enviamos un haz de radiación focalizado y monocromático con una longitud de onda\(\lambda\) a través de un medio de partículas, ya sean partículas sólidas o moléculas individuales, que tengan dimensiones\(<1.5 \lambda\), entonces la radiación se dispersa en todas las direcciones. Por ejemplo, la luz infrarroja en el IR cercano con una longitud de onda de 700 nm se dispersará desde cualquier partícula cuya dimensión más larga sea inferior a 1,300 nm. Incluso en una muestra por lo demás transparente, se produce la dispersión de las moléculas.
Espectros Raman
Hay dos clases generales de dispersión: dispersión elástica y dispersión inelástica. En dispersión elástica, un fotón es primero absorbido por una partícula y luego emitido sin un cambio en su energía (\(\Delta E = 0\)); esto se llama dispersión de Rayleigh. Con dispersión inelástica, un fotón es primero absorbido por una partícula y luego emitido con un cambio en su energía (\(\Delta E \ne 0\)); esto se llama dispersión Raman. Una gráfica que muestra la intensidad de la radiación dispersa en función de la energía del fotón dispersado, expresada como un cambio en el número de onda\(\Delta \overline{\nu}\), se denomina espectro Raman y los valores de\(\Delta \overline{\nu}\) se denominan desplazamientos Raman.
La figura\(\PageIndex{1}\) muestra una porción del espectro Raman para tetracloruro de carbono e ilustra varias características importantes. Primero, la dispersión de Rayleigh produce un pico intenso en\(\Delta \overline{\nu} = 0\). A pesar de que el pico es intenso, no lleva información útil ya que la energía absoluta es justamente esa para la fuente. En segundo lugar, la dispersión Raman tiene dos componentes, las líneas Stokes y las líneas anti-Stokes, que tienen cambios absolutos idénticos en relación con la línea para la dispersión de Rayleigh, pero que tienen signos diferentes. Las líneas Stokes tienen valores positivos para\(\Delta\overline{\nu}\) y las líneas anti-Stokes tienen valores negativos para\(\Delta \overline{\nu}\). Tercero, cada una de las líneas Stokes es más intensa que la correspondiente línea anti-Stokes. Cuarto, debido a que medimos el desplazamiento en el número de onda de un pico en relación con la radiación de origen, el espectro es independiente de la radiación fuente.
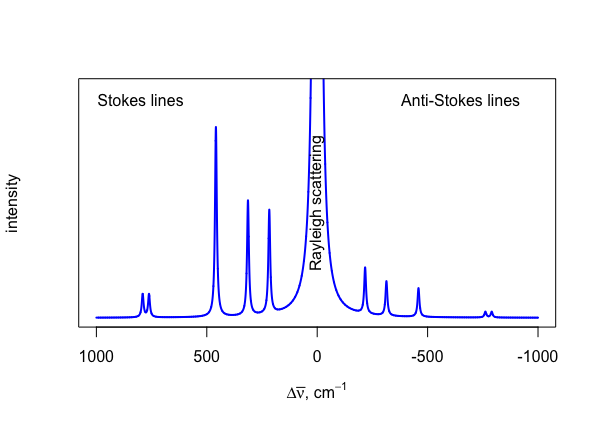
La energía —y, por lo tanto, el wavenumber— de un fotón que experimenta la dispersión de Stokes es menor que la energía y, por lo tanto, el número de vagabundos, de la radiación fuente, lo que plantea la pregunta de por qué un cambio de Stokes se reporta como un valor positivo en lugar de un valor negativo. A pesar de que encontrarás la mayoría de los espectros Raman con valores positivos para el cambio de Stokes, también encontrarás ejemplos donde los cambios de Stokes se reportan con valores negativos. Debido a que las líneas de Stokes son más intensas que las líneas anti-Stokes, y, por lo tanto, más útiles, y debido a que sus respectivos desplazamientos resultan de los mismos cambios en los estados de energía vibracional que encontramos en la espectroscopia IR, es conveniente reportar las líneas de Stokes como valores positivos para que podamos alinear un espectros Raman e IR de especies. Consulte las dos secciones siguientes para obtener detalles adicionales.
Mecanismo de dispersión Raman y Rayleigh
En el Capítulo 6 examinamos el mecanismo por el cual ocurren la absorción y emisión. En capítulos posteriores exploramos la espectrometría de absorción atómica y emisión atómica, la espectrometría de absorción molecular ultravioleta y visible, la espectrometría de luminiscencia molecular y la espectrometría de absorción molecular infrarroja. En cada caso comenzamos considerando un diagrama de niveles de energía que explica el origen de la absorción y emisión. La Figura\(\PageIndex{2}\) proporciona un diagrama de energía que podemos usar para explicar el origen de las líneas que conforman un espectro Raman, como el espectro para tetracloruro de carbono en la Figura\(\PageIndex{1}\).
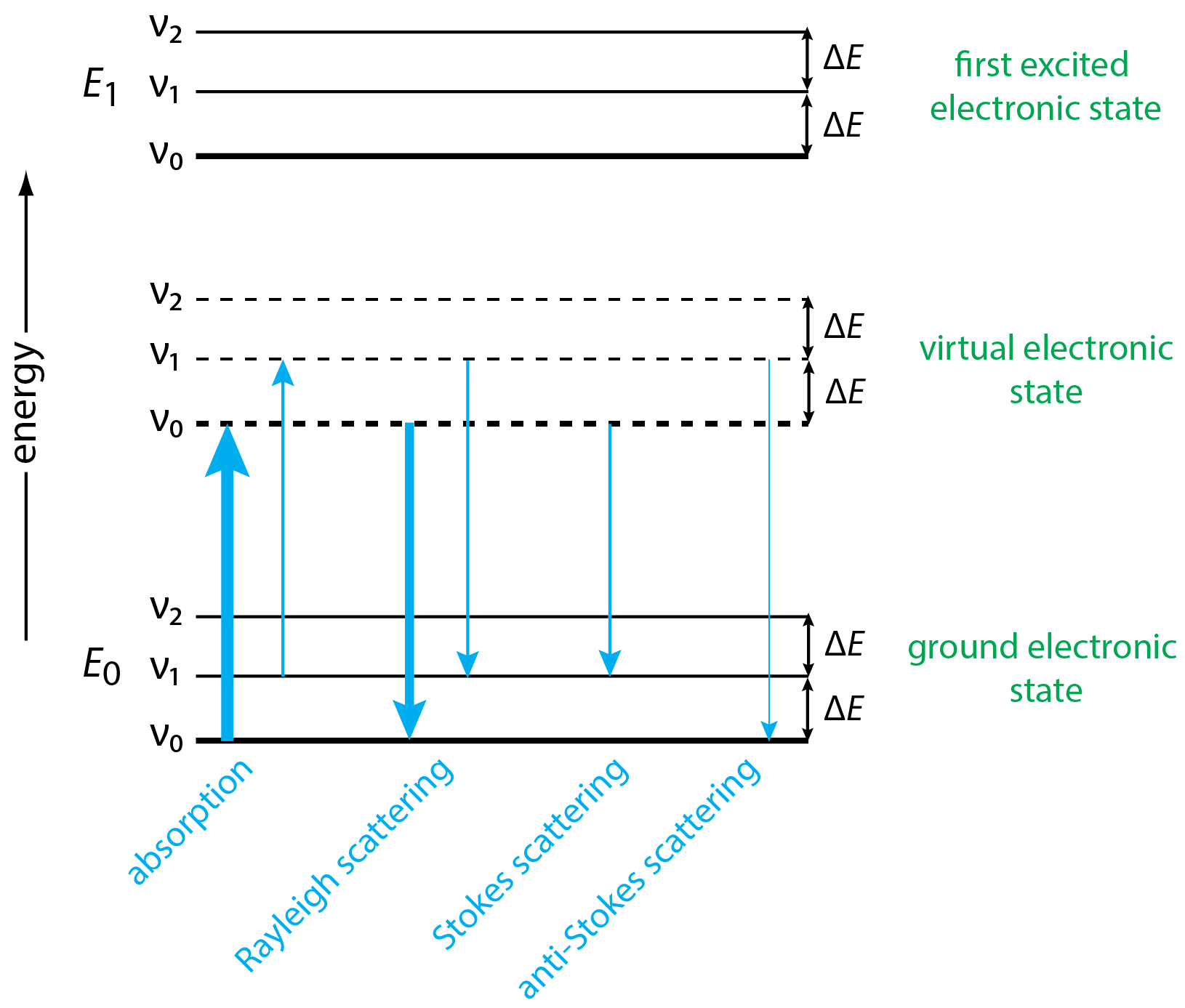
Lo primero a tener en cuenta sobre el diagrama de nivel de energía en la Figura\(\PageIndex{2}\) es que, además de mostrar el estado electrónico básico y el primer estado electrónico excitado —cada uno con tres niveles de energía vibracional— también muestra un estado electrónico virtual, algo que no encontramos con otros métodos (ver , por ejemplo, el diagrama de energía para espectrometría de absorción molecular UV e IR en la Figura 6.4.2). Se cuantifican el suelo y los primeros estados electrónicos excitados, lo que significa que la absorción no puede ocurrir si la energía de la fuente no coincide exactamente con el cambio de energía entre los dos estados electrónicos. La energía de un fotón emitido también se fija por la diferencia en la energía de los dos estados electrónicos. Un estado electrónico virtual, sin embargo, no está cuantificado y está determinado por la energía de la radiación fuente. La fuente de radiación, por lo tanto, no necesita igualar un cambio particular en la energía.
La absorción de un fotón de radiación fuente mueve el analito desde el estado electrónico básico a un estado electrónico virtual sin un cambio en el estado de energía vibracional, como lo ven las dos flechas en el extremo izquierdo del diagrama. Debido a que el estado de energía vibracional terrestre\(\nu_0\),, está más poblado que el estado de energía vibracional\(\nu_1\),, más del analito termina en la energía vibracional más baja de un estado electrónico virtual que en un estado de energía vibracional superior, lo que se muestra aquí por el grosor relativo de los dos flechas.
Una vez en un estado electrónico virtual, el analito puede regresar al estado de excitación fundamental en una de tres formas. Puede hacerlo sin un cambio en el nivel de energía vibratoria. En este caso, la energía de absorción y la energía de emisión son las mismas y\(\Delta E = 0\) y\(\Delta \overline{\nu} = 0\). Esta es la dispersión de Rayleigh y, como sugiere el grosor combinado de las dos flechas en la Figura\(\PageIndex{2}\), es el mecanismo de relajación más importante.
Cuando la relajación incluye un cambio en el nivel de energía vibratoria, el resultado es un cambio absoluto en la energía equivalente a la diferencia de energía,\(\Delta E\), entre los niveles de energía vibracional adyacentes. Para la dispersión de Stokes, la relajación es a un nivel de energía vibracional más alto, como\(\nu_0 \rightarrow \nu_1\) y, para la dispersión anti-Stokes, la relajación a un nivel de energía vibracional más bajo, como\(\nu_1 \rightarrow \nu_0\). Como sugiere el grosor de las líneas para la dispersión de Stokes y anti-Stokes en Figura\(\PageIndex{2}\), las líneas de Stokes son más intensas que las líneas anti-Stokes porque comienzan en un estado excitado más densamente poblado.
Relación entre IR y Espectros Raman
Una característica importante de Figura\(\PageIndex{2}\) es que la transición que da lugar a una línea particular de Stokes o línea anti-Stokes es la misma transición que dará lugar a una banda IR correspondiente. Si las reglas de selección para estas transiciones son las mismas para una especie en particular, entonces esperamos que su espectro IR y su espectro Raman tengan picos a los mismos (o similares) valores de\(\overline{\nu}\) y\(\Delta \overline{\nu}\) para sus vibraciones fundamentales; sin embargo, como vemos en Tabla\(\PageIndex{1}\) para carbono tetracloruro, CCl 4, hay cinco vibraciones fundamentales en su espectro Raman, pero sólo tres en su espectro IR.
| Infrarrojos (\(\overline{\nu}\), cm —1) | Raman (\(\Delta \overline{\nu}\), cm —1) |
|---|---|
| \ (\ overline {\ nu}\), cm—1) ">— | \ (\ Delta\ overline {\ nu}\), cm—1) ">217.0 (l) |
| \ (\ overline {\ nu}\), cm—1) ">309.9 (l) débil | \ (\ Delta\ overline {\ nu}\), cm—1) ">313.5 (l) |
| \ (\ overline {\ nu}\), cm—1) ">— | \ (\ Delta\ overline {\ nu}\), cm—1) ">458.7 (l) |
| \ (\ overline {\ nu}\), cm—1) ">768 (g); muy fuerte | \ (\ Delta\ overline {\ nu}\), cm—1) ">761.7 (l) |
| \ (\ overline {\ nu}\), cm—1) ">789 (g); muy fuerte | \ (\ Delta\ overline {\ nu}\), cm—1) ">790.4 (l) |
| \ (\ Delta\ overline {\ nu}\), cm—1) ">Las designaciones (g) y (l) indican la fase de la muestra donde (g) es fase gaseosa y (l) es fase líquida. Las designaciones de débil y muy fuerte para los picos IR indican el grado relativo de absorción: muy fuerte significa un %T relativamente pequeño (y una absorbancia fuerte) y débil significa un %T relativamente grande (y una absorbancia débil). Ver Figura\(\PageIndex{1}\) para la cantidad relativa de dispersión en el espectro Raman para CCl 4. | |
En el Capítulo 16 aprendimos que en la espectroscopia IR la energía vibratoria fundamental de un compuesto es activa, es decir, vemos un pico en su espectro IR, solo si el estiramiento o curva correspondiente da como resultado un cambio en el momento dipolar del compuesto. Para la espectroscopia Raman, la energía vibratoria fundamental de un compuesto es activa solo si el estiramiento o curvatura correspondiente da como resultado un cambio en la polarizabilidad de sus electrones. La polarizabilidad esencialmente es una medida de lo fácil que es distorsionar la nube de electrones de un compuesto aplicando un campo eléctrico externo, como cuando se absorbe un fotón de la fuente; en general, la polarizabilidad aumenta cuando un movimiento de estiramiento o flexión aumenta el volumen del compuesto a medida que los electrones son luego se extendió sobre una mayor cantidad de espacio.
La figura\(\PageIndex{3}\) muestra los cuatro modos de estiramiento y flexión para CCl 4. El movimiento de estiramiento en (a), en el que las cuatro longitudes de enlace C—Cl aumentan y disminuyen juntas, significa que el volumen de la molécula aumenta y disminuye; por lo tanto, este modo vibracional es Raman activo. La simetría del movimiento de estiramiento, sin embargo, significa que no hay cambio en el momento dipolar de la molécula y el modo vibratorio es IR inactivo. El estiramiento asimétrico en (b), por otro lado, es activo tanto IR como Raman. El movimiento de flexión en (c) da como resultado que la molécula se vuelva más o menos compacta en tamaño, y sea Raman activa; la simetría de los movimientos de tijera, sin embargo, significa que el modo vibratorio es IR inactivo. Los movimientos de flexión en (d) son activos tanto IR como Raman.
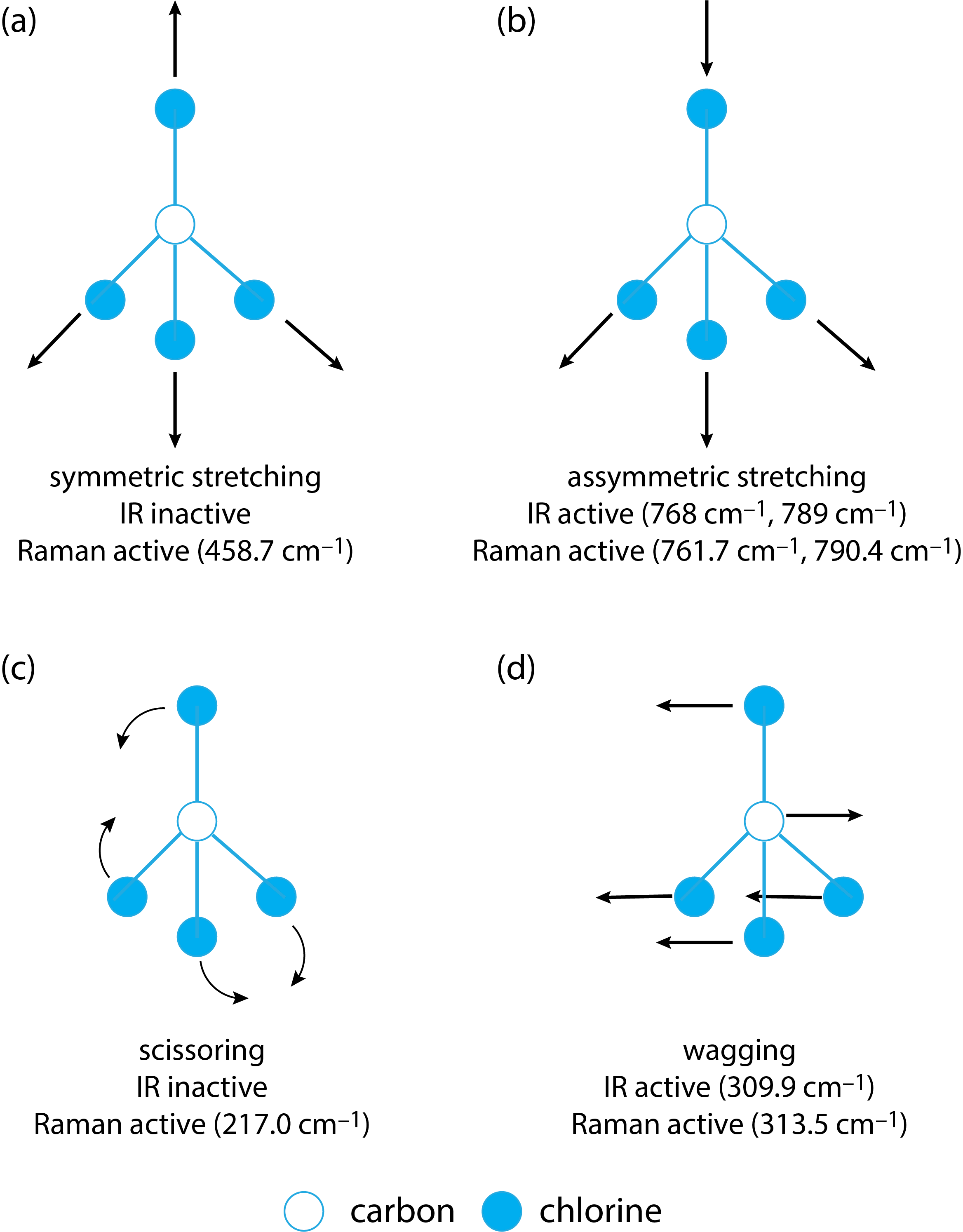
En general, los modos de estiramiento y flexión simétricos dan como resultado picos de dispersión Raman relativamente fuertes, pero no absorción en el IR, mientras que los modos de estiramiento y flexión simétricos dan como resultado picos IR y Raman. Como resultado, IR y Raman son técnicas complementarias.
Ratios de despolarización Raman
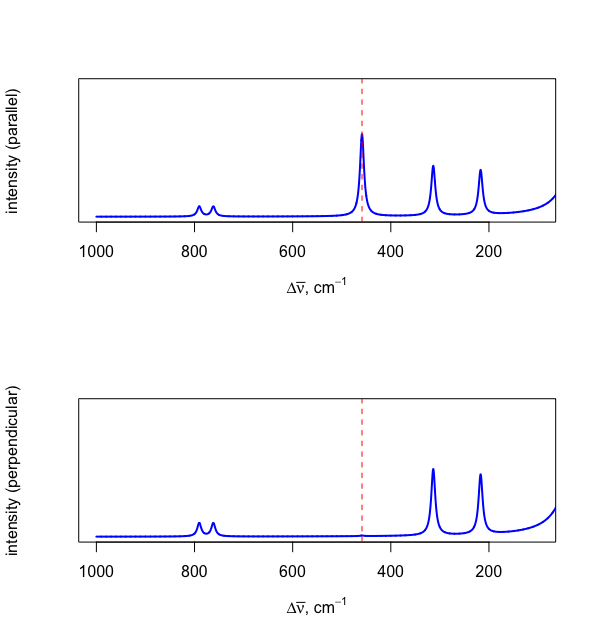
Si la fuente de radiación electromagnética está polarizada en plano, entonces es posible recolectar un espectro Raman utilizando luz dispersada en un plano que es paralelo a la fuente y, por separado, en un plano que es perpendicular a la fuente. La relación de la intensidad de dispersión de una línea en el espectro perpendicular,\(I_{\perp}\), a la intensidad de dispersión en el espectro paralelo,\(I_{||}\), se llama la relación de despolarización,\(p\).
\[p = \frac{I_{\perp}}{I_{||} } \label{depolarization} \]
Una línea Raman que se origina a partir de un modo vibratorio que no cambia la forma de las moléculas dará como resultado una relación de despolarización cercana a cero y una ausencia de la línea en el espectro perpendicular. La figura\(\PageIndex{4}\) muestra el espectro Raman al recolectar datos paralelos (arriba) y perpendiculares (abajo) a la fuente de luz. La ausencia del pico a 458.7 cm —1 en el espectro perpendicular confirma que este es el tramo simétrico ilustrado en la Figura\(\PageIndex{3}a\).