20.2: Fuentes de iones
- Page ID
- 78925
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Dado que un espectro de masas muestra la abundancia relativa de iones con diferentes relaciones masa-carga, un espectrómetro de masas debe incluir una forma de generar iones. Más específicamente, necesita un método que genere el ion inicial ya que, una vez formado, sufrirá fragmentación sin ayuda adicional del analista (lo que no significa que el analista no pueda asistir en esa fragmentación; ver discusión de espectrometría de masas en tándem en la Sección 20.4). En esta sección consideramos varias fuentes de iones comunes. Podemos describir estas fuentes utilizando dos propiedades características: (a) el estado físico de la especie inicialmente ionizada (fase gaseosa, líquida o sólida), y (b) si la ionización favorece la formación de iones fragmentados o la formación de iones moleculares (fuentes duras o fuentes blandas).
Fuentes de ionización de electrones (fase gaseosa/fuente dura)
La fuente de ionización de electrones (EI), también conocida como fuente de impacto de electrones, utiliza un haz de electrones energéticos para ionizar el analito. Como se muestra en\(\PageIndex{1}\), la muestra se volatiliza antes de ingresar a la fuente de iones como moléculas en fase gaseosa, M (g). Un filamento de tungsteno calentado se utiliza para generar electrones, los cuales son arrastrados hacia un ánodo cargado positivamente. Este haz de electrones se cruza con las moléculas en fase gaseosa a 90° donde ocurre la ionización
\[ \ce{M}(g) + e^- \rightarrow \ce{M^{+•}}(g) + 2e^- \label{ei1} \]
Los iones moleculares,\(\ce{M^{+•}}(g)\), son luego barridos en el analizador de masas usando un conjunto de placas aceleradoras (no mostradas aquí).
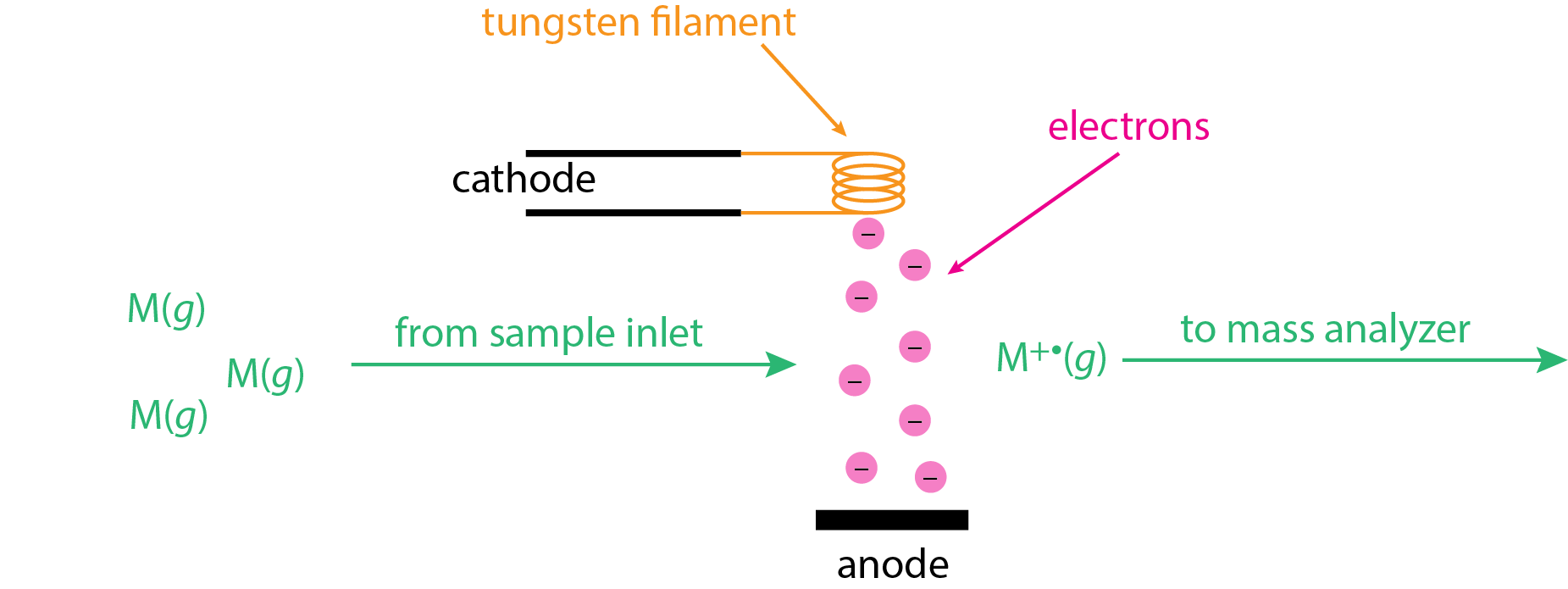
El haz de electrones en la Figura\(\PageIndex{1}\) tiene mucha energía debido a la diferencia significativa de potencial entre el cátodo y el ánodo, que puede llegar a ser de hasta 70 V. La energía cinética de estos electrones es equivalente al producto de la carga del electrón en Coulombs, el potencial aplicado en voltios, y Número de Avogadro
\[e \times V \times N_A = 1.6 \times 10^{-19} \times 6.022 \times 10^{-23} = 6.7 \times 10^{6} \text{ J/mol} \nonumber \]
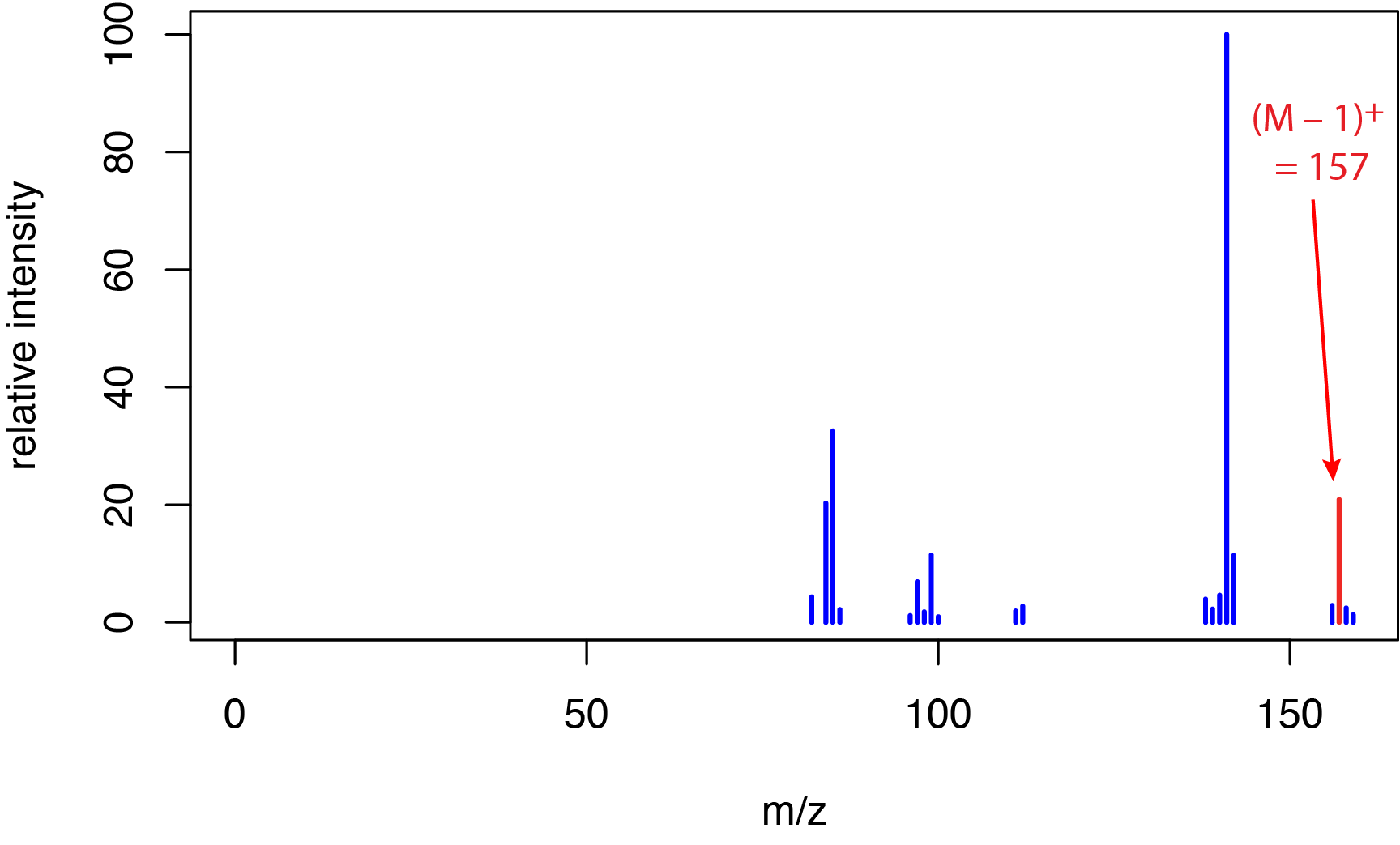
o 6,700 kJ/mol. Esta energía es mucho mayor que las energías de enlace típicas, que varían de aproximadamente 150 a 600 kJ/mol para enlaces simples, de aproximadamente 500 a 750 kJ/mol para dobles enlaces y de aproximadamente 800 a 1100 kJ/mol para enlaces triples. La diferencia significativa entre la energía de los electrones y las energías de enlace explica por qué los espectros de ionización de electrones son ricos en iones fragmentados, como vimos anteriormente en la Sección 20.1 para o -nitrofenol, m-nitrofenol y p-nitrofenol. Esta fragmentación extensa es útil para determinar la estructura de un analito, lo cual es una ventaja de un método de ionización dura, pero al posible costo de la pérdida del pico de iones moleculares para algunos analitos. Por ejemplo, la Figura\(\PageIndex{2}\) muestra el espectro de masas de ionización electrónica del 1-decanol, C 10 H 22 O, el cual tiene una masa nominal de 158 daltons. El pequeño pico a m/z = 157 es para el ion fragmento C 10 H 21 O +; el ion molecular no se observa en este espectro.

Fuentes de ionización química (fase gaseosa/fuente blanda)
La ionización de electrones es una fuente dura porque la energía del haz de electrones resulta en una fácil fragmentación. En la ionización química, se introdujo una molécula de reactivo, como el metano, en la fuente de ionización electrónica (CI) para que esté presente a un nivel que es\(1000 \times\) a\(10,000 \times\) mayor que el analito. A esta mayor concentración, es la molécula reactiva la que se ioniza; por ejemplo, cuando se usa CH 4 como gas reactivo, los iones como\(\ce{CH4+}\) y se\(\ce{CH3+}\) forman. Estos iones reaccionan con moléculas de metano adicionales
\[\ce{CH4+}(g) + \ce{CH4}(g) \rightarrow \ce{CH5+}(g) + \ce{CH3}(g) \label{ci1} \]
\[\ce{CH3+}(g) + \ce{CH4}(g) \rightarrow \ce{C2H5+}(g) + \ce{H2}(g) \label{ci2} \]
para formar\(\ce{CH5+}\) y\(\ce{C2H5+}\), especies que son suficientemente reactivas como para transferir fácilmente un hidrógeno a una molécula del analito, MH
\[\ce{CH5+}(g) + \ce{MH}(g) \rightarrow \ce{MH2+}(g) + \ce{CH4}(g) \label{ci3} \]
para dar un ion molecular que identificamos como [M + H] + y que tiene una masa que es una unidad amu mayor que la de M. Alternativamente, pueden eliminar fácilmente un hidrógeno de una molécula del analito, MH
\[\ce{C2H5+}(g) + \ce{MH}(g) \rightarrow \ce{M+}(g) + \ce{C2H6}(g) \label{ci4} \]
para dar un ion molecular que identificamos como [M — H] — y que tiene una masa que es un amu menor que la de M. Debido a que la formación del ion molecular ocurre indirecta y menos energéticamente, se suprime la fragmentación, dando lugar a un espectro de masas con un pico de ión molecular y con solo un pequeño número de otros iones. La figura\(\PageIndex{2}\) muestra el espectro de masas para 1-decanol cuando se utiliza ionización química con\(\ce{CH4}\) como gas reactivo.
Fuentes de ionización por electropulverización (fase líquida/fuente blanda)
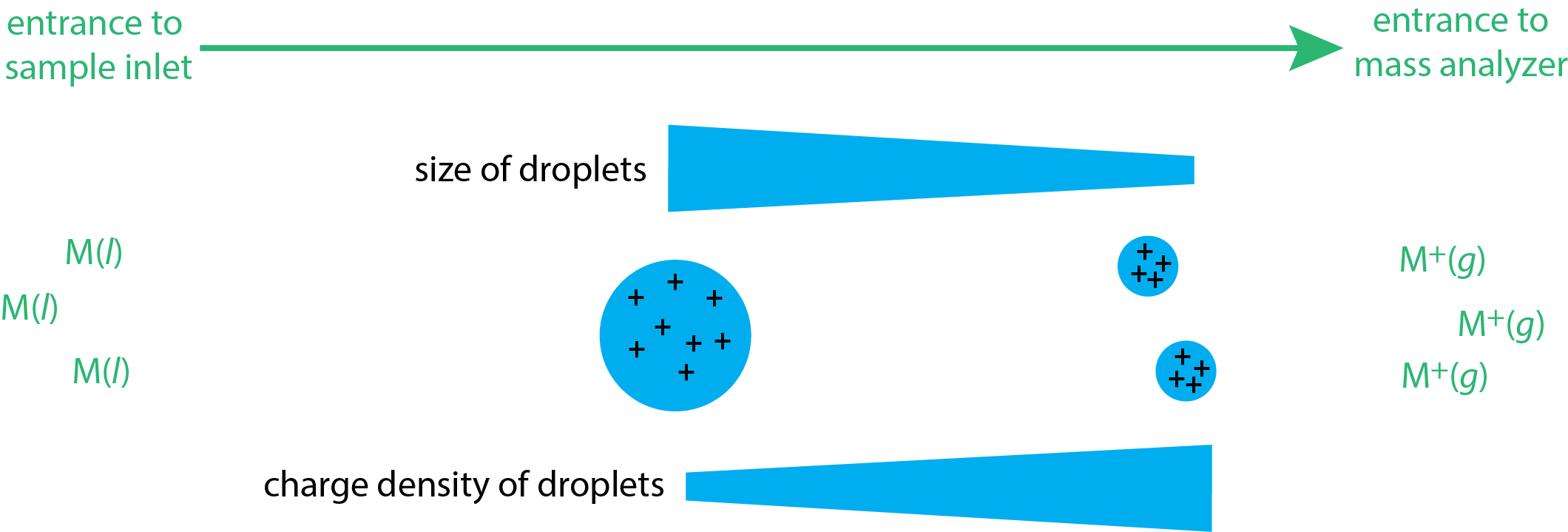
El impacto electrónico y la ionización química son fuentes de fase gaseosa porque la muestra se volatiliza antes de que entre en la entrada del espectrómetro de masas. En la ionización por electropulverización (ESI), la muestra es un líquido y los iones se desorben de esa matriz en el sistema de entrada del espectrómetro de masas. La muestra líquida se introduce en la entrada del espectrómetro a través de una aguja capilar, formando una neblina de gotitas. La aplicación de un gran potencial a través de esta entrada asegura que las gotas transporten cargas positivas. Estas gotitas cargadas luego ingresan a una cámara donde sufren desolvación, lo que disminuye el tamaño de la gotita y aumenta su densidad de carga (ver Figura\(\PageIndex{4}\)). A medida que esta densidad de carga aumenta, las gotitas eventualmente se vuelven inestables, por razones que no se comprenden completamente, y los iones ionizados en fase gaseosa se desorben de las gotitas y entran en el analizador de masas.
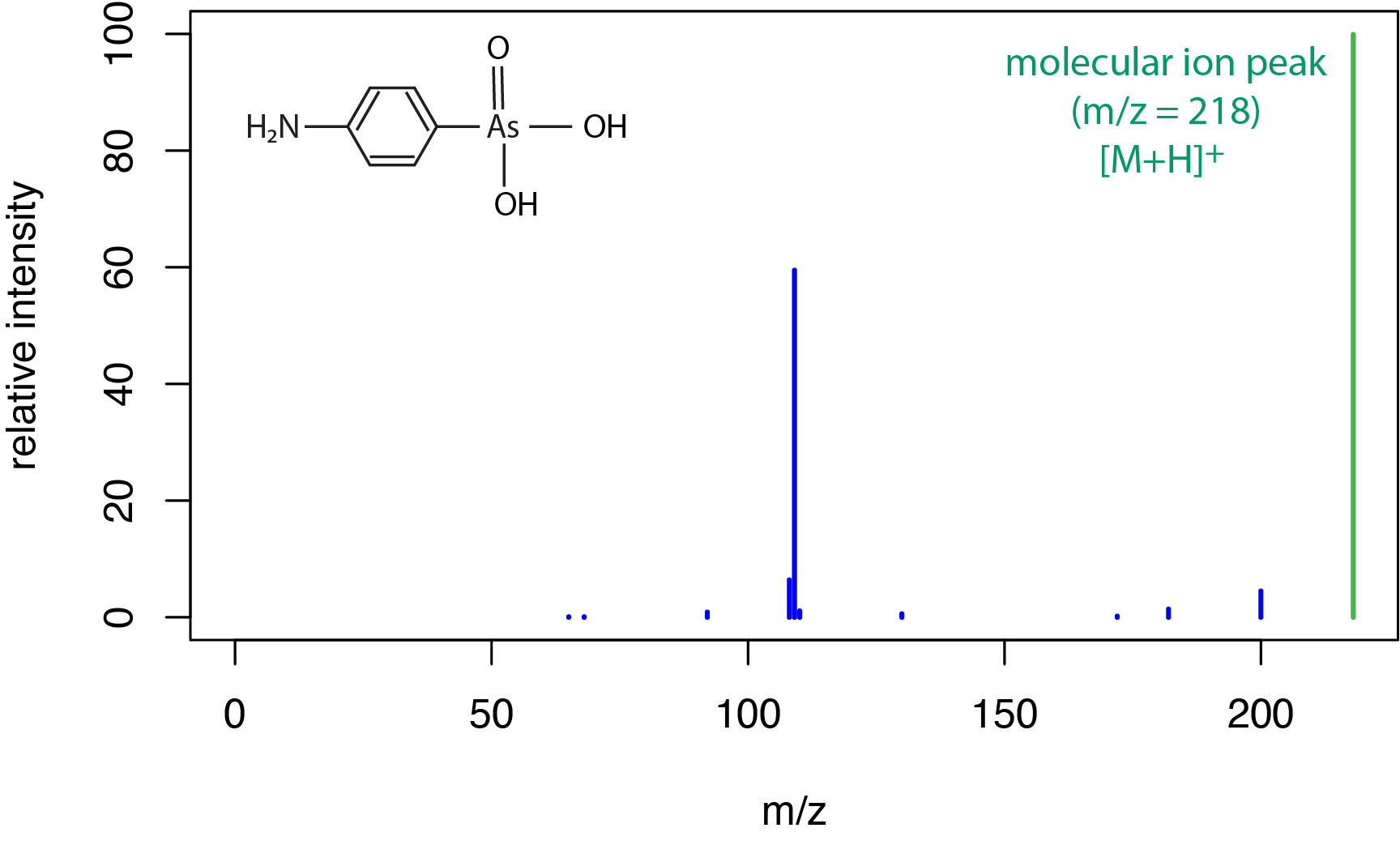
Un espectro de masas de ionización por electrospray típico para una molécula pequeña se muestra en la Figura\(\PageIndex{5}\) para el compuesto ácido (4-aminofenil) arsónico. Como vimos en la Figura\(\PageIndex{3}\) para la ionización química, una fuente de ionización blanda da como resultado una cantidad limitada de fragmentación y un fuerte pico para el ion molecular, que aquí incluye una transferencia de protones para dar el pico [M + H] + a un m/z de 218 amu.
La ionización por electropulverización es particularmente útil para moléculas biológicas, como péptidos y proteínas, ya que la ionización suave asegura que se retenga la información del peso molecular. Debido a que estas moléculas son grandes, captan fácilmente múltiples protones, formando iones de carga múltiple de la forma general [M + z H] z + donde z es el número de protones añadidos. La Figura\(\PageIndex{6}\) muestra un espectro hipotético para la molécula M y la Tabla\(\PageIndex{1}\) proporciona los valores m/ z correspondientes para los picos del espectro de masas.
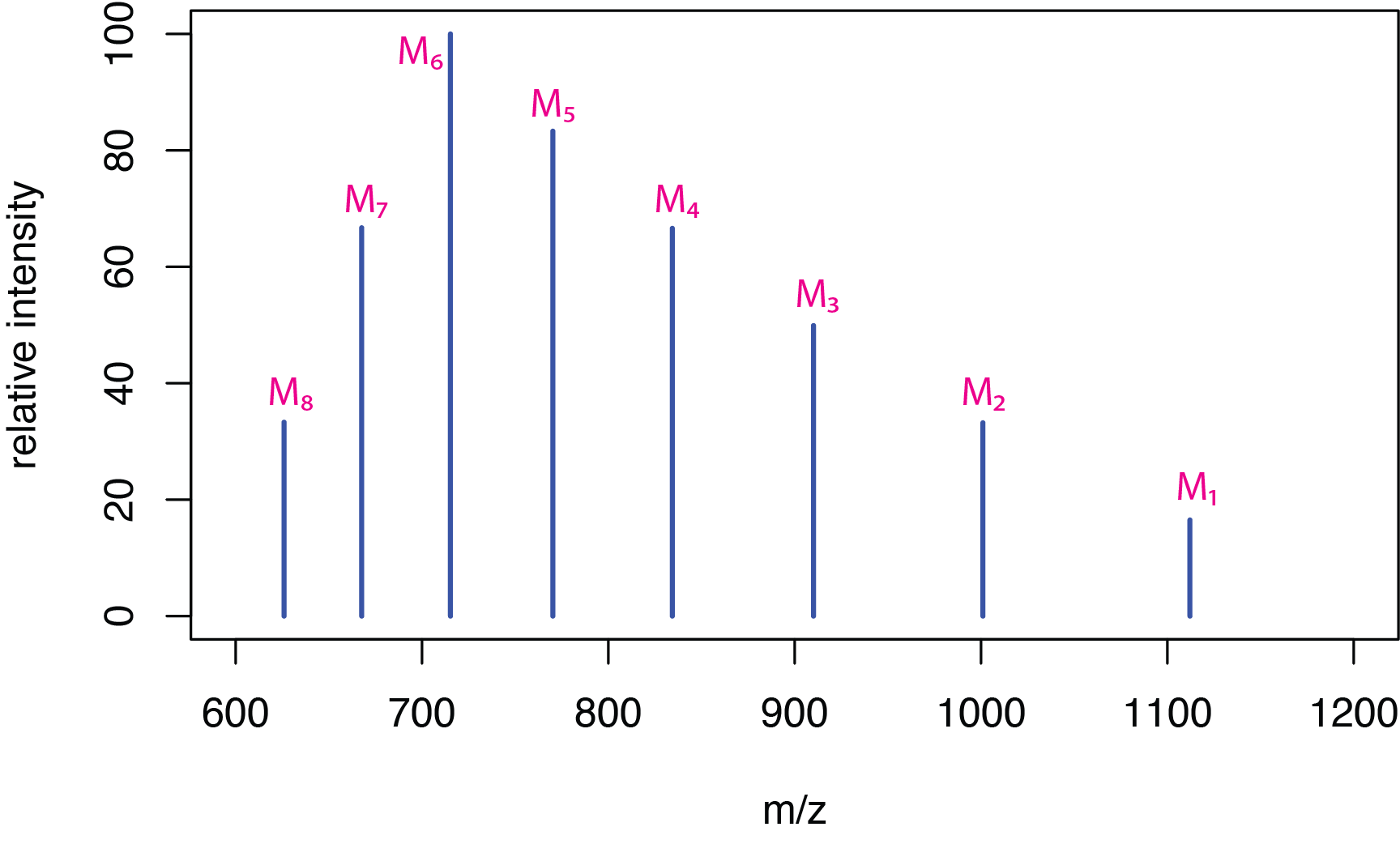
| pico | m/z |
|---|---|
| M 1 | 1112 |
| M 2 | 1001 |
| M 3 | 910 |
| M 4 | 834 |
| M 5 | 770 |
| M 6 | 715 |
| M 7 | 667 |
| M 8 | 626 |
Si tomamos las relaciones masa-carga para dos picos adyacentes cualesquiera,\(M_i\) y\(M_j\), donde el pico\(M_i\) tiene el mayor valor para m/z, y si asumimos que\(M_j\) tiene un átomo de hidrógeno adicional, dándole una carga que es una unidad más alta, entonces
\[Z_i = \frac{M_j - 1}{M_i - M_j} \label{findz} \]
donde\(Z_i\) esta la carga en el ion\(M_i\). Tabla\(\PageIndex{2}\) muestra las cargas calculadas para los iones\(M_1\) a\(M_7\).
Aquí hay una derivación para Ecuación\ ref {findz}. Supongamos que la molécula de interés tiene un peso molecular de\(m\). Si la carga en el ion responsable del pico\(M_i\) es\(Z\), entonces debe darse el caso de que la masa del pico sea igual a m + Z ya que tiene hidrógenos adicionales Z y debe darse el caso de que su relación masa/carga sea
\[M_i = \frac{m + Z}{Z} \nonumber \]
y su peso molecular,\(m\), es
\[m = (M_i \times Z) - Z \nonumber \]
De la misma manera, el pico\(M_j\) tiene una carga de\(Z + 1\) y
\[M_j = \frac{m + Z + 1}{Z + 1} \nonumber \]
\[m = (M_j \times Z )+ M_j - Z - 1 \nonumber \]
Establecer las dos ecuaciones para\(m\) iguales entre sí y resolver para\(Z\) da
\[(M_i \times Z) - Z = (M_j \times Z) + M_j - Z - 1 \nonumber \]
\[(M_i \times Z) = (M_j \times Z) + M_j - 1 \nonumber \]
\[(M_i \times Z) - (M_j \times Z) = M_j - 1 \nonumber \]
\[Z = \frac{M_j - 1}{M_i - M_j} \nonumber \]
| pico | m/z | Z |
|---|---|---|
| M 1 | 1112 | 9 |
| M 2 | 1001 | 10 |
| M 3 | 910 | 11 |
| M 4 | 834 | 12 |
| M 5 | 770 | 13 |
| M 6 | 715 | 14 |
| M 7 | 667 | 15 |
| M 8 | 626 | — |
El peso molecular,\(m\), viene dado por la ecuación
\[m = (M_i \times Z) - Z \label{findmw} \]
En el cuadro se\(\PageIndex{3}\) muestran los pesos moleculares de los iones\(M_1\) a\(M_7\) y su valor promedio. El espectro de masas simulado se creó estableciendo el peso molecular en 10,000 amu y con cargas que variaron de +9 a +16.
| pico | m/z | Z | \(m\) |
|---|---|---|---|
| M 1 | 1112 | 9 | \ (m\) ">9.999 |
| M 2 | 1001 | 10 | \ (m\) ">10,000 |
| M 3 | 910 | 11 | \ (m\) ">9.999 |
| M 4 | 834 | 12 | \ (m\) ">9.996 |
| M 5 | 770 | 13 | \ (m\) ">9.997 |
| M 6 | 715 | 14 | \ (m\) ">9.996 |
| M 7 | 667 | 15 | \ (m\) ">10.005 |
| M 8 | 626 | — | \ (m\) ">— |
| peso molecular promedio | \ (m\) ">9.999 | ||
Fuentes de desorción/ionización láser asistidas por matriz (fase sólida/fuente blanda)
La ionización por desorción láser asistida por matriz (MALDI) es una fuente de ionización suave para obtener el espectro de masas para moléculas biológicamente importantes, como proteínas y péptidos. La figura\(\PageIndex{7}\) ilustra los pasos básicos en la obtención de un espectro MALDI. La muestra se mezcla primero con una molécula pequeña, que se llama matriz, para formar una solución; la matriz generalmente está presente en una proporción de 10:1. Una gota de esta mezcla se coloca sobre una sonda de muestra y se deja secar, dejando la muestra en forma sólida. Un rayo láser pulsado (\(\lambda = 237\)nm es típico) se enfoca en la mezcla de muestra sólida-matriz. La matriz absorbe el pulso láser y la absorción de la energía del láser volatiliza tanto la matriz como la muestra. La ionización de la muestra forma iones moleculares, generalmente iones [M + H] +, que luego se barren en el analizador de masas.

Cuando la muestra es una digestión de una proteína, entonces es una mezcla de péptidos, cada uno de los cuales aparece como un pico [M + H] + en el espectro de masas resultante. Por ejemplo, un péptido con la secuencia AWSVAR (alanina-triptófano-serina—valina—alanina-arginina) aparecerá como un pico con una masa de 689.8 daltons. Para encontrar este valor sumamos los pesos moleculares de los aminoácidos, damos cuenta de la pérdida de una molécula de agua por cada enlace peptídico que se forma, y luego se da cuenta del hidrógeno que da el ion [M + H] +. En este caso tenemos
\[ \ce{[M + H]^+} = 89.1 + 204.2 + 105.1 + 117.1 + 89.1 + 174.2 - (5 \times 18.0) + 1 = 689.8 \text{ amu} \nonumber \]
donde el término\(5 \times 18.0\) da cuenta de la pérdida de cinco moléculas\(\ce{H2O}\) al formar los cinco enlaces peptídicos.
Fuentes de bombardeo de átomos rápidos (fase líquida/fuente blanda)
El bombardeo atómico rápido (FAB) tiene cierta similitud con MALDI: la muestra se mezcla con una matriz líquida (a menudo glicerol) y se bombardea con un haz de átomos de xenón o argón (en lugar de un láser). La desorción de la muestra de su matriz forma iones en fase gaseosa que son barridos en el analizador de masas. Los espectros suelen contener tanto un ion molecular como patrones de fragmentación.


