20.4: Aplicaciones de la Espectrometría de Masas Moleculares
- Page ID
- 78924
Aplicaciones Cualitativas
En un análisis cualitativo nuestro interés es determinar la identidad de una sustancia de interés para nosotros. Por sí misma, la espectrometría de masas es una poderosa herramienta para determinar la identidad de los compuestos puros. El análisis de mezclas, sin embargo, es posible si utilizamos un espectrómetro de masas como detector para una técnica de separación, como la cromatografía de gases, o si encadenamos dos o más analizadores de masas en secuencia.
Identificación de Compuestos Puros
Hay varias formas de usar un espectro de masas para identificar un compuesto, incluyendo la identificación de su peso molecular, el uso de relaciones isotópicas, el examen de patrones de fragmentación y la búsqueda a través de bases de datos.
Uso de Información de Peso Molecular. Un pico de iones moleculares, M +•, cuando está presente, un pico [M + H] + o un pico [M — H] +, proporciona información sobre el peso molecular del compuesto. Cuando se utiliza un analizador de masas de baja resolución, esto puede ser suficiente para distinguir entre iones moleculares con, por ejemplo, una masa nominal de 95 amu y una masa nominal de 96 amu, pero insuficiente para distinguir entre iones moleculares con una masa más precisa de 96.0399 amu y 96.0575 amu. Cuando se utiliza un analizador de masas de alta resolución, la diferencia entre el último par de iones moleculares puede ser factible.
Usando Ratios Isotópicos. La molécula ciclohepteno tiene la fórmula C 7 H 12 y una masa nominal de 96 amu, y la molécula ciclohexenona tiene la fórmula C 6 H 8 O y una masa nominal de 96 amu. Aunque ambas moléculas producirán un ion molecular con la misma relación masa-carga nominal, cada una también tendrá un pico con una masa nominal de M+ 1 debido a la presencia de isótopos de carbono, hidrógeno y oxígeno. Debido a que el ciclohepteno y la ciclohexenona tienen diferentes fórmulas químicas, las alturas relativas de sus picos M + 1 son diferentes. Aquí es cómo podemos resolver esto.
Por cada 100 átomos de 12 C hay 1.08 átomos de 13 C (es decir, 1.08% de los átomos de carbono son 13 C), por cada 100 átomos de 1 H hay 0.015 átomos de 2 H, y por cada 100 átomos de 16 O hay 0.04 átomos de 17 O. Para el ciclohepteno, esto significa que la altura relativa de su pico M + 1 a su pico M es
\[(7 \times 1.08) + (12 \times 0.015) = 7.74 \nonumber \]
y para ciclohexenona tenemos
\[(6 \times 1.08) + (8 \times 0.015) + (1 \times 0.04) = 6.64 \nonumber \]
Aquí vemos que un examen cuidadoso de la altura relativa del pico M + 1 proporciona una manera de distinguir entre C 7 H 12 y C 6 H 8 O aunque tengan las mismas masas nominales. Hay calculadoras en línea disponibles, este enlace proporciona un ejemplo, que puede usar para calcular los patrones de abundancia isotópica completos, incluidos M + 2, M + 3 y otros picos. Los patrones isotópicos son particularmente útiles para identificar la presencia de cloro y bromo en una molécula porque cada uno tiene un isótopo con una abundancia significativa: para el cloro, 37 Cl tiene una abundancia de 32.5% con relación a 35 Cl, y para el bromo, 81 Br tiene una abundancia de 98.0% de 79 Br.
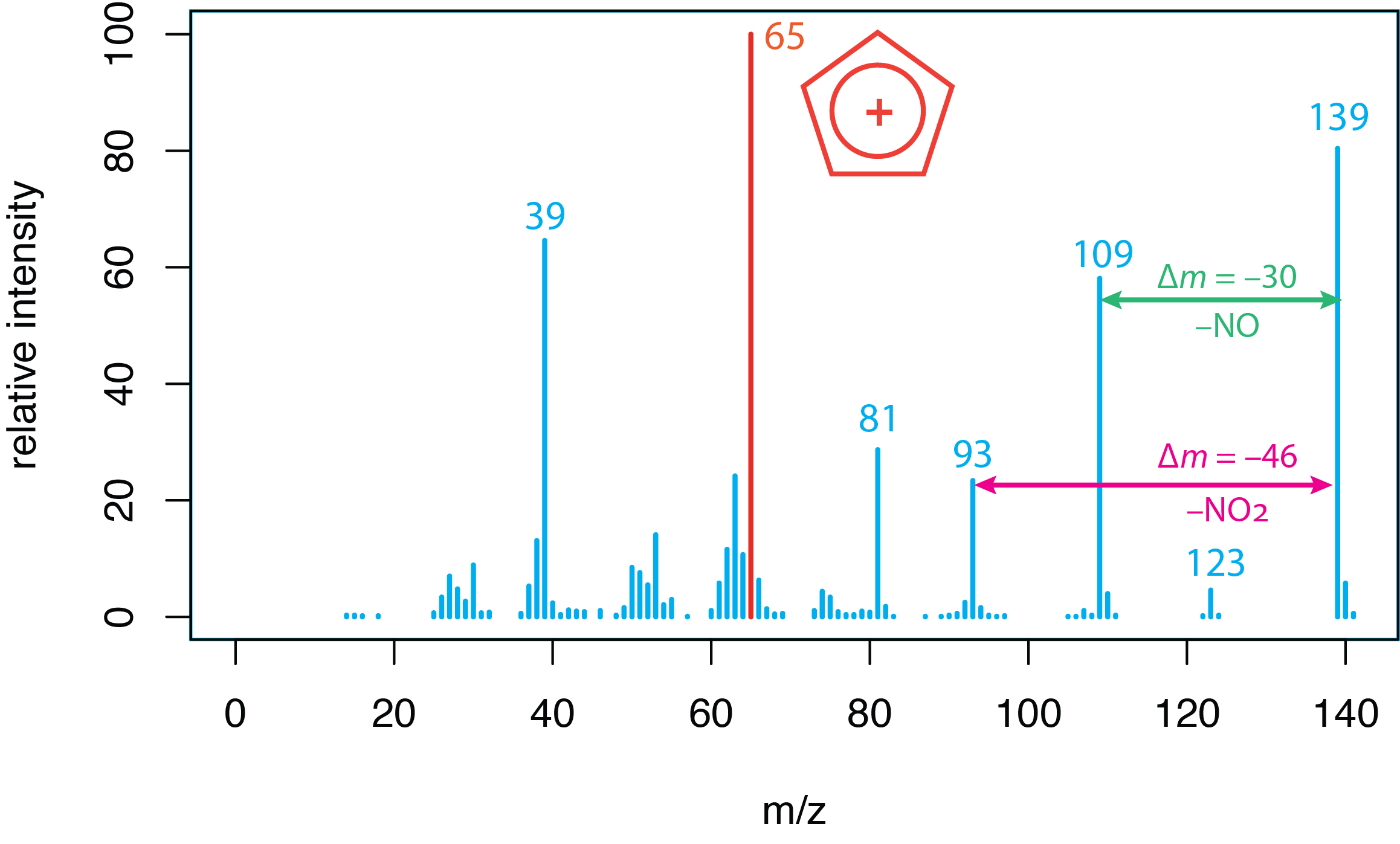
Usando Patrones de Fragmentación. La figura\(\PageIndex{1}\) muestra el espectro de masas del p-nitrofenol, el cual consideramos por primera vez en la Sección 20.1. El espectro de masas de una molécula es único y contiene información que podemos usar para deducir su estructura. La interpretación de un espectro de masas se basa en identificar posibles fuentes para la pérdida de masa, como la a\(\Delta m\) de 30 amu correspondiente a la pérdida de NO, o a\(\Delta m\) de 46 amu correspondiente a la pérdida de NO 2. Algunas relaciones masa-carga se reconocen como evidencia para un ion particular, como C 5 H 5 + a una relación masa/carga de 65. La interpretación de los patrones de fragmentación está cubierta en otra parte del plan de estudios, particularmente en la química orgánica, y no se le da más consideración aquí.
Usando la Búsqueda por Computadora. Grandes bases de datos de espectros de masas están disponibles (vea aquí una fuente del NIST). Se ingresa una tabla de picos de relaciones masa-carga e intensidades de pico para una muestra en un algoritmo que busca en la base de datos e identifica las coincidencias más probables.
Análisis de Mezclas Usando MS como Detector para una Separación GC o LC
La espectrometría de masas es una poderosa técnica analítica cuando la muestra que estamos analizando es pura (o si las impurezas son de concentración suficientemente baja que tienen poco efecto sobre el espectro de masas). Para una mezcla de dos o más analitos, la interpretación del espectro de masas es difícil, si no imposible. Para analizar tal mezcla, necesitamos un medio para separar los analitos entre sí. Un enfoque es interconectar un espectrómetro de masas con un cromatógrafo de gases o un cromatógrafo de líquidos. El GC, o LC separa la mezcla en sus partes componentes con el espectrómetro de masas que sirve como detector. Consulte el Capítulo 27 y el Capítulo 28 para obtener más detalles sobre CG-MS y LC-MS.
Análisis de mezclas mediante espectrometría de masas en tándem
Otro enfoque para trabajar con una muestra compleja es utilizar dos o más analizadores de masas en lo que se denomina espectrometría de masas en tándem. Por ejemplo, si colocamos tres analizadores de masas cuadrupolares en una secuencia, podemos usar una fuente de ionización suave para generar principalmente iones moleculares de la forma [M+ H] + para cada uno de los analitos de la muestra, y luego dejar que el primer cuadrupolo separe estos iones moleculares por las diferencias en su masa a- relación de carga. Los iones moleculares [M + H] + para uno de los analitos se pasan entonces selectivamente al segundo cuadrupolo donde se permite que sufra fragmentación por colisión con un gas, como el He. Finalmente, estos iones fragmentos se pasan a lo largo del tercer cuadrupolo donde se obtiene el espectro de masas. Al pasar secuencialmente cada uno de los iones moleculares desde el primer cuadrupolo a través del segundo y tercer cuadrupolo, podemos obtener espectros de masas para cada molécula de la mezcla.
Aplicaciones Cuantitativas
Como detector para otros métodos instrumentales, como la cromatografía de gases y la cromatografía líquida, la espectrometría de masas proporciona un análisis cuantitativo monitoreando el recuento total de iones o monitoreando iones de una sola relación masa/carga, lo que se conoce como monitoreo selectivo de iones. Como método independiente para determinar la concentración de un analito, la espectrometría de masas es menos atractiva debido a la dificultad de controlar la cantidad de muestra o patrón introducido en el instrumento y el efecto de la matriz de la muestra sobre la fragmentación. El uso de un estándar interno mejora la precisión y la precisión.


