22.1: Celdas Electroquímicas
- Page ID
- 78699
En la Figura se muestra un diagrama esquemático de una celda electroquímica típica\(\PageIndex{1}\). La celda electroquímica consta de dos medias celdas, cada una de las cuales contiene un electrodo sumergido en una solución de iones cuyas actividades determinan el potencial del electrodo. Un puente salino que contiene un electrolito inerte, como KCl, conecta las dos medias celdas. Los extremos del puente salino se fijan con fritas porosas, que permiten que los iones del electrolito se muevan libremente entre las medias celdas y el puente salino. Este movimiento de iones en el puente salino completa el circuito eléctrico, permitiéndonos medir el potencial usando un potenciómetro.
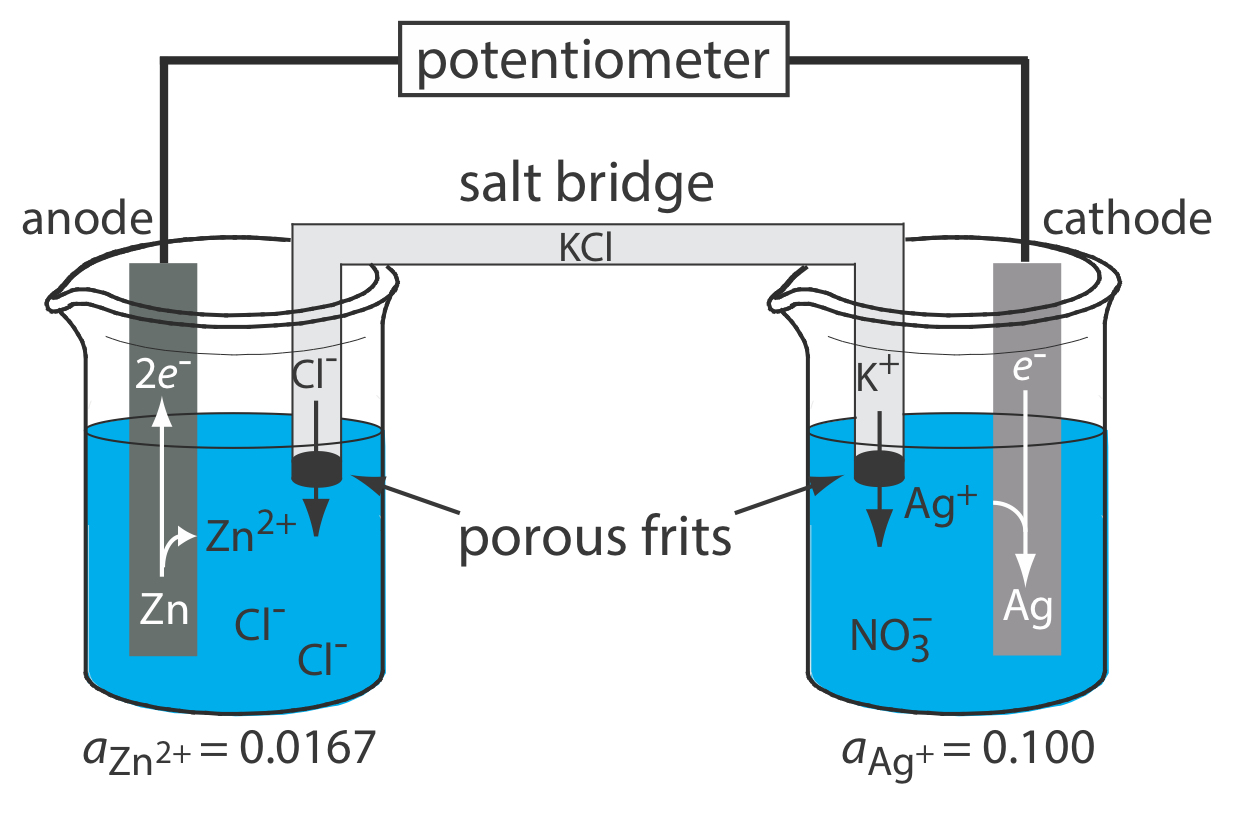
La razón para separar los electrodos es evitar que la reacción de oxidación y la reacción de reducción ocurran en el mismo electrodo. Por ejemplo, si colocamos una tira de metal Zn en una solución de AgnO 3, la reducción de Ag + a Ag ocurre en la superficie del Zn al mismo tiempo que una porción del metal Zn se oxida a Zn 2 +. Debido a que la transferencia de electrones de Zn a Ag + ocurre en la superficie del electrodo, no podemos pasarlos a través del potenciómetro.
Conducción en una célula
La corriente se mueve a través de la célula en la Figura\(\PageIndex{1}\) como resultado del movimiento de dos tipos de partículas cargadas: electrones e iones. Primero, cuando el zinc, Zn (s) infrogen una reacción de oxidación
\[\mathrm{Zn}(s) \rightleftharpoons \text{ Zn}^{2+}(a q)+2 e^{-} \label{ox_rxn} \]
libera dos electrones. Estos electrones se mueven a través del circuito que conecta el electrodo metálico de Zn en la semicelda izquierda al electrodo metálico de Ag en la semicelda derecha, donde efectúa la reducción de Ag + (aq).
\[\mathrm{Ag}^{+}(a q)+e^{-} \rightleftharpoons \mathrm{Ag}(s) \label{red_rxn} \]
Si esto es todo lo que sucede, entonces la media celda de la izquierda desarrollará un exceso de carga positiva a medida que se acumulan iones Zn 2 + (aq) y la media celda de la derecha desarrollará un exceso de carga negativa debido a la pérdida de Ag + (aq). El puente salino proporciona una manera de continuar el movimiento de la carga, y por lo tanto la corriente, con los iones K + moviéndose hacia la media celda derecha y los iones Cl, moviéndose hacia la semicelda izquierda.
Celdas galvánicas y electrolíticas
La reacción neta para la celda electroquímica en la Figura\(\PageIndex{1}\) es
\[\mathrm{Zn}(s)+2 \mathrm{Ag}^{+}(a q) \rightleftharpoons 2 \mathrm{Ag}(s)+\mathrm{Zn}^{2+}(\mathrm{aq}) \label{net_rxn} \]
que simplemente es el resultado de sumar las reacciones en las dos medias celdas después de ajustar por la diferencia de electrones. Como muestran las flechas de la figura, cuando conectamos los electrodos al potenciómetro, la corriente fluye espontáneamente de la semicelda izquierda a la media celda derecha. A esto lo llamamos una celda galvánica. Si aplicamos un potencial suficiente para invertir la dirección del flujo de corriente, resultando en una reacción neta de
\[2 \mathrm{Ag}(s)+\mathrm{Zn}^{2+}(\mathrm{aq}) \rightleftharpoons \mathrm{Zn}(s)+2 \mathrm{Ag}^{+}(a q) \nonumber \]
entonces llamamos al sistema una celda electrolítica. Una celda galvánica produce energía eléctrica y una celda electrolítica consume energía eléctrica.
Ánodos y cátodos
La semicelda donde tiene lugar la oxidación se llama ánodo y, por convención, se muestra a la izquierda para una celda galvánica. La semicelda donde tiene lugar la reducción se llama cátodo y, por convención, se muestra a la derecha para una celda galvánica.
Corrientes Faradaicas y No Faradaicas
Cuando oxidamos o reducimos un analito en el electrodo en una semicelda, los electrones pasan a través del potenciómetro hasta el electrodo en la otra semicelda donde tiene lugar una reacción de reducción u oxidación correspondiente. En cualquier caso, la corriente de las reacciones redox en los dos electrodos se denomina corriente faradaica. Una corriente faradaica debida a la reducción de un analito se llama corriente catódica y lleva un signo positivo. Una corriente anódica resulta de la oxidación del analito y lleva un signo negativo.
Además de la corriente faradaica de una reacción redox, la corriente en una celda electroquímica incluye fuentes no faradaicas. Supongamos que la carga en un electrodo es cero y de repente cambiamos su potencial para que la superficie del electrodo adquiera una carga positiva. Los cationes cerca de la superficie del electrodo responderán a esta carga positiva migrando lejos del electrodo; los aniones, por otro lado, migrarán hacia el electrodo. Esta migración de iones ocurre hasta que la carga superficial positiva del electrodo y el exceso de carga negativa de la solución cerca de la superficie del electrodo son iguales. Debido a que el movimiento de iones y el movimiento de electrones son indistinguibles, el resultado es una pequeña corriente no faradaica de corta duración que llamamos corriente de carga. Cada vez que cambiamos el potencial del electrodo, fluye una corriente de carga de corta duración.
Incluso en ausencia de analito, una pequeña corriente medible fluye a través de una celda electroquímica. Esta corriente residual tiene dos componentes: una corriente faradaica debida a la oxidación o reducción de impurezas traza y una corriente de carga no faradaica. Los métodos para discriminar entre la corriente faradaica del analito y la corriente residual se discuten más adelante en este capítulo.
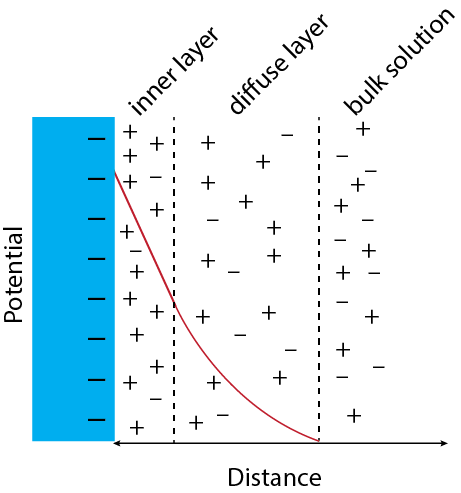
La Doble Capa Eléctrica
Como se señaló en el apartado anterior, cuando aplicamos un potencial a un electrodo desarrolla una carga superficial positiva o negativa, cuya magnitud es función del metal y del potencial aplicado. Debido a que la superficie lleva una carga, la composición de la capa de solución inmediatamente adyacente al electrodo cambia con, por ejemplo, la concentración de cationes aumentando y disminuyendo la concentración de aniones si la superficie del electrodo lleva una carga negativa. A medida que nos alejamos de la superficie del electrodo, el potencial neto primero disminuye de manera lineal, debido al desequilibrio de los cationes y aniones, y luego de manera exponencial hasta llegar a cero. Esta superficie estructurada se llama la doble capa eléctrica y consiste en una capa interna y una capa difusa. Cada vez que cambiamos el potencial aplicado al electrodo, la estructura de la doble capa eléctrica cambia y fluye una pequeña corriente de carga.
Transferencia de masa en celdas con paso de corriente
La magnitud de una corriente faradaica está determinada por la velocidad a la que el analito se oxida en el ánodo o se reduce en el cátodo. Dos factores contribuyen a la velocidad de una reacción electroquímica: la velocidad a la que los reactivos y productos son transportados hacia y desde el electrodo, lo que llamamos transporte de masa, y la velocidad a la que los electrones pasan entre el electrodo y los reactivos y productos en solución.
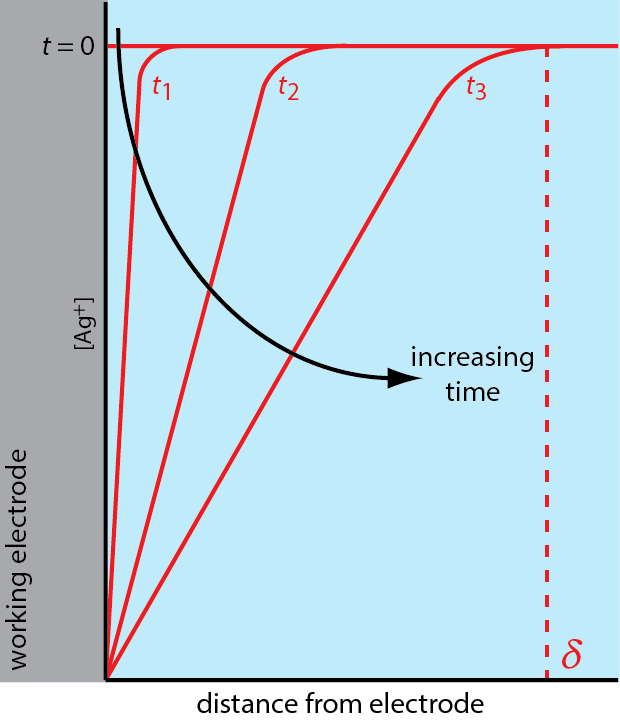
Hay tres modos de transporte de masa que afectan la velocidad a la que los reactivos y productos se mueven hacia o lejos de la superficie del electrodo: difusión, migración y convección. La difusión ocurre siempre que la concentración de un ion o una molécula en la superficie del electrodo es diferente de la de la solución a granel. Por ejemplo, si aplicamos un potencial suficiente para reducir completamente\(\text{Ag}^+\) en la superficie del electrodo, el resultado es un gradiente de concentración similar al mostrado en la Figura\(\PageIndex{3}\). La región de solución sobre la que se produce la difusión es la capa de difusión. A falta de otros modos de transporte masivo, el ancho de la capa de difusión,\(\delta\), aumenta con el tiempo ya que el\(\text{Ag}^+\) mosto se difunde desde una distancia cada vez mayor.
La convección ocurre cuando mezclamos la solución, que lleva los reactivos hacia el electrodo y elimina los productos del electrodo. La forma más común de convección es agitar la solución con una barra agitadora; otros métodos incluyen rotar el electrodo e incorporar el electrodo a una celda de flujo.
El modo final de transporte de masa es la migración, que ocurre cuando una partícula cargada en solución es atraída o repelida de un electrodo que porta una carga superficial. Si el electrodo lleva una carga positiva, por ejemplo, un anión se moverá hacia el electrodo y un catión se moverá hacia la solución a granel. A diferencia de la difusión y convección, la migración afecta únicamente al transporte masivo de partículas cargadas.
Representaciones esquemáticas de celdas
Aunque la Figura\(\PageIndex{1}\) proporciona una imagen útil de una celda electroquímica, no es una manera conveniente de representarla. ¡Imagina tener que dibujar una imagen de cada celda electroquímica que estás usando! Una forma más útil de describir una celda electroquímica es una notación taquigráfica que utiliza símbolos para identificar diferentes fases y que enumera la composición de cada fase. Utilizamos una barra vertical (|) para identificar un límite entre dos fases donde se desarrolla un potencial, y una coma (,) para separar especies en la misma fase o para identificar un límite entre dos fases donde no se desarrolla potencial. Las notaciones de celdas cortas comienzan con el ánodo y continúan hasta el cátodo. Por ejemplo, describimos la celda electroquímica en la Figura\(\PageIndex{1}\) usando la siguiente notación taquigráfica.
\[\text{Zn}(s) | \text{ZnCl}_2(aq, a_{\text{Zn}^{2+}} = 0.0167) || \text{AgNO}_3(aq, a_{\text{Ag}^+} = 0.100) | \text{Ag} (s) \nonumber \]
La doble barra vertical (||) representa el puente de sal, cuyo contenido generalmente no enumeramos. Tenga en cuenta que una doble barra vertical implica que hay una diferencia de potencial entre el puente de sal y cada media celda.
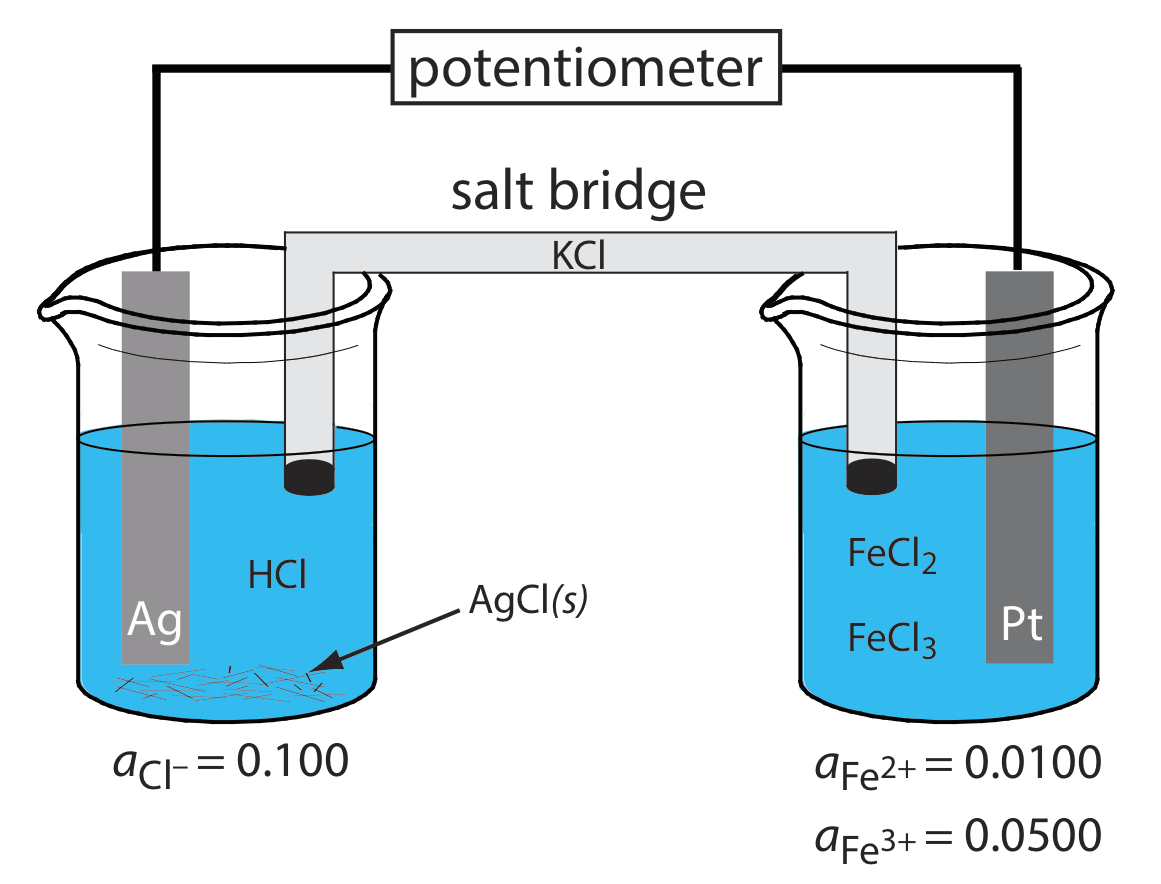
¿Cuáles son las reacciones anódicas, catódicas y globales responsables del potencial de la celda electroquímica en la Figura\(\PageIndex{4}\)? Escriba la notación taquigráfica para la celda electroquímica.
Solución
La oxidación de Ag a Ag + ocurre en el ánodo, que es la semicelda izquierda. Debido a que la solución contiene una fuente de Cl, la reacción anódica es
\[\mathrm{Ag}(s)+\mathrm{Cl}^{-}(aq) \rightleftharpoons\text{ AgCl}(s)+e^{-} \nonumber \]
La reacción catódica, que es la semicelda derecha, es la reducción de Fe 3 + a Fe 2 +.
\[\mathrm{Fe}^{3+}(a q)+e^{-}\rightleftharpoons \text{ Fe}^{2+}(a q) \nonumber \]
La reacción celular global, por lo tanto, es
\[\mathrm{Ag}(s)+\text{ Fe}^{3+}(a q)+\text{ Cl}^{-}(a q) \rightleftharpoons \mathrm{AgCl}(s)+\text{ Fe}^{2+}(a q) \nonumber \]
La notación taquigráfica de la celda electroquímica es
\[\text{Ag}(s) | \text{HCl} (aq, a_{\text{Cl}^{-}} = 0.100), \text{AgCl} (\text{sat’d}) || \text{FeCl}_2(aq, a_{\text{Fe}^{2+}} = 0.0100), \text{ Fe}^{3+}(aq,a_{\text{Fe}^{3+}} = 0.0500) | \text{Pt} (s) \nonumber \]
Tenga en cuenta que el cátodo de Pt es un electrodo inerte que transporta electrones a la media reacción de reducción. El electrodo en sí no sufre reducción.